




新高考化学一轮复习讲义课件 第2章 第10讲 氧化还原反应的基本概念
展开1.了解氧化还原反应的概念。2.掌握氧化还原反应与四种基本反应类型的关系。3.会用“单、双线桥”分析电子转移的方向和数目。4.掌握氧化性、还原性强弱的比较及应用。
考点一 氧化还原反应与四种基本反应类型
考点二 氧化还原反应的概念
考点三 氧化性、还原性强弱的比较
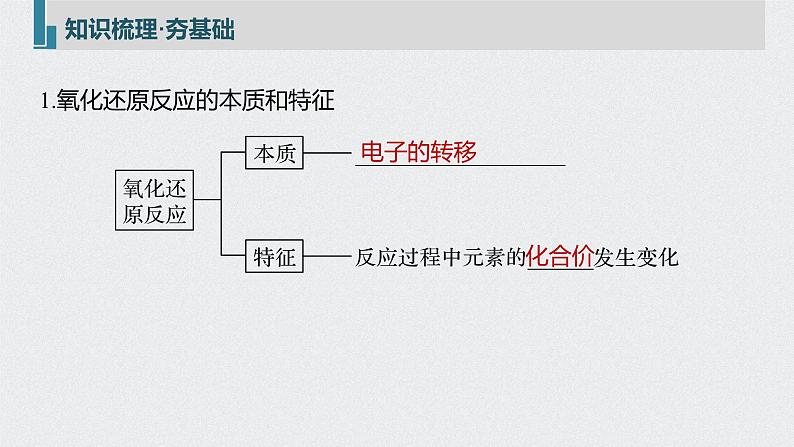
1.氧化还原反应的本质和特征
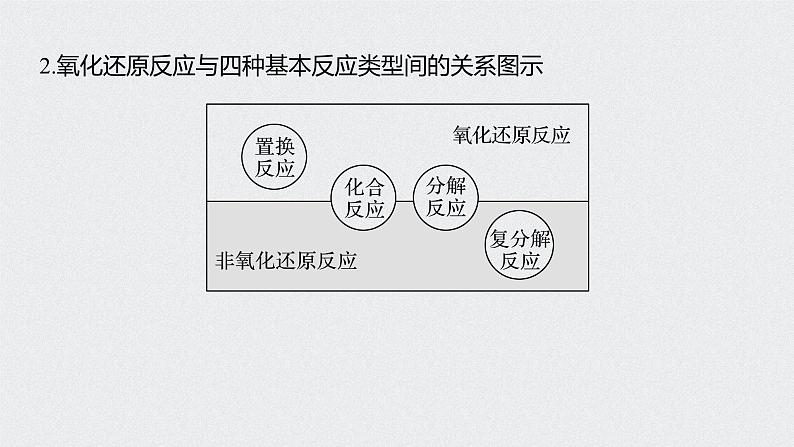
2.氧化还原反应与四种基本反应类型间的关系图示
(1)有单质参加或单质生成的化学反应一定是氧化还原反应( )错因: 。(2)无单质参加的化合反应一定不是氧化还原反应( )错因: 。(3)Na2O2和SO2的反应是氧化还原反应( )错因: 。
如同素异形体之间的转化属于非氧化还原反应
如H2O2+SO2===H2SO4属于氧化还原反应
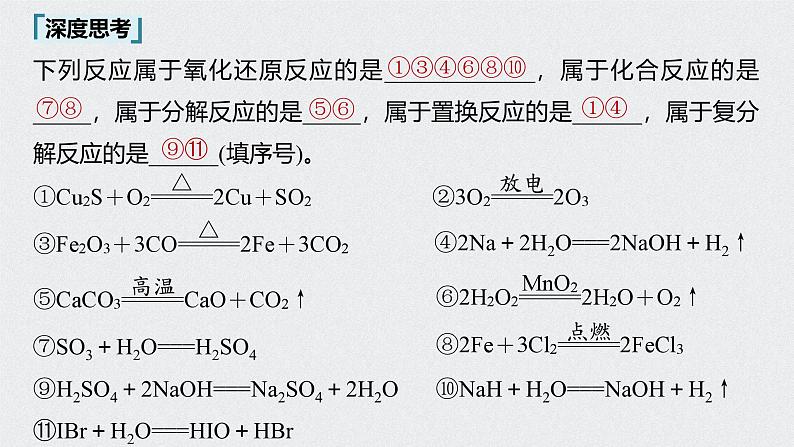
下列反应属于氧化还原反应的是_____________,属于化合反应的是_____,属于分解反应的是_____,属于置换反应的是______,属于复分解反应的是______(填序号)。
④2Na+2H2O===2NaOH+H2↑
⑦SO3+H2O===H2SO4
⑨H2SO4+2NaOH===Na2SO4+2H2O ⑩NaH+H2O===NaOH+H2↑⑪IBr+H2O===HIO+HBr
1.(2020·北京密云区一模)下列颜色变化与氧化还原反应有关的是A.氨气遇到HCl气体后产生白烟B.品红溶液通入SO2气体后褪色C.湿润的淀粉碘化钾试纸遇Cl2变蓝D.在无色火焰上灼烧NaCl火焰呈黄色
2.(2020·天津市静海区大邱庄中学模拟)下列化学反应属于区域3的是
A.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.Zn+H2SO4===ZnSO4+H2↑
解析 A项,该反应中有元素化合价的变化,因此属于氧化还原反应;反应物是三种,生成物只有一种,反应类型属于化合反应,但不属于区域3,不符合题意;B项,该反应中没有元素化合价的变化,因此不属于氧化还原反应;反应物是一种,生成物是多种,属于分解反应,但不属于区域3,不符合题意;
C项,该反应中有元素化合价的变化,因此属于氧化还原反应;该反应不属于任意一种基本反应类型,但属于区域3,符合题意;D项,该反应中有元素化合价的变化,因此属于氧化还原反应;反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应,但不属于区域3,不符合题意。
故①②③均属于氧化还原反应、置换反应,A正确;B、C错误;③不属于复分解反应,D错误。
1.基于双线桥理解氧化还原反应概念之间的关系
概括为“升失氧、降得还,剂性一致、其他相反”。
2.常见的氧化剂和还原剂(1)常见氧化剂常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
(2)常见还原剂常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
(3)元素化合价处于中间价态的物质既有氧化性,又有还原性
(1)金属阳离子一定只具有氧化性( )错因: 。(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )错因: 。(3)氧化还原反应中的反应物,不是氧化剂就是还原剂( )错因: 。
Fe2+既有氧化性,又有还原性
Cl2和NaOH反应,氯元素既被氧化,又被还原
Cl2和NaOH的反应,NaOH是反应物,既不是氧化剂,又不是还
(4)某元素从游离态变为化合态,该元素可能被氧化也可能被还原( )错因:。(5)CaO2与水发生氧化还原反应时,CaO2只作氧化剂( )错因: 。
CaO2和H2O反应,CaO2既是氧化剂又是还原剂
1.用双线桥法标出MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O反应电子转移的方向和数目:________________________________________。此反应中氧化剂是______,还原剂是____,氧化产物是____,还原产物是_______,MnO2发生_____反应,HCl发生_____反应;生成1 ml Cl2时转移电子数目为_____,被氧化的HCl的物质的量是___ ml,盐酸表现的性质是_____性和____性。
2.下列标明电子转移的方向和数目的化学方程式中,正确的是______(填序号)。
其中①中MnO2的作用:_______。②中Cl2表现的性质:_______________。③中氧化产物和还原产物的质量比为______。④中氧化剂与还原剂物质的量之比为______。
题组一 氧化还原反应概念的判断
1.下列所加物质的作用与其还原性有关的是
解析 腌咸菜加氯化钠,不存在元素化合价的变化,不是氧化还原反应,A不合题意;食用盐中加碘酸钾,没有发生化学变化,不表现还原性,B不合题意;红酒中添加SO2,SO2具有还原性,可以防止红酒被氧化变质,所以与SO2的还原性有关,C符合题意;生活用水消毒加入次氯酸钙是由于次氯酸钙能与空气中的CO2和H2O生成具有强氧化性的HClO,利用其氧化性,D不合题意。
2.(2020·青岛通济实验学校月考)海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生作用以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4,下列说法正确的是A.溴发生了还原反应B.二氧化硫在反应中被还原C.溴在反应中失去电子D.该反应既是化合反应又是氧化还原反应
解析 因Br元素的化合价由0降低为-1价,Br2在反应中作氧化剂,表现氧化性,发生了还原反应,选项A正确;S元素的化合价由+4价升高到+6价,SO2作还原剂,被氧化,选项B错误;Br元素的化合价由0降低为-1价,则Br2在反应中得到电子,选项C错误;该反应的生成物为两种,不属于化合反应;反应中溴元素、硫元素化合价发生变化,属于氧化还原反应,选项D错误。
题组二 基于双线桥分析复杂氧化还原反应
3.(2020·江西赣州模拟)制取新型水处理剂ClO2的化学方程式为2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法错误的是A.KClO3在反应中得到电子B.ClO2是还原产物C.H2C2O4在反应中被氧化D.1 ml KClO3参加反应有2 ml电子转移
解析 反应中氯元素的化合价由+5降低为+4,则KClO3为氧化剂,在反应中得到电子,A项正确;因KClO3为氧化剂,在反应中被还原,则ClO2是还原产物,B项正确;反应中碳元素的化合价由+3升高到+4,则H2C2O4为还原剂,在反应中被氧化,C项正确;反应中氯元素的化合价由+5降低为+4,1 ml KClO3参加反应有1 ml×(5-4)=1 ml电子转移,D项错误。
4.(2020·日照一模)Cu2HgI4是一种红色固体,常用作示温涂料。制备反应为2CuSO4+K2HgI4+SO2+2H2O===Cu2HgI4↓+K2SO4+2H2SO4。下列说法正确的是A.上述反应的产物Cu2HgI4中,Hg的化合价为+1B.上述反应中Hg元素与Cu元素均被还原C.上述反应中生成1 ml Cu2HgI4时,转移的电子数为4NAD.由以上信息可推知:可发生反应 2CuSO4+2NaCl+SO2+2H2O===2CuCl↓+Na2SO4+2H2SO4
解析 根据反应方程式可知,Cu2HgI4中Cu的化合价为+1价,则Hg的化合价为+2价,A选项错误;上述反应中,只有Cu元素被还原,B选项错误;上述反应中,CuSO4中Cu的化合价由+2价降至+1价,生成1 ml Cu2HgI4时,转移2 ml电子,转移的电子数为2NA,C选项错误;根据题干信息,CuSO4可与SO2在盐溶液中发生氧化还原反应,Cu2+被还原为Cu+,SO2被氧化为 ,则反应2CuSO4+2NaCl+SO2+2H2O===2CuCl↓+Na2SO4+2H2SO4可以发生,D选项正确。
走好关键第一步——正确标出元素化合价正确分析氧化还原反应中电子转移的数目,其前提是确定物质中各元素(特别是变价元素)的化合价。基本方法是先标出熟悉元素的化合价,再根据化合物中正、负化合价的代数和为零的原则求解其他元素的化合价。常见元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
1.氧化性、还原性的判断(1)氧化性是指 的性质(或能力);还原性是指 的性质(或能力)。(2)氧化性、还原性的强弱取决于得、失电子的 程度,与得、失电子数目的 无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
从元素的价态考虑:最高价态——只有 ,如:浓H2SO4、KMnO4等;最低价态——只有 ,如:金属单质、Cl-、S2-等;中间价态——既有 又有 ,如:Fe2+、S、Cl2等。
2.氧化性、还原性强弱的比较方法(1)根据化学方程式判断氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物氧化性:氧化剂 氧化产物;还原性:还原剂 还原产物。
(2)根据反应条件和产物价态高低进行判断①与同一物质反应,一般越易进行,则其氧化性或还原性就 。如Na与冷水剧烈反应,Mg与热水反应,Al与水加热反应也不明显,所以还原性:Na Mg Al;非金属单质F2、Cl2、Br2、I2与H2反应,F2与H2暗处剧烈反应并爆炸,Cl2与H2光照剧烈反应并爆炸,Br2与H2加热到500 ℃才能发生反应,I2与H2在不断加热的条件下才缓慢发生反应,且为可逆反应,故氧化性:F2 Cl2 Br2 I2。
(1)强氧化剂与强还原剂混合不一定能发生氧化还原反应( )错因: 。(2)阳离子只有氧化性,阴离子只有还原性( )错因: 。(3)元素的非金属性越强,其氧化性越强,相应单质越活泼( )错因: 。(4)金属原子失电子数越多,金属的还原性越强( )错因:________________________________________________________ 。
Fe2+除了具有氧化性,还具有还原性
氮的非金属性很强,但N2不活泼
Na、Mg在氧化还原反应中,分别失去1个、2个电子,但Na的金
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液 ⑦Fe与H2SO4溶液 ⑧Na与O2(1)由于浓度不同而发生不同氧化还原反应的是_________(填序号,下同)。(2)由于温度不同而发生不同氧化还原反应的是_________。(3)氧化还原反应不受浓度、温度影响的是_____。
解析 ⑥Fe和浓HNO3常温下钝化,加热继续反应,Fe和稀HNO3反应,HNO3被还原成NO。⑦Fe和浓H2SO4常温下钝化,加热继续反应,Fe和稀H2SO4反应生成FeSO4和H2。
根据影响因素判断氧化性、还原性强弱的方法(1)浓度:同一种物质浓度越大,氧化性(或还原性)越强。如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;还原性:浓盐酸>稀盐酸。(2)温度:同一种物质,温度越高其氧化性越强。如:热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。(3)酸碱性:同一种物质,所处环境酸(碱)性越强其氧化性(还原性)越强。
其氧化性为KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
题组一 氧化性、还原性强弱的判断
1.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
2.铋(Bi)位于元素周期表中第ⅤA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为A.I2、H2O2、KMnO4、NaBiO3B.H2O2、I2、NaBiO3、KMnO4C.NaBiO3、KMnO4、H2O2、I2D.KMnO4、NaBiO3、I2、H2O2
由②中现象可知,KMnO4氧化H2O2产生O2,自身被还原为Mn2+,则KMnO4(氧化剂)的氧化性强于H2O2的氧化性;从价态上看,高锰酸钾的氧化性一定是强于二氧化锰;由③中现象可知:碘离子被双氧水氧化成单质碘,则双氧水(氧化剂)的氧化性强于碘单质(氧化产物)的氧化性,综上所述,NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序是NaBiO3>KMnO4>H2O2>I2。
题组二 氧化性、还原性强弱的应用
解析 A项,还原性:SO2>Fe2+,符合题意;B项,还原性:SO2>I-,符合题意;C项,还原性:H2O2>SO2,与题意矛盾;D项,还原性:H2O2>Fe2+,符合题意。
4.已知C2O3在酸性溶液中易被还原成C2+,C2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.C2O3+6HCl===2CCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2
解析 根据氧化还原反应中,氧化性:氧化剂>氧化产物,可判断B中氧化性Cl2>I2;C中氧化性C2O3>Cl2;D中氧化性Fe3+>I2,这些结论与题给信息一致。对于A,由于I-的还原性强于Fe2+,所以Cl2应先氧化I-,而不是先氧化Fe2+。
假设法突破氧化还原反应能否进行先假设选项中的化学反应能够发生,依据此反应判断出还原性(或氧化性)的强弱,然后与题目提供的还原性(或氧化性)强弱顺序对照,若二者表示的还原性(或氧化性)强弱顺序一致,则此反应能够发生;若不一致,则此反应不能进行。
题组三 氧化性、还原性强弱的实验探究
5.为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
实验过程:Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。Ⅲ.当B中溶液变黄时,停止加热,关闭K2。Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是___________________________。
排出装置中的空气,防止干扰
解析 通入一段时间N2,排出装置中的空气。
(2)棉花中浸润的溶液为__________。
解析 氯气和二氧化硫都是有毒气体,可以用氢氧化钠溶液来吸收。
(3)A中发生反应的化学方程式:__________________________________________。
MnO2+4HCl(浓) MnCl2+Cl2↑
解析 A中发生二氧化锰与浓盐酸的反应,生成氯化锰、氯气和水。
(4)若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为_________________________________________。
解析 SO2通入酸性高锰酸钾溶液中二者可以发生氧化还原反应。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________(填“甲”“乙”或“丙”)。
解析 溶液显酸性,检验硫酸根离子应选择氯化钡溶液;乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则铁离子的氧化性大于二氧化硫;丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则铁离子的氧化性大于二氧化硫。
1.正误判断(1)向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色,所以Br-还原性强于Cl-( )(2015·山东理综,11C)(2)向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,加入淀粉后溶液变成蓝色,则氧化性:Cl2>I2( )(2015·广东理综,22C)(3)向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液,加入H2O2后溶液变成红色,则Fe2+既有氧化性又有还原性( )(2015·广东理综,22D)(4)在氧化还原反应中,还原剂失去电子的总数等于氧化剂得到电子的总数( )(2015·江苏,3C)
(5)在CO2中,Mg燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性( )(2015·江苏,4C)
2.[2020·新高考全国卷Ⅰ(山东),2]下列叙述不涉及氧化还原反应的是A.谷物发酵酿造食醋B.小苏打用作食品膨松剂C.含氯消毒剂用于环境消毒D.大气中NO2参与酸雨形成
解析 谷物发酵的过程中包含淀粉水解、葡萄糖转化为乙醇、乙醇氧化为乙酸的过程;小苏打分解的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O,不是氧化还原反应;含氯消毒剂有强氧化性,可用于环境消毒;NO2与水发生反应3NO2+H2O===NO+2HNO3,是氧化还原反应。
3.(2020·北京,2)下列物质的应用中,利用了氧化还原反应的是A.用石灰乳脱除烟气中的SO2B.用明矾[KAl(SO4)2·12H2O]处理污水C.用盐酸去除铁锈(主要成分Fe2O3·xH2O)D.用84消毒液(有效成分NaClO)杀灭细菌
解析 用石灰乳脱除烟气中的SO2时,SO2与氢氧化钙反应生成亚硫酸钙或亚硫酸氢钙,反应过程中无元素化合价的变化,没有利用氧化还原反应,故A不符合题意;明矾[KAl(SO4)2·12H2O]溶于水,电离出的铝离子发生水解生成氢氧化铝胶体,利用胶体的吸附性可吸附污水中的固体颗粒物,该过程利用胶体的吸附性,发生的反应中元素化合价没有变化,没有利用氧化还原反应,故B不符合题意;用盐酸去除铁锈(主要成分Fe2O3·xH2O),发生的主要反应为6HCl+Fe2O3===2FeCl3+3H2O,反应中没有元素化合价的变化,没有利用氧化还原反应,故C不符合题意;
84消毒液有效成分为NaClO,具有强氧化性,能使蛋白质发生变性从而杀死细菌病毒,杀菌消毒的过程利用了氧化还原反应,故D符合题意。
4.(2020·北京,3)水与下列物质反应时,水表现出氧化性的是A.Na B.Cl2 C.NO2 D.Na2O
解析 2Na+2H2O===2NaOH+H2↑,H2O中H元素化合价由+1降为0,得电子被还原,作氧化剂,在反应中表现出氧化性,故A符合题意;Cl2+H2O HCl+HClO、3NO2+H2O===2HNO3+NO,H2O中的元素没有发生化合价的变化,水在反应中既不是氧化剂也不是还原剂,既不表现氧化性也不表现还原性,故C不符合题意;Na2O+H2O===2NaOH,该反应没有元素化合价的变化,不是氧化还原反应,水在反应中既不表现氧化性也不表现还原性,故D不符合题意。
解析 溴化钠中溴元素化合价升高被氧化作还原剂,选项A符合;溴单质中溴元素化合价降低被还原作氧化剂,选项B不符合;溴单质既是氧化剂又是还原剂,被氧化生成溴酸钠,被还原生成溴化钠,选项C不符合;反应属于中和反应,各元素化合价不变,不属于氧化还原反应,选项D不符合。
7.(2019·北京,10)下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
解析 A项,Fe粉将溶液中的Fe3+转化为Fe2+,涉及氧化还原反应;B项,Mg2+与NaOH溶液反应生成Mg(OH)2沉淀,过滤后多余的NaOH用稀盐酸中和,两个反应均不涉及氧化还原反应;C项,Cl2能溶于水并与水发生氧化还原反应,不能用水除去Cl2中的HCl;D项,NO2与水反应生成HNO3和NO,涉及氧化还原反应。
1.(2020·太原质检)下列应用不涉及物质氧化性或还原性的是A.用葡萄糖制镜或保温瓶胆B.用漂白液杀菌、消毒C.用Na2SiO3溶液制备木材防火剂D.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
解析 葡萄糖与银氨溶液发生氧化还原反应,生成银单质,葡萄糖作还原剂被氧化,故A不选;用漂白液杀菌、消毒利用了NaClO的强氧化性,故B不选;用Na2SiO3溶液制备木材防火剂不发生氧化还原反应,与氧化性或还原性无关,故C选;高锰酸钾可氧化具有催熟作用的乙烯,从而达到保鲜水果的目的,故D不选。
2.(2020·湖南省岳阳一中模拟)下列实验中,颜色的变化与氧化还原反应有关的是A.向紫色石蕊溶液中加入盐酸,溶液变红B.饱和FeCl3溶液在沸水中变成红褐色胶体C.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色迅速变成灰绿色, 最后变成红褐色D.SO2使滴有酚酞的NaOH溶液褪色
解析 向FeSO4溶液中滴加NaOH溶液,得到白色沉淀Fe(OH)2,Fe(OH)2迅速与空气中的O2发生氧化还原反应得到红褐色的Fe(OH)3。
3.对于反应:2H2S+SO2===3S↓+2H2O,氧化剂与还原剂的物质的量之比为A.1∶1 B.2∶1 C.3∶1 D.1∶2
解析 反应2H2S+SO2===3S↓+2H2O中,H2S中S元素化合价由-2升高为0,H2S是还原剂;SO2中S元素化合价由+4降低为0,SO2是氧化剂,所以氧化剂与还原剂的物质的量之比等于1∶2,D满足题意。
4.下列属于氧化还原反应,且氧化剂和还原剂为同一种物质的是A.MgO+2HCl===MgCl2+H2O
D.2Na2O2+2H2O===4NaOH+O2↑
解析 MgO+2HCl===MgCl2+H2O中元素化合价没有发生变化,反应不是氧化还原反应,A不符合题意;
反应2Na2O2+2H2O===4NaOH+O2↑中有O元素化合价的变化,反应属于氧化还原反应,其中Na2O2既是还原剂也是氧化剂,氧化剂和还原剂是同一种物质,D符合题意。
5.(2020·四川省泸县第二中学高三模拟)氯气是一种重要的工业原料。工业上利用下列反应来检查氯气管道是否漏气:3Cl2+8NH3===N2+6NH4Cl。下列说法错误的是A.若有白烟产生则管道漏气B.该反应中NH4Cl是还原产物C.反应中NH3只显还原性D.生成1.4 g N2时转移0.3 ml电子
解析 反应生成HCl,NH3可与HCl反应生成氯化铵,有白烟生成,故A正确;Cl元素化合价降低,被还原,Cl2为氧化剂,所以NH4Cl是还原产物,故B正确;反应中NH3中氮元素是-3价,处于最低价态,部分显还原性,同时与氯化氢反应生成氯化铵,故C错误;N元素化合价由-3升高到0,则生成1 ml N2时有6 ml电子转移,生成1.4 g N2物质的量为0.05 ml,转移 ×6 ml=0.3 ml电子,故D正确。
6.(2020·辽宁省本溪一中模拟)水是一种重要的资源,它同时在化学反应中担任着重要的角色,既可作为反应物又可作为生成物,如图中和水相连的物质都能和水发生反应,则有关说法正确的是
A.上述反应中属于氧化还原反应的有①②④⑥⑦⑧B.①和⑦中都有氧气生成,且生成1 ml O2转移的电子数相同C.①④⑧反应中,水既不作氧化剂也不作还原剂D.⑦中水作氧化剂,②中水作还原剂
解析 H2O与Na2O、SO3、Mg3N2的反应不属于氧化还原反应,其余反应均属于氧化还原反应,A错误;①中2Na2O2+2H2O===4NaOH+O2↑,生成1 ml O2转移2 ml e-,⑦中2F2+2H2O===4HF+O2,生成1 ml O2转移4 ml e-,B错误;
①④⑧反应中,水既不作氧化剂也不作还原剂,C正确;⑦中水作还原剂,②中水作氧化剂,D错误。
7.已知N元素的最低化合价是-3,最高化合价是+5,那么下列物质中的N元素只具有氧化性的是A.NH3 B.N2 C.NO2 D.HNO3
解析 N元素只具有氧化性,则化合价只能降低,化合价为+5。NH3中N的化合价为-3,是最低价,只有还原性,与题意不符,A错误;N2中N的化合价为0,既可以升高,又可以降低,与题意不符,B错误;NO2中N的化合价为+4,既可以升高,又可以降低,与题意不符,C错误;HNO3中N的化合价为+5,符合题意,D正确。
8.在溶液中可以发生反应:X+2Y3+===2Y2++X2+,现有下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。其中正确的是A.②④⑥ B.①③④C.①③⑤⑥ D.②⑤
A.①⑤中产生的气体能使带火星的木条复燃B.①④中均发生了氧化还原反应和复分解反应C.②⑤中KMnO4与MnO2的作用不同,产生气体的量也不同D.通过③能比较酸性:HCl>H2O2
解析 试管①中过氧化钠与水反应最终生成氢氧化钠与氧气,试管⑤中过氧化氢在二氧化锰催化剂作用下分解生成水和氧气,因此产生的气体均能使带火星的木条复燃,A项正确;①中的反应机理可以认为过氧化钠与水反应生成过氧化氢与氢氧化钠,过氧化氢分解生成水和氧气,发生的反应为复分解反应与氧化还原反应,④中过氧化钡与稀硫酸反应生成过氧化氢与硫酸钡沉淀,过氧化氢分解产生了氧气,发生的反应为复分解反应和氧化还原反应,B项正确;
②中KMnO4与过氧化氢反应生成氧气,KMnO4体现氧化性,而⑤中MnO2则起催化作用,两个试管中产生氧气的量均由过氧化氢的量决定,因溶液是等分的,但②中过氧化氢全部被氧化,⑤中的过氧化氢发生歧化反应,所以产生气体的量不相同,C项正确;根据已知条件可以看出过氧化氢属于二元弱酸,而HCl属于一元强酸,试管③因为生成了过氧化钡沉淀,不是可溶性的盐溶液,则不能证明HCl与过氧化氢的酸性强弱,D项错误。
10.(2020·浙江省绍兴一中模拟)已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法不正确的是A.S2Cl2既作氧化剂又作还原剂B.H2O作氧化剂C.每生成1 ml SO2转移3 ml电子D.氧化产物与还原产物的物质的量之比为1∶3
解析 因Cl的非金属性比S强,故S2Cl2中S、Cl的化合价分别为+1、-1;则在反应中只有硫的化合价发生变化,氧化产物与还原产物的物质的量之比为1∶3,A、D项正确,B项错误;SO2中硫的化合价为+4,故每生成1 ml SO2转移3 ml电子,C项正确。
11.(2020·延安模拟)氯元素的化合价与其形成的常见物质种类的关系如图所示。下列说法不正确的是A.b只有还原性B.c没有漂白性,d具有漂白性C.一定条件下e和f均属于较强氧化剂D.g的化学式为HClO4
解析 b为HCl,其中+1价的H化合价能降低,具有氧化性,A项错误;c为Cl2,没有漂白性,d为HClO,具有漂白性,B项正确;
g的化学式为HClO4,D项正确。
12.(2020·滨州模拟)工业上制备有机氟化剂SF4的反应3SCl2+4NaF===SF4+S2Cl2+4NaCl。下列说法正确的是A.NaF既不作氧化剂也不作还原剂,SF4为氧化产物B.SCl2与S2Cl2两种物质中的氯元素化合价不同C.还原剂与氧化剂物质的量之比为2∶1D.SF4属于有机物
解析 NaF中钠元素和氟元素化合价均未变化,既不作氧化剂也不作还原剂,SCl2中硫元素化合价为+2价,SF4中硫元素化合价为+4,SF4为氧化产物,A正确;SCl2中氯元素化合价为-1价,S2Cl2中氯元素化合价为-1价,Cl的化合价相同,B错误;SCl2中硫元素化合价为+2价,氯元素化合价为-1价,S2Cl2中硫元素化合价为+1,氯元素化合价为-1价,S2Cl2为还原产物,SF4中硫元素化合价为+4,SF4为氧化产物,SCl2既作氧化剂又作还原剂,氧化剂与还原剂物质的量之比为2∶1,C错误;有机物含有C元素,SF4中没有C元素,不是有机物,D错误。
13.已知氧化性:Fe3+>I2> ,下列说法或离子方程式正确的是A.2Fe3++SO2+2H2O===2Fe2++ +4H+B.Fe3O4可写成FeO·Fe2O3,Fe3I8可写成FeI2·2FeI3C.还原性:Fe2+>SO2>I-D.反应H2SO4(浓)+2HI===I2+SO2↑+2H2O不能进行
浓硫酸具有强氧化性,碘离子具有强还原性,反应H2SO4(浓)+2HI===I2+SO2↑+2H2O能进行,D错误。
铁元素的化合价有+2和+3,碘元素的化合价是-1价,由于氧化性:Fe3+>I2,故I2不能将Fe2+氧化成Fe3+,只能将铁氧化到+2价,Fe3I8可表示为3FeI2·I2,B错误;
②5Cl2+I2+6H2O===2HIO3+10HCl
下列物质(或微粒)氧化能力强弱顺序正确的是
②5Cl2+I2+6H2O===2HIO3+10HCl,氧化剂为Cl2,氧化产物HIO3,故氧化性Cl2>HIO3;
15.(2020·福建省莆田一中模拟)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是________(填字母)。 A.亚硝酸盐被还原B.维生素C是还原剂C.维生素C将Fe3+还原为Fe2+D.亚硝酸盐是还原剂
解析 服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,铁元素化合价降低,被还原,则维生素C具有还原性,而亚硝酸盐会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中亚硝酸盐为氧化剂,所以维生素C是还原剂。
(2)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:____________________________________。
(3)Fe与过量稀硫酸反应可以制取FeSO4,若用反应所得的酸性溶液将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是___(填字母)。 a.Cl2 b.Fe c.H2O2 d.HNO3
解析 由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水作为氧化剂的还原产物是水,不引入杂质,所以最佳试剂是双氧水。
(4)FeSO4可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠(Na2FeO4),氧化性比Cl2、O2、ClO2、KMnO4更强,主要反应:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。①该反应中的氧化剂是________,还原剂是______________。
Na2O2、FeSO4
解析 该反应中铁元素化合价由+2变为+6、氧元素化合价由-1变为0、-2。得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以Na2O2是氧化剂,Na2O2、FeSO4是还原剂;
高考化学一轮复习第1章物质及其变化第4讲氧化还原反应的基本概念和规律课件: 这是一份高考化学一轮复习第1章物质及其变化第4讲氧化还原反应的基本概念和规律课件,共42页。PPT课件主要包含了Mn2+,Cr3+,NO或NO2,SO2,Cl-,Fe2+或Fe,Zn2+,CO2,Fe3+,H2O等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第2章 第10讲 氧化还原反应的基本概念 (含解析): 这是一份2022年高考化学一轮复习课件 第2章 第10讲 氧化还原反应的基本概念 (含解析)
高考化学一轮复习第2章物质及其变化第4讲氧化还原反应的基本概念和规律课件: 这是一份高考化学一轮复习第2章物质及其变化第4讲氧化还原反应的基本概念和规律课件,共60页。PPT课件主要包含了元素的化合价发生变化,还原性,氧化性,①③④⑥⑧⑩,得电子,失电子等内容,欢迎下载使用。












