



新高考化学二轮复习课件 第1部分 专题突破 专题16 溶液中的三大平衡及应用
展开1.理解影响电离平衡、水解平衡及沉淀溶解平衡的因素。2.掌握电离平衡、水解平衡及沉淀溶解平衡的应用。
正误判断,正确的打“√”,错误的打“×”(1)常温下,pH为2的盐酸由H2O电离出的c(H+)=1.0×10-12 ml·L-1( )(2)同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7( )(3)室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7( )(4)25 ℃时,等体积、等浓度的硝酸与氨水混合后,溶液pH=7( )(5)用热的纯碱溶液洗去油污,是因为Na2CO3可直接与油污反应( )
(6)NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同( )(7)施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合施用,是因为K2CO3与NH4Cl反应生成氨气,会降低肥效( )(8)向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成,则Ksp(AgCl)>Ksp(AgI)( )(9)常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+的溶液中,c(Mg2+)≤5.6×10-4 ml·L-1( )(10)室温下,向浓度均为0.1 ml·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀,所以Ksp(BaSO4)<Ksp(CaSO4)( )
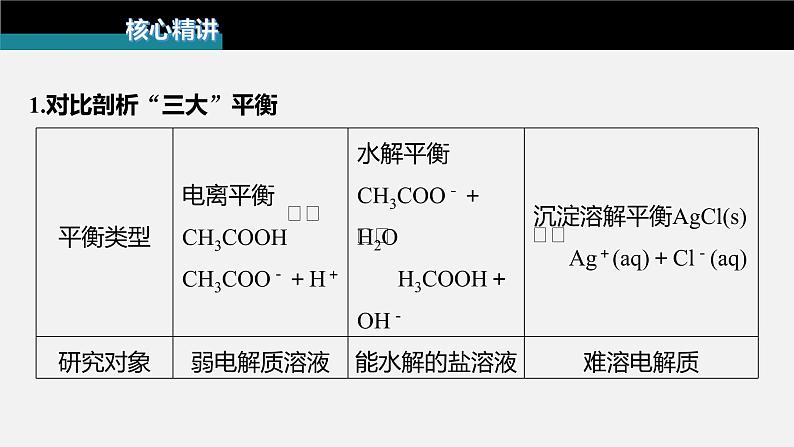
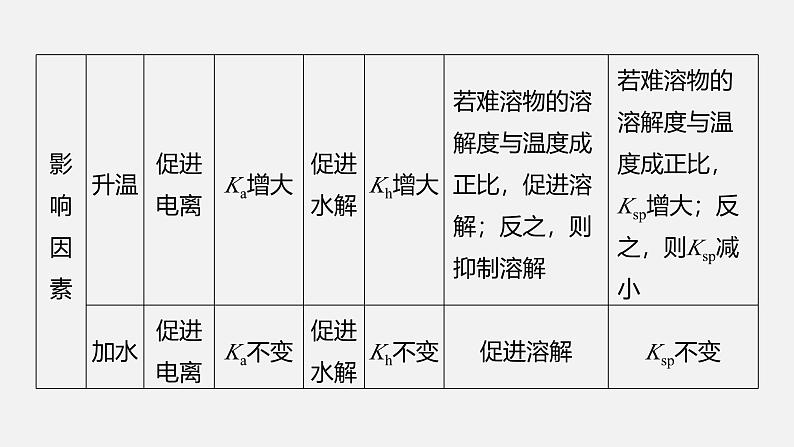
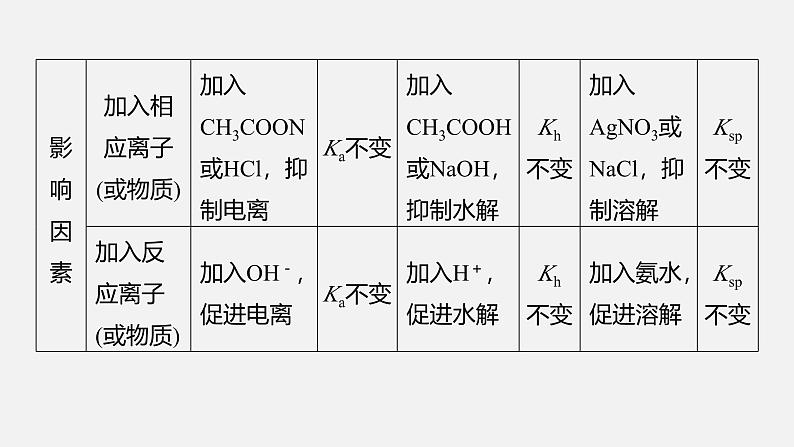
1.对比剖析“三大”平衡
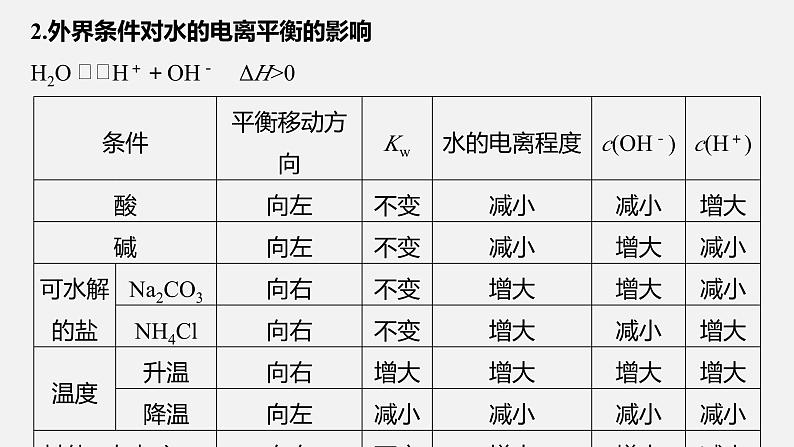
2.外界条件对水的电离平衡的影响H2O H++OH- ΔH>0
3.走出溶液稀释、混合的误区误区一:不能正确理解酸、碱的无限稀释规律常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。误区二:不能正确理解弱酸、弱碱的稀释规律
误区三:不能正确掌握混合溶液的定性规律常温下,pH=n(n<7)的强酸和pH=14-n的强碱溶液等体积混合,混合溶液pH=7;pH=n(n<7)的醋酸和pH=14-n的氢氧化钠溶液等体积混合,混合溶液pH<7;pH=n(n<7)的盐酸和pH=14-n的氨水等体积混合,混合溶液pH>7。
角度一 电离平衡及影响因素1.(2019·全国卷Ⅲ,11)设NA为阿伏加德罗常数的值。关于常温下pH=2的H3PO4溶液,下列说法正确的是A.每升溶液中的H+数目为0.02NAB.c(H+)=C.加水稀释使电离度增大,溶液pH减小D.加入NaH2PO4固体,溶液酸性增强
pH=2的H3PO4溶液中c(H+)=10-2ml·L-1,每升溶液中所含N(H+)=0.01NA,A错误;
加水稀释能促进H3PO4的电离,使其电离度增大,由于以增大溶液体积为主,导致溶液中c(H+)减小,溶液pH增大,C错误;
2.(2022·全国乙卷,13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)B.溶液Ⅱ中的HA的电离度C.溶液Ⅰ和 Ⅱ 中的c(HA)不相等D.溶液Ⅰ和 Ⅱ 中的c总(HA)之比为10-4
常温下,溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 ml·L-1,c(H+)<c(OH-)+c(A-),A错误;
根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;
常温下溶液Ⅰ的pH=7.0,溶液Ⅰ中c(H+)=1×10-7 ml·L-1,Ka(HA)= =1.0×10-3,c总(HA)=c(HA)+c(A-), =1.0×10-3,溶液Ⅰ中c总(HA)=(104+1)c(HA),溶液Ⅱ中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,溶液Ⅰ和Ⅱ中c总(HA)之比为[(104+1)c(HA)]∶[1.01c(HA)]=(104+1)∶1.01≈104,D错误。
角度二 水解平衡及影响因素3.(2015·天津理综,5)室温下,将0.05 ml Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是
D项,加入的0.1 ml NaHSO4固体与0.05 ml Na2CO3恰好反应生成0.1 ml Na2SO4,溶液呈中性,故溶液pH减小,加入NaHSO4,引入Na+,所以c(Na+)增大,错误。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是A.Na2SO3溶液中存在水解平衡:B.④的pH与①不同,是由 浓度减小造成的C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D.①与④的Kw值相等
4.(2018·北京,11)测定0.1 ml·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
Kw只与温度有关,D对。
(1)盐类水解易受温度、浓度、溶液的酸碱性等因素的影响。以氯化铁水解为例,当改变条件,如升温、通入HCl气体、加水、加铁粉、加碳酸氢钠等时,应从平衡移动方向、pH的变化、水解程度、现象等方面去归纳总结,加以分析掌握。(2)多元弱酸的酸式盐问题。酸式盐一般既存在水解,又存在电离。如果酸式盐的电离程度大于其水解程度,溶液显酸性,如NaHSO3溶液;如果酸式盐的水解程度大于其电离程度,则溶液显碱性,如NaHCO3溶液。
角度三 沉淀溶解平衡及影响因素5.(2016·海南,5)向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是A.c( ) B.c(Mg2+) C.c(H+) D.Ksp(MgCO3)
(1)沉淀溶解平衡与化学平衡、电离平衡一样,具有动态平衡的特征,平衡时溶液中各离子浓度保持恒定,平衡常数只受温度的影响,与浓度无关。(2)溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关,相同类型的难溶电解质的Ksp越小,溶解度越小,越难溶。
考向一 电离平衡及应用1.将浓度为0.1 ml·L-1的HF溶液加水稀释,下列各量增大的是①c(H+) ②c(F-) ③c(OH-) ④Ka(HF) ⑤KwA.①⑥ B.②④ C.③⑦ D.④⑤
HF是弱电解质,加水稀释促进HF的电离,但c(H+)、c(F-)、c(HF)都减小;温度不变,Kw不变,c(H+)减小,则c(OH-)增大;
2.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是A.升高温度,可能引起由c向b的变化B.该温度下,水的离子积常数为1.0×10-13C.该温度下,加入FeCl3可能引起由b向a的变化D.该温度下,稀释溶液可能引起由c向d的变化
由图可知,a、b、c三点对应的平衡常数不变,该曲线上的点温度相等,升高温度,不能引起由c向b的变化,故A项错误;b点c(H+)=c(OH-)=1.0×10-7 ml·L-1,故Kw=1.0×10-14,故B项错误;
FeCl3为强酸弱碱盐,Fe3+结合水电离出的OH-,促进水的电离平衡右移,c(H+)增大,c(OH-)减小,可能引起由b向a的变化,故C项正确;由c点到d点,水的离子积常数减小,但温度不变,Kw不变,则稀释溶液不能引起由c向d的变化,故D项错误。
3.浓度均为0.1 ml·L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积为V,pH随 的变化关系如图所示。下列叙述正确的是
由图像可知,HY溶液加水稀释104倍,溶液的pH也随之增加了4,而HX溶液加水稀释104倍后,溶液的pH变化小于4,因此HY为强酸,HX为弱酸,A项错误;电离常数只与温度有关,因此在相同温度下,电
离常数K(HX):a=b,B项错误;a、b两点对应溶液中水的电离都因HX的电离而受到抑制,在a点时,溶液中HX电离出的c(H+)较大,对水的电离抑制更强,因此在a点时溶液中c水(H+)、c水(OH-)都比b点的小,则c水(H+)·c水(OH-):a<b,C项正确;
一般情况下,升高温度,促进弱电解质的电离,因此加热两溶液时,HY是强酸,c(Y-)不变,而HX是弱酸,c(X-)增大,则 增大,D项错误。
考向二 水解平衡及应用4.下列实验中,均产生白色沉淀。下列分析不正确的是A.Na2CO3与NaHCO3溶液中所含微粒种类相同B.CaCl2能促进Na2CO3、NaHCO3水解C.Al2(SO4)3能促进Na2CO3、NaHCO3水解D.4个实验中,溶液滴入后,试管中溶液pH均降低
5.BiOCl是一种具有珍珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:下列说法错误的是A.酸浸工序中分次加入稀HNO3可降低反应的剧烈程度B.转化工序中加入稀HCl可抑制生成BiONO3C.水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度D.水解工序中加入少量NH4NO3(s)有利于BiOCl的生成
硝酸为强氧化剂,可与金属铋反应,酸浸工序中分次加入稀HNO3,可降低反应的剧烈程度,A正确;金属铋与硝酸反应生成的硝酸铋会发生水解反应生成BiONO3,水解的离子方程式为 ,转化工序中加入稀HCl,使氢离子浓度增大,硝酸铋水解平衡左移,可抑制生成BiONO3,B正确;
氯化铋水解生成BiOCl的离子方程式为Bi3++Cl-+H2O BiOCl+2H+,水解工序中加入少量CH3COONa(s),醋酸根离子会结合氢离子生成弱电解质醋酸,使氢离子浓度减小,氯化铋水解平衡右移,促进Bi3+水解,C正确;
结合C项分析水解工序中加入少量NH4NO3(s),铵根离子水解生成氢离子,使氢离子浓度增大,氯化铋水解平衡左移,不利于生成BiOCl,且部分铋离子与硝酸根离子、水也会发生反应:Bi3++BiONO3+2H+,也不利于生成BiOCl,D错误。
考向三 沉淀溶解平衡及应用6.室温下,通过下列实验探究Ca(ClO)2溶液的性质。实验1:向0.1 ml·L-1 Ca(ClO)2溶液中滴加酚酞试剂,溶液先变红后褪色实验2:向0.1 ml·L-1 Ca(ClO)2溶液中通入少量CO2气体,出现白色沉淀实验3:向0.1 ml·L-1 Ca(ClO)2溶液中通入少量SO2气体,出现白色沉淀实验4:将0.1 ml·L-1 Ca(ClO)2溶液与0.1 ml·L-1 NaHCO3溶液等体积混合,出现白色沉淀
下列说法不正确的是A.实验1说明Ca(ClO)2溶液中存在反应ClO-+H2O HClO+OH-B.实验2反应静置后的上层清液中有C.实验3中生成的白色沉淀主要成分是CaSO4D.由实验4可得出:Ka2(H2CO3)>Ka(HClO)
实验1酚酞变红说明Ca(ClO)2水解显碱性,故存在ClO-+H2OHClO+OH-,A项正确;实验2出现白色沉淀,说明上层清液是饱和溶液,存在沉淀溶解平衡,有c(Ca2+)·c( )=Ksp(CaCO3),B项正确;SO2气体被Ca(ClO)2氧化为硫酸根离子生成CaSO4沉淀,C项正确;实验4生成的碳酸钙是难溶固体,不能得出Ka2(H2CO3)>Ka(HClO),错误。
7.向10.00 mL 0.50 ml·L-1 NaHCO3溶液中滴加不同浓度的CaCl2溶液,观察到明显产生浑浊时,停止滴加;取少量所得浑浊液加热,记录实验现象。下列说法不正确的是
A.①中产生浑浊的原因是B.未加热前①和②中发生了反应:C.加热浊液产生气泡主要是因为CaCO3受热分解产生了更多的CO2D.向上述NaHCO3溶液中加入足量0.5 ml·L-1 CaCl2溶液,可能同时产生 浑浊和气泡
①中能产生碳酸钙沉淀,说明c(Ca2+)·c( )>Ksp(CaCO3),A项正确;未加热前①和②不放出二氧化碳,说明碳酸未饱和,加热后二氧化碳溶解度减小,放出二氧化碳气体,所以未加热前①和②中发生反应: +Ca2+===CaCO3↓+H2CO3,B项正确;结合B项分析知,加热浊液产生气泡主要是因为H2CO3受热分解生成了CO2,C项错误;向上述NaHCO3溶液中加入足量0.5 ml·L-1 CaCl2溶液,发生反应CaCl2+2NaHCO3===CaCO3↓+2NaCl+CO2↑+H2O,能同时产生浑浊和气泡,D项正确。
1.石蕊是一种有机弱酸,石蕊分子(HZ)及其酸根离子(Z-)在水溶液中呈现不同的颜色。则Z-的颜色是A.蓝色 B.紫色C.红色 D.由溶液酸碱性确定
根据石蕊是一种弱酸可知,石蕊分子HZ在溶液中存在电离平衡:HZ H++Z-,酸性溶液中滴入石蕊溶液显红色,酸性溶液中氢离子浓度增大,则HZ的电离平衡逆向移动,HZ的浓度增大,溶液变成红色,则HZ为红色;碱性溶液中石蕊溶液显蓝色,碱性溶液中氢离子浓度减小,Z-的浓度增大,则Z-的颜色应该为蓝色。
2.常温下,将pH均为3,体积均为V0的HA溶液和HB溶液,分别加水稀释至体积为V,pH随 的变化如图所示。下列说法正确的是A.稀释相同倍数时:c(A-)>c(B-)B.水的电离程度:b=c>aC.溶液中离子总物质的量:b>c>aD.溶液中离子总浓度:a>b>c
3.化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq)。下列有关叙述正确的是A.该反应的平衡常数K=B.MnS的Ksp小于CuS的KspC.达到平衡时c(Mn2+)=c(Cu2+)D.向溶液中加入少量Na2S固体后,溶液中c(Cu2+)、c(Mn2+)均保持不变
化学式相似的物质,溶度积小的沉淀可以转化为溶度积更小的沉淀,故MnS的Ksp比CuS的Ksp大,故B错误;该反应达到平衡时各离子的浓度保持不变,但不一定相等,故C错误;增大硫离子的浓度,平衡向左移动,所以c(Cu2+)、c(Mn2+)均减小,故D错误。
4.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如图:已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2OB.沉镁的操作不能在较高温度下进行C.流程中可循环使用的物质只有NH3D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
5.某含锰废水中主要含有MnSO4,另含H+、Fe2+、Ca2+、Mg2+、Cu2+、Al3+等,某同学为了回收Mn单质设计如下工艺流程,下列说法不正确的是
已知25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。A.滤渣1主要含Fe(OH)3和Al(OH)3B.除钙镁步骤中,当Ca2+、Mg2+ 沉淀完全时,溶液中C.滤液4主要含(NH4)2CO3D.反应①中Si可用铝替代
6.常温下,通过下列实验探究H2S、Na2S溶液的性质。实验1:向0.1 ml·L-1 H2S溶液中通入一定体积的NH3,测得溶液pH为7。实验2:向0.1 ml·L-1 H2S溶液中滴加等体积同浓度的NaOH溶液,充分反应后再滴入2滴酚酞,溶液呈红色。实验3:向5 mL 0.1 ml·L-1 Na2S溶液中滴入1 mL 0.1 ml·L-1 ZnSO4溶液,产生白色沉淀;再滴入几滴0.1 ml·L-1 CuSO4溶液,立即出现黑色沉淀。实验4:向0.1 ml·L-1 Na2S溶液中逐滴滴加等体积同浓度的盐酸,无明显现象。
下列说法正确的是A.实验1得到的溶液中存在B.由实验2可得出:Kw<Ka1(H2S)·Ka2(H2S)C.由实验3可得出:Ksp(ZnS)>Ksp(CuS)D.实验4得到的溶液中存在c(H+)-c(OH-)=c(S2-)-c(H2S)
新高考化学二轮复习课件 第1部分 专题突破 专题15 速率常数、平衡常数的分析应用: 这是一份新高考化学二轮复习课件 第1部分 专题突破 专题15 速率常数、平衡常数的分析应用,共60页。PPT课件主要包含了复习目标,核心精讲,步骤3求其他,真题演练,该反应气体,+137,升高温度,×039MPa,选择合适催化剂等,5或50%等内容,欢迎下载使用。
新高考化学二轮复习课件 第1部分 专题突破 专题13 化学反应速率、化学平衡选择题突破: 这是一份新高考化学二轮复习课件 第1部分 专题突破 专题13 化学反应速率、化学平衡选择题突破,共60页。PPT课件主要包含了核心精讲,真题演练,考向预测,专题强化练等内容,欢迎下载使用。
新教材适用2024版高考化学二轮总复习第1部分新高考选择题突破专题8电解质溶液微专题1溶液中的三大平衡与平衡常数课件: 这是一份新教材适用2024版高考化学二轮总复习第1部分新高考选择题突破专题8电解质溶液微专题1溶液中的三大平衡与平衡常数课件,共60页。PPT课件主要包含了专题8电解质溶液,高考真题·研析,知能对点·突破,关键能力·提升等内容,欢迎下载使用。












