

江苏省前黄高级中学2024-2025学年高三上学期入学检测化学试卷(Word版附答案)
展开江苏省前黄中学2025届高三上学期期初检测试卷 化学试卷
本试卷满分为 97 分,考试时间为 75 分钟
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Nd-144 Zn-65 一、单选题(共 13 题,每题 3 分,共 39 分。每题仅一个选项符合题意。)
1 . 近年来,我国新能源产业得到了蓬勃发展,下列说法错误的是
A . 理想的新能源应具有资源丰富、可再生、对环境无污染等特点
B . 氢氧燃料电池具有能量转化率高、清洁等优点
C . 锂离子电池放电时锂离子从负极脱嵌,充电时锂离子从正极脱嵌
D . 太阳能电池是一种将化学能转化为电能的装置
2 . 下列化学用语或表述正确的是
A . 中子数为 1 的氦核素: He B . SiO2 的晶体类型:分子晶体
C . F2 的共价键类型: p-p σ 键 D . PCl3 的空间结构:平面三角形
3 .太阳能电池可由 Si 、GaP 、GaAs 等半导体材料构成。下列说法正确的是
A . 原子半径:r(Ga)
4 . 在给定条件下,下列制备过程涉及的物质转化均可实现的是
A . 回收烟气中 SO2 获得 CaSO4 :SO2a―2CaSO3 →CaSO4
B . 金属 Mg 制备: Mg(OH)2 —盐—→ MgCl2 溶液Mg
C . 纯碱工业: NaCl 溶液 —2—→ NaHCO3 —△—→ Na2 CO3
△
D .AlCl3 制备:Al2O3(s) 盐酸→ AlCl3(aq)—→无水 AlCl3(s)
5 . 化合物 Z 是合成药物艾氟康唑的中间体,下列说法不正确的是
A . X 与 CH3CH2MgBr 发生加成反应 B . Y 分子存在对映异构现象
C . Z 分子中所有原子位于同一平面上 D . Y 、Z 可用溴的四氯化碳溶液鉴别
阅读下列材料,完成 6⁓8 题:
氯气在生产、生活中应用广泛。实验室用 MnO2 和浓盐酸反应制取 Cl2,工业上用电解饱和食盐水 制备 Cl2,也可用 Deacn 催化氧化法制备 Cl2 。 Deacn 催化氧化法原理将工业副产物 HCl 制成
CuO
4HCl(g)+O2(g)══2Cl2(g)+2H2O(g)
Cl2 ,实现氯资源的再利用。反应的热化学方程式:
ΔH=-114.4 kJ/ml 。如图所示为该法的一种 催化机理。氨气可以检验 Cl2 是否发生泄露,遇 Cl2 泄漏时反应有白烟生成。Cl2 可用于处理含 氰(CN-)废水。
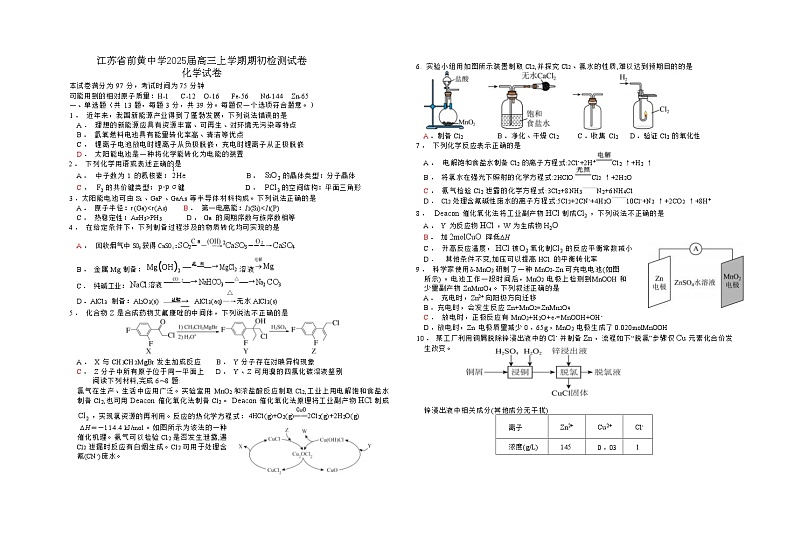
6. 实验小组用如图所示装置制取 Cl2,并探究 Cl2 、氯水的性质,难以达到预期目的的是
A .制备 Cl2 B .净化、干燥 Cl2 C .收集 Cl2 D .验证 Cl2 的氧化性
7 . 下列化学反应表示正确的是
A . 电解饱和食盐水制备 Cl2 的离子方程式:2Cl-+2H+Cl2 ↑+H2 ↑
B . 将氯水在强光下照射的化学方程式:2HClOCl2 ↑+2H2O C . 氨气检验 Cl2 泄露的化学方程式:3Cl2+8NH3—N2+6NH4Cl
D . Cl2 处理含氰碱性废水的离子方程式:5Cl2+2CN-+4H2O—10Cl-+N2 ↑+2CO2 ↑+8H+
8 . Deacn 催化氧化法将工业副产物 HCl 制成Cl2 ,下列说法不正确的是
A . Y 为反应物 HCl ,W 为生成物 H2O
B . 加 2mlCuO 降低ΔH
C . 升高反应温度, HCl 被O2 氧化制Cl2 的反应平衡常数减小
D . 其他条件不变,加压可以提高 HCl 的平衡转化率
9 . 科学家使用δ-MnO2 研制了一种 MnO2-Zn 可充电电池(如图 所示) 。电池工作一段时间后,MnO2 电极上检测到MnOOH 和 少量副产物 ZnMn2O4 。下列叙述正确的是
A . 充电时,Zn2+ 向阳极方向迁移
B .充电时,会发生反应 Zn+MnO2=ZnMn2O4
C . 放电时,正极反应有 MnO2+H2O+e-=MnOOH+OH-
D .放电时,Zn 电极质量减少 0 .65g ,MnO2 电极生成了 0.020mlMnOOH
10 . 某工厂利用铜屑脱除锌浸出液中的 Cl- 并制备 Zn ,流程如下“脱氯”步骤仅 Cu 元素化合价发
生改变。
锌浸出液中相关成分(其他成分无干扰)
离子
Zn2+
Cu2+
Cl-
浓度(g/L)
145
0 .03
1
下列说法正确的是
A . “浸铜”时应加入足量 H2O2 ,确保铜屑溶解完全
B . “浸铜”反应: 2Cu+4H+ +H2O2 = 2Cu2+ +H2 ↑ +2H2O
C . “脱氯”反应: Cu+Cu2+ +2Cl- = 2CuCl
D . 脱氯液净化后电解,可在阳极得到 Zn
11 . 室温下,根据下列实验过程及现象,能验证相应实验结论的是
12 . 环境保护工程师研究利用Na2 S 、 FeS和H2 S 处理水样中的 Cd2+ 。已知 25℃时, H2 S 饱和
溶液浓度约为 0. 1ml . L-1 , Ka1 (H2 S)=10-6.97 , Ka2 (H2S)=10-12.90 , K sp (FeS)=10-17.20 , K sp (CdS)=10-26.10 。下列说法错误的是
A . Na2 S 溶液中: c (H+ )+c (Na + )=c (OH-)+c (HS-)+2c (S2-)
B . 0.01ml .L-1 Na2S 溶液测得 pH= 11: c (Na+ )>c (S2-)>c (OH-)>c (HS-) C . 向c (Cd2+ )=0.01ml . L-1 的溶液中加入 FeS ,可使c (Cd2+ )<10-8ml . L-1
D . 向c (Cd2+ )=0.01ml . L-1 的溶液中通入H2S 气体至饱和,所得溶液中: c (H+ )>c (Cd2+ )
13 . 二甲醚和水蒸气制氢气可作为燃料电池的氢能源,发生的主要反应如下:
反应Ⅰ CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH1>0 反应Ⅱ CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH2>0 反应Ⅲ CO2(g)+H2(g)===CO(g)+H2O(g) ΔH3>0
在恒压下,将一定比例的二甲醚和水蒸气混合后, 以一定流 速通过装有催化剂的反应器,反应相同时间测得的 CH3OCH3 实际转化率、CO2 实际选择性与 CO2 平衡选择性随温度的
变化如图所示。CO2 的选择性=2n 应生(3H3) ×100%。
下列说法不正确的是
A . 曲线a 表示 CH3OCH3 实际转化率随温度的变化
B . 200℃时,反应Ⅱ的速率大于反应Ⅲ的速率
C . 适当增加n 起(H(3) ,有利于提高 H2 的产率
D . 一定温度下,若增大压强,CO 的平衡产量不变 二、非选择题:共 4 题,共 58 分。
14 . (14 分)回收磁性合金钕铁硼( Nd2Fe14B)可制备半导体 材料铁酸铋和光学材料氧化钕。
(1)钕铁硼在空气中焙烧转化为 Nd2O3 、 Fe2 O3 等(忽略 硼的化合物) ,用 0.4ml . L—1 盐酸酸浸后过滤得到NdCl3
浸出液中某元素的物质的量× 100%
溶液和含铁滤渣。Nd、Fe 浸出率( 某元素的总物质的量 )随浸取时间变化如图所示。
①含铁滤渣的主要成分为 (填化学式)。
②浸出初期 Fe 浸出率先上升后下降的原因是 。
(2)含铁滤渣用硫酸溶解,经萃取、反萃取提纯后,用于制备铁酸铋。
①用含有机胺(R3N)的有机溶剂作为萃取剂提纯一定浓度的 Fe2(SO4)3 溶液,原理为:
(R3NH)2 SO4 +Fe3+ +SO- +H2 O H+ + (R3NH)2 Fe (OH)(SO4 )2 (有机层)
①已知: (R3NH)2 SO4 + H+ + HSO4— ≈ 2(R3NH . HSO4 )
其他条件不变,水层初始 pH 在 0 .2~0 .8 范围内,随水层 pH 增大,有机层中Fe 元素含量迅 速增多的原因是 。
②反萃取后,Fe2 (SO4 )3 经转化可得到铁酸铋。铁酸铋 晶胞如图所示(图中有 4 个 Fe 原子位于晶胞体对角线
上,O 原子未画出) ,其中原子数目比N(Fe): N(Bi) =
。
_______
(3)净化后的 NdCl3 溶液通过沉钕、焙烧得到 Nd2 O3 。
①向NdCl3 溶液中加入(NH4 )2 CO3 溶液, Nd3+ 可转
化为Nd(OH)CO3 沉淀,生成物还有 NH4HCO3 。该反应的离子方程式为:
。
②将 4 .42mgNd(OH)CO3 (摩尔质量为221g . ml—1 )在氮 气氛围中焙烧,剩余固体质量随温度变化曲线如图所示。
550 ~ 600℃ 时,所得固体产物可表示为Nda Ob (CO3 )c ,
3+ 2-
通过以上实验数据确定该产物中n (Nd ):n (CO3 ) 的比值
(写出计算过程)。
选项
实验过程及现象
实验结论
A
向 Al(OH)3 沉淀中分别滴加盐酸和氨水,观察沉淀变化
探 究 Al(OH)3 为两 性氢氧化物
B
向 2mL 0. 1ml . L—1 Na2S 溶液中滴加几滴溴水,振荡,产生 淡黄色沉淀
氧化性: Br2 > S
C
向溶有 SO2 的 BaCl2 溶液中通入气体 X ,出现白色沉淀
气体 X 一定具有强 氧化性
D
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加 KSCN 溶液, 溶液未出现血红色
食品脱氧剂样品中 没有+3 价铁
15 .(16 分)盐酸考尼伐坦(J)可用于治疗血容量正常的低钠血症,其合成路线如下:
(1)化合物 A 中 sp3 、sp2 杂化的碳原子数目之比为 。
(2)B 的分子式为C7H4NO3Cl ,可由对硝基苯甲酸与SOCl2 反应合成,B 的结构简式为 。
(3)写出同时满足下列条件的 E 的一种同分异构体的结构简式: 。
①分子中有 2 个苯环;②遇FeCl3 溶液显紫色;③能与新制 Cu(OH)2 反应
④核磁共振氢谱有 6 组峰;。
(4) F → G 的反应中,羰基相邻碳原子上的 C - H 键容易断裂的原因是
。
(5)G + H → I 的反应需经历 G + H → X → Y → I 的过程。中间体 X 中无溴原子,X → Y 的 过程中有π键的断裂,则 Y → I 的反应类型为 。
(6)将考尼伐坦(I)制成盐酸盐(J)的目的是 。
(7)麻黄碱是治疗硬脊膜外麻醉引起低血压的常用药物,有机物 K( )是生产麻 黄碱的重要中间体。写出以和 CH3NH2 为原料制备有机物 K 的合成路线流程图(无 机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16 .(14 分)实验室以菱锰矿(含MnCO3 及少量Fe、Si 的氧化物等)为原料制备高纯MnCO3 和 Mn3O4 的流程如下图所示。已知:室温下 Ksp(MnS) =2 .6×10-13、Ksp[Mn(OH)2] =2 .0×10-13 、H2S 电离 常数 Ka1 =1 .1×10-7 、Ka2 =1 .3×10-13。
(1) 该流程中可循环使用的物质有 。
(2) “沉铁”过程需加氨水调节溶液 pH,使溶液中 Fe3+转化为 Fe(OH)3 沉淀同时得到 MnSO4 溶液。 检验 MnSO4 溶液中是否含有 Fe3+的实验方法是
。
(3) 沉铁过程中也会产生少量 Mn(OH)2 沉淀。Mn(OH)2 在工业上 可用于去除溶液中 HS- ,反应为 Mn(OH)2+HS-===MnS+OH- +
H2O ,其平衡常数 K= 。
(4) 制取 MnCO3 。在题 16 图-1 所示的实验装置中,搅拌下使一 定量的 MnSO4 溶液与氨水-NH4HCO3 混合溶液充分反应。
①滴液漏斗中添加的药品是 。
②混合溶液中氨水的作用是
。
(5) 制取 Mn3O4 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 MnSO4 溶 液制取 Mn3O4 纯度的影响如题 16 图-2 、题 16 图-3 、题 16 图-4 所示。
题 16 图-2 题 16 图-3 题 16 图-4
补充完整制取纯净 Mn3O4 的实验方案:取 25 mL 0 .7 ml·L-1 的 MnSO4 溶液,
,
控制搅拌速率 500 r ·min-1 反应 8 h , , 110 ℃干燥 2 h ,得到纯净的 Mn3O4(须使用的试剂:0 .7 ml·L-1NaOH 溶液、1 .0 ml·L-1BaCl2 溶液)。
17 . (14 分)甲醛释氢对氢能源和含甲醛污水处理有重要意义。
(1) HCHO 电催化释氢
催化电解含较低浓度的 HCHO、NaOH 混合溶液,可获得 H2 与 HCOONa(如题 17 图 1 所示),其 中电极 b 表面覆盖一种 M 与 P 形成的化合物(晶胞结构如题 17 图 2 所示)作催化剂。
题 17 图-1 题 17 图-2
①催化剂可由 MO2 与(NH4)2HPO4 混合物与 H2 高温灼烧制得,同时还有 NH3 生成,生成物中 P 为-3价,该反应的化学方程式为 。
②电解时, 电极 b 上同时产生 H2 与 HCOO- 的物质的量之比为 1 ∶2 ,则电极 b 上的电极反应式
为 。
③电解过程中每产生 2 ml H2 ,通过阴离子交换膜的 OH-为 ml。
(2) HCHO 水化释氢
45 ℃时,碱性条件下 Ag 作催化剂可将甲醛转化为 H2 ,反应的机理如题 17 图 3 所示。使用时将 纳米 Ag 颗粒负载在 Al2O3 表面以防止纳米 Ag 团聚。其他条件不变,反应相同时间,NaOH 浓 度对氢气产生快慢的影响如题 17 图 4 所示。
已知: 甲醛在碱性条件下会发生副反应2HCHO+NaOH===HCOONa+CH3OH。
题 17 图-3
①若将甲醛中的氢用D 原子标记为 DCDO ,得到的氢气产物为 (填化学式)。
②NaOH 浓度低于 1 ml·L-1 时,NaOH 浓度增大产生氢气会加快的原因是
。
③若 NaOH 浓度过大,H2 的产生迅速减慢的原因可能是
。
图-4
(3) 甲烷与水在催化剂作用下可产生氢气与碳氧化物,与甲烷水化法制氢气相比,甲醛制氢的优 点 。
湖南省名校联盟2024-2025学年高二上学期入学考试化学试卷(Word版附解析): 这是一份湖南省名校联盟2024-2025学年高二上学期入学考试化学试卷(Word版附解析),共14页。试卷主要包含了侯氏制碱法主要反应原理,皮江法冶炼镁的工业流程如图所示等内容,欢迎下载使用。
四川省成都列五中学2024-2025学年高三上学期入学摸底测试化学试卷(Word版附答案): 这是一份四川省成都列五中学2024-2025学年高三上学期入学摸底测试化学试卷(Word版附答案),共8页。试卷主要包含了《黄帝内经》中记载,明矾可用作净水剂等内容,欢迎下载使用。
江苏省泰州中学2024-2025学年高三上学期开学考试化学试题(Word版附答案): 这是一份江苏省泰州中学2024-2025学年高三上学期开学考试化学试题(Word版附答案),共11页。试卷主要包含了5V-51,江苏省“十四五”规划指出,下列化学用语表示正确的是,十二烷基磺酸钠,下列化学反应表示正确的是等内容,欢迎下载使用。












