
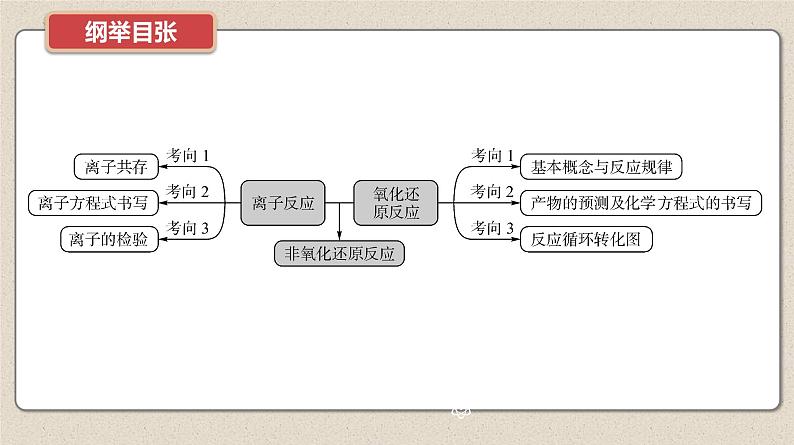






新高考化学二轮复习提优导学案课件 微主题2 离子反应 氧化还原反应(含解析)
展开考向1 离子方程式1. (2022·广东卷)下列关于钠的化合物之间转化反应的离子方程式书写正确的是( )B. 碱转化为两种盐:2OH-+Cl2===ClO-+Cl-+H2O D. 盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
2. (2022·全国甲卷)能正确表示下列反应的离子方程式的是( )A. 硫化钠溶液和硝酸混合:S2-+2H+===H2S↑B. 明矾溶液与过量氨水混合:C. 硅酸钠溶液中通入二氧化碳:D. 将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1∶2混合:
3. (双选)(2022·湖南卷)下列离子方程式正确的是( )A. Cl2通入冷的NaOH溶液:Cl2+2OH-===Cl-+ClO-+H2OC. FeSO4溶液中加入H2O2产生沉淀:2Fe2++H2O2+4H2O===4H++2Fe(OH)3↓D. NaHCO3溶液与少量Ba(OH)2溶液混合:
4. (2022·浙江卷6月)下列反应的离子方程式不正确的是( )A. 盐酸中滴加Na2SiO3溶液:B. Na2CO3溶液中通入过量SO2: C. 乙醇与K2Cr2O7酸性溶液反应: D. 溴与冷的NaOH溶液反应:Br2+OH-===Br-+BrO-+H+
5. (2022·浙江卷1月)下列实验对应的离子方程式不正确的是( )A. 将碳酸氢钙溶液与过量的澄清石灰水混合: B. 将少量NO2通入NaOH溶液: C. 将少量SO2通入NaClO溶液: D. 向氨水中滴入少量硝酸银溶液:Ag++2NH3·H2O===[Ag(NH3)2]++2H2O
6. (2021·全国乙卷)下列过程中的化学反应,相应的离子方程式正确的是( )A. 用碳酸钠溶液处理水垢中的硫酸钙: B. 过量铁粉加入稀硝酸中: C. 硫酸铝溶液中滴加少量氢氧化钾溶液: D. 氯化铜溶液中通入硫化氢:Cu2++S2-===CuS↓
7. (2021·广东卷)宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的化学(或离子)方程式书写正确的是( )A. Na2O2放入水中:Na2O2+H2O===2NaOH+O2↑B. H2O(g)通过灼热铁粉: C. 铜丝插入热的浓硫酸中:Cu+H2SO4===CuSO4+H2↑D. SO2通入酸性KMnO4溶液中:
8. (2020·新课标Ⅲ卷)对于下列实验,能正确描述其反应的离子方程式的是( )A. 用Na2SO3溶液吸收少量Cl2:B. 向CaCl2溶液中通入CO2:Ca2++H2O+CO2===CaCO3↓+2H+C. 向H2O2溶液中滴加少量FeCl3:2Fe3+ +H2O2===O2↑+2H++2Fe2+
考向2 离子共存9. (2021·湖南卷)下列粒子组在溶液中能否大量共存的判断和分析均正确的是( )
考向3 离子的检验与除杂 A. Na2CO3、NaOH、HClB. Na2CO3、HCl、KOHC. K2CO3、HNO3、NaOHD. Na2CO3、NaOH、HNO3
11. (2021·新课标Ⅰ卷)下列说法正确的是( )A. 液溴易挥发,在存放液溴的试剂瓶中应加水封B. 能使湿润的淀粉碘化钾试纸变蓝的物质一定是Cl2C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I―D. 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含 Ag+
考向4 氧化还原反应12. (2022·浙江卷6月)关于反应Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,下列说法正确的是( )A. H2SO4发生还原反应B. Na2S2O3既是氧化剂又是还原剂C. 氧化产物与还原产物的物质的量之比为2∶1D. 1 ml Na2S2O3发生反应,转移4 ml电子
13. (2021·河北卷)关于非金属含氧酸及其盐的性质,下列说法正确的是( )A. 浓硫酸具有强吸水性,能吸收糖类化合物中的水分并使其炭化B. NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强C. 加热NaI与浓磷酸混合物可制备HI,说明H3PO4比HI酸性强D. 浓硝酸和稀硝酸与Cu反应的还原产物分别为NO2和NO,故稀硝酸氧化性更强
A. 产生22.4 L(标准状况)Cl2时,反应中转移10 ml e-B. 反应中氧化剂和还原剂的物质的量之比为11∶6C. 可用石灰乳吸收反应产生的Cl2制备漂白粉
15. (2021·山东卷)下列由实验现象所得结论错误的是( ) B. 向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ)C. 向浓硝酸中插入红热的炭,产生红棕色气体,证明炭可与浓硝酸反应生成NO2D. 向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应
【解析】 2号试管溶液变为棕色,说明NaClO和KI溶液反应生成了碘单质,可知该条件下KClO3的氧化能力比NaClO差。
16. (2020·新课标Ⅲ卷)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显______色。可知该条件下KClO3的氧化能力________NaClO(填“大于”或“小于”)。
考向5 有关化学(或离子)方程式的书写17. (1) (2021·广东卷)实验室沿用舍勒的方法制取Cl2的化学方程式为_________ ____________________________________。(2) (2021·全国甲卷)①将Cl2通入FeI2的过程中,若氧化产物只有一种,反应的化学方程式为_____________________________。②先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2。上述制备I2的总反应的离子方程式为___________________ _____________________________________________________。
FeI2+Cl2===I2+FeCl2
(3) (2021·全国乙卷)将浓硫酸、NaNO3、石墨粉末在三颈烧瓶中混合,置于冰水浴中。剧烈搅拌下,分批缓慢加入KMnO4粉末。转至油浴中,35 ℃搅拌1小时。缓慢滴加一定量的蒸馏水。升温至98 ℃并保持1小时。转移至大烧杯中,静置冷却至室温。加入大量蒸馏水,而后滴加H2O2至悬浊液由紫色变为土黄色。H2O2的作用是____________________________________________________(用离子方程式表示)。(4) (2021·全国甲卷)将CuO加入适量的稀硫酸中,加热,其主要反应的化学方程式为___________________________________________。
(5) (2021·全国乙卷)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。①“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐。写出Al2O3转化为NH4Al(SO4)2的化学方程式:_________________ ___________________________________________________。②TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是__________________ ___________________________。
TiO2++(x+1)
18. (2020·新课标Ⅱ卷)(1) Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为________________________________________。(2) ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 ml ClO2消耗NaClO2的量为____________ ml。(3) “84”消毒液的有效成分为NaClO,不可与酸性清洁剂混用的原因是________ _____________________________________(用离子方程式表示)。
2Cl2+HgO===HgCl2+Cl2O
Cl-+2H+===Cl2↑+ H2O
1. (2022·深圳一调)下列过程中的化学反应,有关离子方程式书写正确的是( )A. 将硫酸铵溶液与氢氧化钡溶液混合: B. 向氧化亚铁中加入适量稀硝酸:
2. (2022·广东、湖北、河北期中联考)下列各组离子在指定溶液中能大量共存的是( )
3. (2022·广东六校第四次联考)硫代硫酸钠晶体(Na2S2O3·5H2O)俗称海波,广泛应用于照相定影及纺织业等领域。实验室利用反应:3SO2+2Na2S===3S↓+2Na2SO3、S+Na2SO3===Na2S2O3制备Na2S2O3溶液,装置如图所示。下列说法错误的是( )A. 制取SO2的反应体现了浓硫酸的酸性和氧化性B. 装置B的作用是安全瓶,防倒吸C. 为提高原子利用率,C中Na2S与Na2SO3物质的量之比为2∶1D. 该实验不足之处是缺少尾气处理装置
4. (2022·茂名一模)解耦电解水可实现用电低谷期的过剩电力向氢能的高效转化,一种以多硫化物离子为介质的转化关系如图。设NA为阿伏加德罗常数的值,下列说法正确的是( )A. 1 ml S2-含有质子数目为18NAB. 16 g O2含有O原子数目为2NAC. 用电低谷期:生成1 ml S得到电子数目为2NAD. 用电高峰期:1 ml H2O发生还原反应生成22.4 L H2
能力1 离子反应1. 判断对错,并把错误的改正过来
错误,Fe+2H+===Fe2++H2↑
2. 指定离子方程式的书写(1) Na及其化合物之间转化的离子方程式①钠与水反应:____________________________________________________②Na2O2与H2O反应:____________________________________________________③氢氧化钠吸收氯气:____________________________________________________④过量的二氧化碳通入氢氧化钠溶液:____________________________________
2Na+2H2O===2Na++2OH-+H2↑
2Na2O2+2H2O===4Na++4OH-+O2↑
Cl2+2OH-===ClO-+Cl-+H2O
⑤过量氢氧化钠吸收二氧化碳:____________________________________⑥碳酸钠转化为碳酸氢钠:____________________________________⑦碳酸氢钠溶液中滴入盐酸:_________________________________________⑧硅酸钠转化为碳酸钠:_________________________________________
(2) 铁及其化合物之间转化的离子方程式①酸性介质中Fe2+被NaClO氧化:_______________________________________________②酸性介质中Fe2+被H2O2氧化:__________________________________________________③除去氯化铁中的氯化亚铁:_____________________________________________④除去氯化亚铁中的氯化铁:_______________________________________
2Fe2++ClO-+2H+===2Fe3++Cl-+H2O
2Fe2++H2O2+2H+===2Fe3++2H2O
2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Fe===3Fe2+
⑤用氯化铁腐蚀线路板(铜板):___________________________________⑥氯化亚铁溶液中滴加稀硝酸:______________________________________________(3) 氮及其化合物之间转化的离子方程式①向AlCl3溶液中加入过量氨水:__________________________________________②NO2与水反应:___________________________________________
2Fe3++Cu===2Fe2++Cu2+
3Fe2++4H++NO===3Fe3++NO↑+2H2O
③用氢氧化钠溶液吸收等物质的量的NO、NO2:______________________________________________④氢氧化钠溶液吸收NO2生成等物质的量的盐:________________________________________________⑤铜与浓硝酸反应:______________________________________________⑥铜与稀硝酸反应:____________________________________________________
(4) 氯及其化合物之间转化的离子方程式①氯气溶于水:__________________________________________②实验室制备氯气:___________________________________________________③氯气使淀粉碘化钾溶液变蓝:_____________________________________④向氯化亚铁溶液中通入氯气:_____________________________________________⑤亚硫酸盐可使氯水褪色:______________________________________________
Cl2+2I-===I2+2Cl-
⑥“84”消毒液(NaClO)和洁厕灵(浓盐酸)混合产生黄绿色气体:________________________________________________⑦工业制备氯气:_________________________________________(5) 硫及其化合物之间转化的离子方程式①二氧化硫可使氯水褪色:_____________________________________________②足量NaOH吸收SO2气体:______________________________________________③用过量的氨水吸收二氧化硫:________________________________________________
Cl-+ClO-+2H+===Cl2↑+H2O
④过量的二氧化硫通入氨水中:_________________________________________⑤二氧化硫转化为强酸:_____________________________________⑥二氧化硫使酸性高锰酸钾褪色:____________________________________________(6) 用量不同的离子方程式的书写①向氢氧化钡溶液中加入过量的硫酸氢钠溶液:___________________________________________________②向硫酸氢钠溶液中加入过量的氢氧化钡溶液:___________________________________________________
③向碳酸氢铵溶液中加入足量石灰水:________________________________________________④向碳酸氢铵溶液中加入足量氢氧化钠溶液:__________________________________________________ ⑤NaHCO3溶液中加入少量Ba(OH)2溶液:________________________________________________________⑥(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:___________________________________________________ ⑦硝酸银溶液中加入足量稀氨水:___________________________________________________
Ag++2NH3·H2O===[Ag(NH3)2]++2H2O
3. 离子共存(1) 有条件的离子共存
(2) 不能大量共存的原因
能力2 氧化还原反应及其规律1. 氧化还原反应的两条主线
2. 氧化还原反应的反应规律
3. 常见氧化剂、还原剂及反应产物预测(1) 常见的氧化剂及产物预测
(2) 常见的还原剂及产物预测
[说明](1) 卤素单质:“碱性歧化,加热升高,酸性归中”歧化反应:Cl2+2OH-===ClO-+Cl-+H2O归中反应:(2) 氮的氧化物与碱溶液的歧化和归中反应
4. 新情境氧化还原反应化学(或离子)方程式的书写(1) 陌生氧化还原反应化学(或离子)方程式书写的一般步骤例如:碱性条件下,KClO饱和溶液与Fe(NO3)3饱和溶液反应化学(或离子)可制备K2FeO4,写出反应的离子方程式。第一步:写出主要反应物和已知的生成物。 第二步:根据化合价升降(有升必有降)预测主要生成物。
第三步:配平发生氧化还原反应的物质。 第四步:配平电荷 (特别注意溶液的酸碱性)。 ①酸性条件下,用H+平衡电荷。在多氧一侧加H+,多一个氧加2个H+,在另一侧加1个H2O。②碱性条件下,用OH-平衡电荷。在多氧一侧加H2O,多一个氧加1个H2O,在另一侧加2个OH-。第五步:查漏补缺,检查元素是否守恒,符号是否正确。
(2) “瞻前顾后”法书写新情境下化学(或离子)方程式的步骤例如:氯化亚铜是一种应用较广的催化剂,易水解。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:除锰步骤Mn2+转化为MnCO3沉淀,溶液中CuSO4转变为Cu(NH3)4CO3留在溶液中。写出酸溶1发生反应的化学方程式。
第一步:“瞻前”确定反应物为CuS+MnO2+H2SO4。第二步:“顾后”确定生成物为S+MnSO4+CuSO4。第三步:根据得失电子守恒配平发生氧化还原反应的物质:CuS+MnO2+H2SO4―→MnSO4+S+CuSO4。第四步:根据质量守恒补充并配平未发生氧化还原反应的物质:CuS+MnO2+2H2SO4===MnSO4+S+2H2O+CuSO4。
考向1 离子方程式 (2022·汕头一模)宏观辨识与微观探析是化学核心素养之一,下列有关离子方程式的书写正确的是( )D. 向Fe(OH)3中通入过量HI溶液:Fe(OH)3+3H+===Fe3++3H2O
考向2 离子共存 25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
考向4 氧化还原反应基本概念A. CO是氧化产物B. SiH4发生还原反应C. 氧化剂与还原剂的物质的量之比为1∶4D. 生成1 ml SiO2时,转移8 ml电子
考向5 给定情景下的化学(或离子)方程式书写 回答下列问题:(1) 将NH4HCO3、NH3·H2O溶液加入FeSO4溶液生成FeCO3沉淀,反应的离子方程式为___________________________________________ _______。(2) Na2S2O4固体与过量H2O2溶液反应生成硫酸盐的离子方程式为____________ ____________________________________________。(3) 在酸性条件下,NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________________________________________。(4) pH=11时,K2FeO4与H2O反应生成Fe(OH)3和O2等物质,反应的离子方程式为__________________________________________________。
(5) 写出葡萄糖、MnO2、H2SO4反应生成MnSO4和CO2的化学方程式:________ _______________________________________________。(6) 用N2H4·H2O还原H2SeO3,反应生成一种气体单质和Se,该反应的化学方程式为___________________________________________________。(7) 工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。发生反应的化学方程式为__________________________________ _______。(8) 以FeS2作还原剂,在硫酸介质中还原NaClO3制备ClO2,同时得到Fe2(SO4)3、Na2SO4,该反应的化学方程式为__________________________________________ ____________________________________。
C6H12O6+12MnO2+12H2SO4===12MnSO4+18H2O+6CO2↑
N2H4·H2O+H2SeO3===N2↑+Se↓+4H2O
2As2S3+5O2+6H2O===4H3AsO4+
2FeS2+30NaClO3+14H2SO4===30ClO2↑
+Fe2(SO4)3+15Na2SO4+14H2O
1. (2022·肇庆三模)宏观辨识与微观探析是化学学科核心素养之一。下列物质的性质实验对应的离子方程式书写正确的是( )D. SO2通入H2S溶液中:4H++2S2-+SO2===3S↓+2H2O
2. 室温下,下列各组离子在指定溶液中一定能大量共存的是( )A. 0.1 ml/L KI溶液:Na+、K+、ClO-、OH-
A. 铁元素被氧化,氮元素被还原B. 氧化性:KNO3>K2FeO4C. 每生成1 ml K2FeO4,转移6 ml e-D. K2FeO4具有氧化杀菌作用
4. 锰的重要用途是制造锰钢。一种以高铁锰矿(含MnO2、Fe2O3及少量FeO、CaO、K2O、Na2O)为原料生产金属锰的工艺流程如图。“焙烧还原”时,高铁锰矿中MnO2被还原为MnO。反应的化学方程式为__________________________,被还原的物质还有__________________________。
新高考化学二轮复习提优导学案课件 基础回归第2讲 回归教材核心实验(含解析): 这是一份新高考化学二轮复习提优导学案课件 基础回归第2讲 回归教材核心实验(含解析),共57页。PPT课件主要包含了蒸发皿,蒸馏烧瓶,烧瓶支管口处,常见离子的检验,不变红,白色沉淀,玻璃棒,容量瓶,胶头滴管定容,玻璃棒引流等内容,欢迎下载使用。
新高考化学二轮复习导学案课件 微主题11 有机推断与合成(含解析): 这是一份新高考化学二轮复习导学案课件 微主题11 有机推断与合成(含解析),共60页。PPT课件主要包含了命题规律,高考回眸,苯甲醇,消去反应,酯基和酮羰基,-氯-1-丙烯,取代反应,保护酚羟基,C5H4O2,CHO等内容,欢迎下载使用。
新高考化学二轮复习导学案课件 微主题10 化学实验与化学计算(含解析): 这是一份新高考化学二轮复习导学案课件 微主题10 化学实验与化学计算(含解析),共60页。PPT课件主要包含了命题规律,高考回眸,可充当沸石,降低温度,水合物的形成,防止滤液,重金属硫化物,温度逐渐恢复至室温,冷的95%乙醇溶液,分液漏斗和等内容,欢迎下载使用。












