




新高考化学一轮复习讲义课件第4章 第23讲 硝酸 含氮化合物的转化关系(含解析)
展开1.掌握硝酸的性质及应用。2.了解氮及其化合物的转化关系。
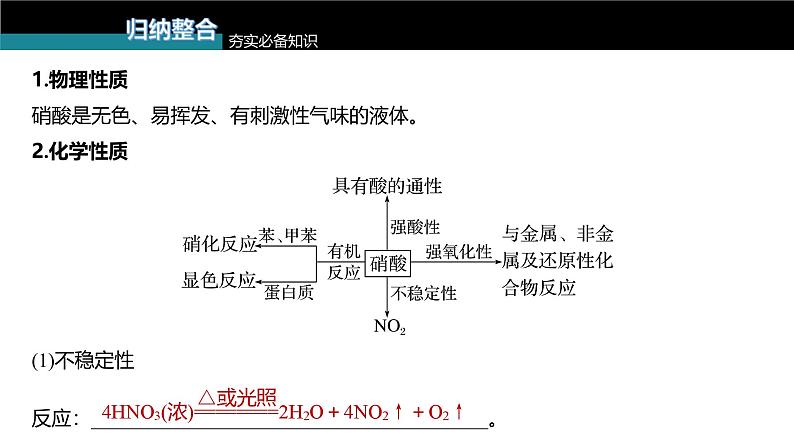
典型的氧化性酸——硝酸
1.物理性质硝酸是无色、易挥发、有刺激性气味的液体。2.化学性质
(1)不稳定性反应:________________________________________。
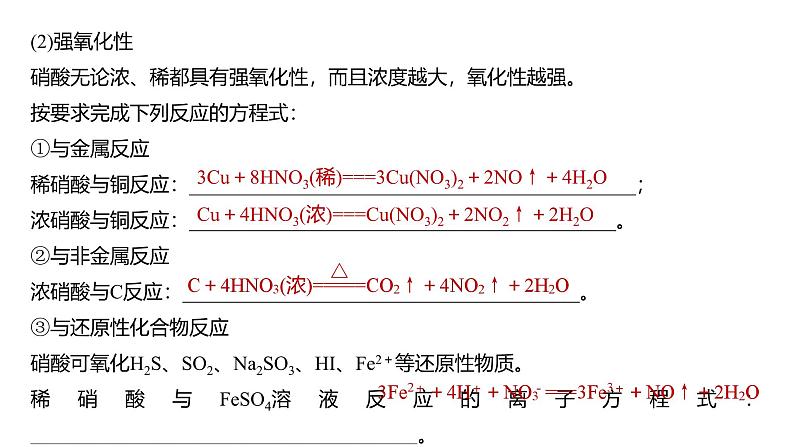
(2)强氧化性硝酸无论浓、稀都具有强氧化性,而且浓度越大,氧化性越强。按要求完成下列反应的方程式:①与金属反应稀硝酸与铜反应:_____________________________________________;浓硝酸与铜反应:___________________________________________。②与非金属反应浓硝酸与C反应:________________________________________。③与还原性化合物反应硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。稀硝酸与FeSO4溶液反应的离子方程式:_______________________________________。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
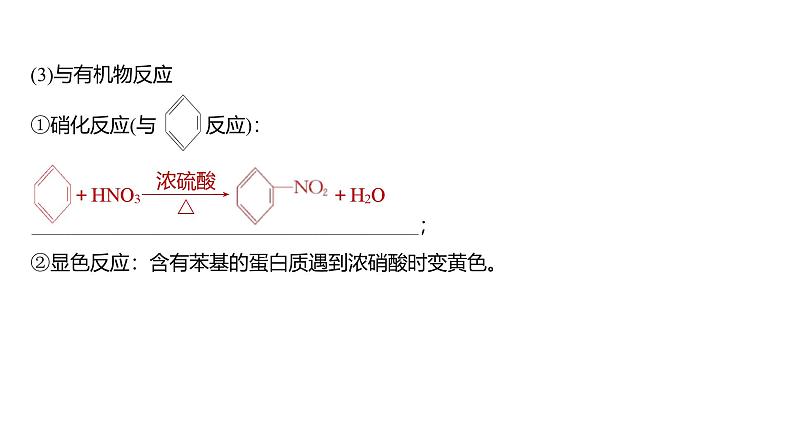
(3)与有机物反应①硝化反应(与 反应):
②显色反应:含有苯基的蛋白质遇到浓硝酸时变黄色。
_______________________________________;
5.Cu在KNO3溶液和稀H2SO4中均不溶解,但能溶解在其混合液中( )6.试管内壁上的银镜可用稀HNO3除去,也可用氨水除去( )7.浓HNO3和氯水均用棕色试剂瓶保存,其原理相同( )8.浓HNO3溅到皮肤上,皮肤会变黄( )
1.常温下,铁、铝在浓硝酸中的钝化为化学变化( )2.可用稀HNO3与FeS固体反应制取H2S( )3.铜、碳分别与浓HNO3反应,都体现了浓硝酸的强氧化性和酸性( )
一、金属与硝酸反应的定性分析1.用动态观点理解Cu与浓HNO3的反应向一定量的浓硝酸中加入过量的铜片。(1)反应开始阶段产生_______色气体,化学方程式为____________________________________________。(2)反应进行一段时间后又产生无色气体,此时的化学方程式为_______________________________________________。(3)待反应停止后,再加入少量的稀硫酸,这时Cu片上又有气泡产生,原因是_______________________________________________________________________________。
Cu+4HNO3(浓)===Cu(NO3)2
+2NO2↑+2H2O
3Cu+8HNO3(稀)
===3Cu(NO3)2+2NO↑+4H2O
稀硫酸后,氢离子与原溶液中的硝酸根离子构成强氧化性酸,又能与过量的铜反应
二、金属与硝酸反应的定量计算2.在100 mL 稀HNO3和稀H2SO4组成的混合溶液中,两种酸的物质的量浓度之和为0.4 ml·L-1。向该溶液中加入足量的铜粉后加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为______________(反应前后溶液体积变化忽略不计)。
0.24 ml·L-1
3.将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:(1)NO的体积为_______ L,NO2的体积为_______ L。
(2)参加反应的HNO3的物质的量是___________。
参加反应的HNO3分两部分:一部分没有被还原,显酸性,生成Cu(NO3)2;另一部分被还原成NO2和NO,所以参加反应的HNO3的物质的量为0.51 ml×2+0.5 ml=1.52 ml。
(3)待产生的气体全部释放后,向溶液中加入V mL a ml·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为______________ ml·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水_______ g。
金属与硝酸反应计算的思维流程
三、硝酸氧化性实验探究4.某学习小组为探究浓、稀硝酸氧化性的相对强弱,按下图所示装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、3 ml·L-1稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳。已知:氢氧化钠溶液不与NO反应,能与NO2反应:2NO2+2NaOH===NaNO3+NaNO2+H2O。请回答下列问题:(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是________________________________________。
3 ml·L-1稀硝酸、浓硝酸、氢氧化钠溶液
根据装置特点和实验目的,装置⑤收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放3 ml·L-1稀硝酸。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________________________________________________________________。
时间CO2,关闭弹簧夹,将装置⑤中的导管末端伸入倒置的烧瓶内
由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间的CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出。
(3)装置①中发生反应的化学方程式是_________________________________________。(4)装置②的作用是___________________,发生反应的化学方程式是____________________________。
3NO2+H2O===2HNO3+NO
(5)该小组得出的结论所依据的实验现象是________________________________________________________________________。
装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
NO通过稀HNO3后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO,则装置④的液面上方会产生红棕色气体。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验方案来判断两种看法是否正确。这些方案中可行的是________(填字母)。a.加热该绿色溶液,观察颜色变化b.加水稀释该绿色溶液,观察颜色变化c.向该绿色溶液中通入氮气,观察颜色变化d.向饱和硝酸铜溶液中通入浓硝酸与铜反应 产生的气体,观察颜色变化
要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,可设计将溶解的NO2赶走(a、c方案),再观察颜色变化。也可在Cu(NO3)2浓溶液中通入NO2,观察比较反应后的颜色变化(d方案),确定是不是由溶有NO2引起的。
氮及其化合物的相互转化
1.氮在自然界中的循环
2.含氮元素物质之间的转化关系
(1)歧化——同一物质中某元素的化合价在同一反应中既升高又降低。如:3NO2+H2O===2HNO3+NO2NO2+2NaOH===NaNO3+NaNO2+H2O
(2)归中——不同物质中同一元素的不同化合价在同一反应中只靠拢。
3.氮元素的“价类二维图”氮元素有多种可变化合价,物质的种类较多,在复习时要从物质类别和价态变化理解这些物质之间的转化关系。
一、氮的循环1.(2022·石家庄市高三模拟)下列关于自然界中氮循环(如图)的说法错误的是A.①和②均属于氮的固定B.氢、氧元素也参与了自然界中的氮循环
D.③和⑤过程中氮元素分别被还原和氧化
2.(2022·江苏镇江市调研)空气中的氮气可通过人工固氮获得氨气,氨气是重要的化工原料,通过氨氧化法可制得硝酸,反应过程如图:
硝酸是一种强氧化性酸,制硝酸工业产生的尾气中含有氮氧化物,应处理后才能排放。下列说法不正确的是A.常温下,浓硝酸可盛放在铝制或铁制容器中B.BaSO3固体能溶于稀硝酸,生成Ba(NO3)2,放出SO2气体C.工业上,当转化①的反应达到平衡时,需不断地从混合气体中分离出NH3,将未 反应的原料气送回合成塔以提高原料的利用率D.转化④中,当V(NO2)∶V(O2)=4∶1时,理论上NO2全部转化为HNO3
硝酸是氧化性酸,BaSO3固体能溶于稀硝酸,被氧化生成硫酸钡,硝酸被还原生成NO,B错误。
二、氮元素“价类二维图”的分析应用3.(2022·河北省三河市第一中学质检)如图是氮元素形成物质的价类二维图及氮循环的部分信息:
下列说法正确的是①可通过雷电作用将b转化为c,这是一种固氮方式②可通过加氧化剂将e转化为f③a→c→d→f这几个反应中,均发生了N元素被氧化的反应④g只具有氧化性,还可能与碱发生反应⑤将f转化为d必须选用合适的还原剂才能实现⑥h可与f反应生成iA.①③⑤⑥ B.②③④ C.①③⑥ D.①④⑤
②e是N2O5,f是HNO3,N2O5与水反应产生HNO3,反应过程中元素化合价不变,因此反应不需要加入氧化剂就可以实现,错误;③在a→c→d→f这几个反应中,N元素化合价升高,失去电子,被氧化,因此均发生了N元素被氧化的反应,正确;
根据物质类别及与N元素化合价的关系可知:a是NH3;b是N2;c是NO;d是NO2;e是N2O5;f是HNO3;g是HNO2;h是NH3·H2O;i是NH4NO3。①在雷电作用下N2与O2反应产生NO,从而实现了N元素的单质向化合物的转化,这是一种固氮方式,正确;
④g是HNO2,属于酸,N元素化合价是+3价,介于最高价和最低价之间,因此既具有氧化性又具有还原性,同时也能与碱发生中和反应产生盐和水,错误;⑤f是HNO3,光照条件下自身分解即可生成NO2(d),可以不用其他还原剂,错误;
⑥HNO3与NH3·H2O发生中和反应产生NH4NO3和水,正确。
4.研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价—物质类别关系图如图:
回答下列问题:(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,反应的化学方程式是_________________________________。(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式:_________________________________________。
(3)实验室中,检验溶液中含有 的操作方法是____________________________________________________________________________________________________________________。(4)物质B为红棕色气体,写出该物质与水反应的离子方程式:________________________________,当反应消耗0.15 ml物质B时,转移电子的物质的量为________。
取少量溶液于试管中,加入氢氧
化钠溶液,稍微加热,若有使湿润的红色石蕊试纸变蓝的气体产生,则证明溶液中含有
3NO2+H2O===2H+
由氮元素化合价—物质类别关系分析,A为氨气,B为二氧化氮,C为硝酸。
1.正误判断(1)浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀HNO3氧化性更强(2021·河北,10D)( )(2)向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2(2021·山东,5C)( )
2.(2018·全国卷Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如右图所示)。下列叙述错误的是A.雾和霾的分散剂相同B.雾霾中含有硝酸铵和硫酸铵C.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关
3.(2017·北京,12)下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
A.由①中的红棕色气体,推断产生的气体一定是混合气体B.红棕色气体不能表明②中木炭与浓硝酸产生了反应C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
由①可知,浓硝酸受热分解可生成红棕色气体NO2,所以“产生红棕色气体”不能说明②中木炭能与浓硝酸发生反应,故B正确;
根据①和②,浓硝酸反应产生红棕色NO2时需要加热,所以浓硝酸具有挥发性才可与上方红热木炭接触,同时,N元素化合价降低,所以生成的NO2为还原产物,故C正确;红热的木炭可与空气中的O2反应生成CO2,故D错误。
4.(2021·广东1月适应性测试,10)部分含氮物质的分类与相应氮元素的化合价关系如图所示。下列说法错误的是A.a可经催化氧化生成bB.b为红棕色,可转化为cC.密闭体系中,c存在2NO2 N2O4D.d的溶液与Cu反应可生成b或c
1.硝酸被称为“国防工业之母”是因为它是制取炸药的重要原料。下列实验事实与硝酸性质不相对应的一组是A.浓硝酸使紫色石蕊溶液先变红后褪色——酸性和强氧化性B.不能用稀硝酸与锌反应制氢气——强氧化性C.要用棕色瓶盛装浓硝酸——不稳定性D.能使滴有酚酞的氢氧化钠溶液红色褪去——强氧化性
2.下列有关硝酸化学性质的叙述中,正确的是A.浓、稀硝酸都能使蓝色石蕊试纸最终变为红色B.硝酸能与FeO反应,只表现氧化性C.硝酸可与Na2S反应制得H2S气体D.浓硝酸因分解放出的NO2又溶解于硝酸而呈黄色
A.①② B.③④ C.②③④ D.②④
3.下列有关实验操作、现象和解释或结论都正确的是
4.氮循环是生态系统物质循环的重要组成部分,人类活动影响了氮循环中的物质转化,如图所示。下列说法不正确的是A.工业合成氨属于人工固氮过程B.硝化过程中氮元素被还原C.含氮无机物与含氮有机化合物可相互转化D.反硝化过程有助于稳定N2在大气中的含量
5.(2022·郑州市高三一模)如图是某元素M的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,图中呈现了各物质的转化关系。下列说法正确的是A.A中只含有离子键B.B物质可以和Y反应直接转化为EC.D、E均可以用向上排空气法收集D.通过氢氧化钠溶液可以除去D中含有的少量E
A为正盐,X是一种强碱,二者反应生成氢化物B,则A为铵盐,B为NH3;B连续与Y反应得到氧化物D与氧化物E,E的相对分子质量比D大16,则Y为O2、C为N2、D为NO、E为NO2,通常条件下Z是无色液体,E与Z反应得到含氧酸F,则Z为H2O、F为HNO3,F与X发生酸碱中和反应得到G为硝酸盐。A为铵盐,属于离子化合物,含有离子键,铵根离子中还含有N—H共价键,故A错误;
B为NH3,Y为O2,E为NO2,氨气与氧气反应生成NO,不会直接生成NO2,故B错误;D为NO,NO能够与氧气反应,不能用排空气法收集,故C错误;一氧化氮不与NaOH溶液反应,二氧化氮与氢氧化钠溶液反应,通过氢氧化钠溶液可以除去NO中含有的少量NO2,故D正确。
下列说法不正确的是A.过程Ⅰ中生成无色气体的离子方程式是3Cu+ +8H+===3Cu2++2NO↑+4H2OB.步骤Ⅲ反应速率比Ⅰ快的原因是NO2溶于水,使c(HNO3)增大C.由实验可知,NO2对该反应具有催化作用D.当活塞不再移动时,再抽入空气,铜可以继续溶解
6.一定温度下,探究铜与稀HNO3反应过程如下:
7.将相同质量的铜分别与足量的浓硝酸、稀硝酸反应,下列叙述正确的是A.硝酸浓度越大消耗的硝酸越少,产生的有毒气体也越少B.反应中转移的电子总数:稀硝酸少于浓硝酸C.试管内壁上的铜用浓硝酸除去比用稀硝酸好,因为反应速率快D.两者用排水法收集的气体的体积相同
8.某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
A.先检查装置气密性,加入药品后,关闭c, 打开a和b,再通入一段时间N2B.关闭a、c,打开b及分液漏斗活塞,反应 后丙中溶液变为深棕色,丁中溶液无明显变化,证明NO与Fe2+反应C.甲中反应一段时间后,更新丙、丁中试剂,关闭a和b,打开c,反应后丙中溶液变 为深棕色,丁中溶液无明显变化,证明NO2也可与Fe2+反应D.该实验的缺陷是缺少尾气吸收装置
9.某同学做“FeSO4被HNO3氧化”的实验,发现溶液变深棕色。猜想可能是生成的NO2或NO与Fe2+或Fe3+反应,使溶液变为深棕色,设计下列装置探究。下列说法错误的是
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。A.装置的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→dB.装置E中发生反应的化学方程式为2NO+2Fe 2FeO+N2C.装置D的作用是吸收挥发出来的硝酸和产生的NO2D.装置B的作用是干燥,防止水蒸气进入E中干扰反应
10.(2022·安徽皖江名校联考)某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO)。下列说法不正确的是
则下列说法不正确的是A.路线①②③是工业生产硝酸的主要途径B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径C.上述所有标号的反应都是氧化还原反应D.氮气可在足量的氧气中通过一步反应生成NO2
11.氮及其化合物的转化关系如图所示。
12.(2022·武汉市汉阳一中高三模拟)用图所示装置进行实验,探究硝酸与铁反应的产物。
下列说法正确的是A.滴入浓硝酸加热前没有明显现象的原因是温度低,反应速率太慢B.实验现象③说明反应后A 中溶液含有 Fe2+C.实验现象④说明 A 中有 NO 生成D.可用浓 NaOH 溶液和湿润的红色石蕊试纸检验硝酸的还原产物中是否有
13.(2022·玉溪市易门县第一中学模拟)硝酸与金属反应后所得还原产物与硝酸的浓度和金属的活泼性有关。10 mL 0.5 ml·L-1 HNO3与0.048 g Mg恰好完全反应。若氮元素只被还原到一种价态,下列说法不正确的是A.HNO3作还原剂B.HNO3浓度越低,N元素还原价态越低C.反应中转移电子数为0.004 mlD.还原产物可能为NH4NO3
14.氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
(1)下列有关NH3的说法中,不正确的是_______(填字母)。A.工业合成NH3需要在高温、高压、催化剂下进行B.NH3可用来生产碳铵和尿素等化肥C.NH3可用浓硫酸或无水氯化钙干燥D.NH3受热易分解,须置于冷暗处保存
(2)NH3易溶于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为______________ ml·L-1。(3)氨气燃烧的化学方程式为_______________________________。(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的________性。
(5)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,通常用以下两种方法处理:①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为Na2CO3+2NO2===NaNO3+__________+CO2(完成化学方程式)。②氨转化法。已知7 ml氨恰好能将含NO和NO2共6 ml的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为________,若用通式NOx表示氮氧化物,则每摩尔氨可将_____ ml的NOx转化为N2。
新高考化学一轮复习讲义课件第3章 第14讲 铁及其化合物的转化关系(含解析): 这是一份新高考化学一轮复习讲义课件第3章 第14讲 铁及其化合物的转化关系(含解析),共60页。PPT课件主要包含了复习目标,+3H2O,溶液颜色无明显变化,真题演练明确考向,碱煮水洗,加快反应,热水浴,防止Fe3+水解,Fe3+,溶液酸碱性不同等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第5章第24讲 氮及其化合物的转化关系(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第5章第24讲 氮及其化合物的转化关系(含解析),共50页。PPT课件主要包含了HNO3,CuNO32,NO2,N2O4,NH3·H2O,NH3,NH4Cl,FeNO33,A或B,dcfedci等内容,欢迎下载使用。
(人教版)高考化学一轮复习讲义课件第5章第17讲 氯及其重要化合物的转化关系(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第5章第17讲 氯及其重要化合物的转化关系(含解析),共48页。PPT课件主要包含了圆底烧瓶,饱和食盐水,水浴加热,避免生成NaClO3,吸收尾气Cl2,少量冷水洗涤,有关信息如下表,蒸馏烧瓶,课时精练,MnO2+4H+等内容,欢迎下载使用。












