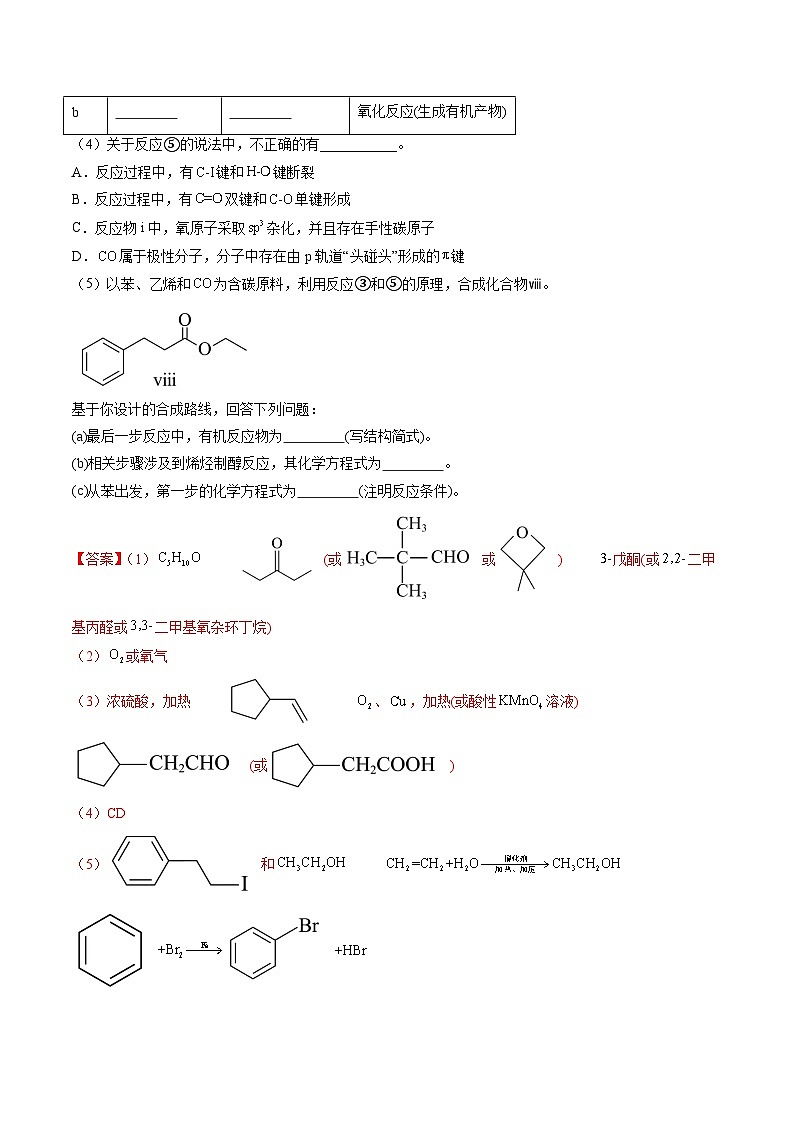
(广东版)新高考化学三轮冲刺强化练习 第20题 有机推断综合题(解析版)
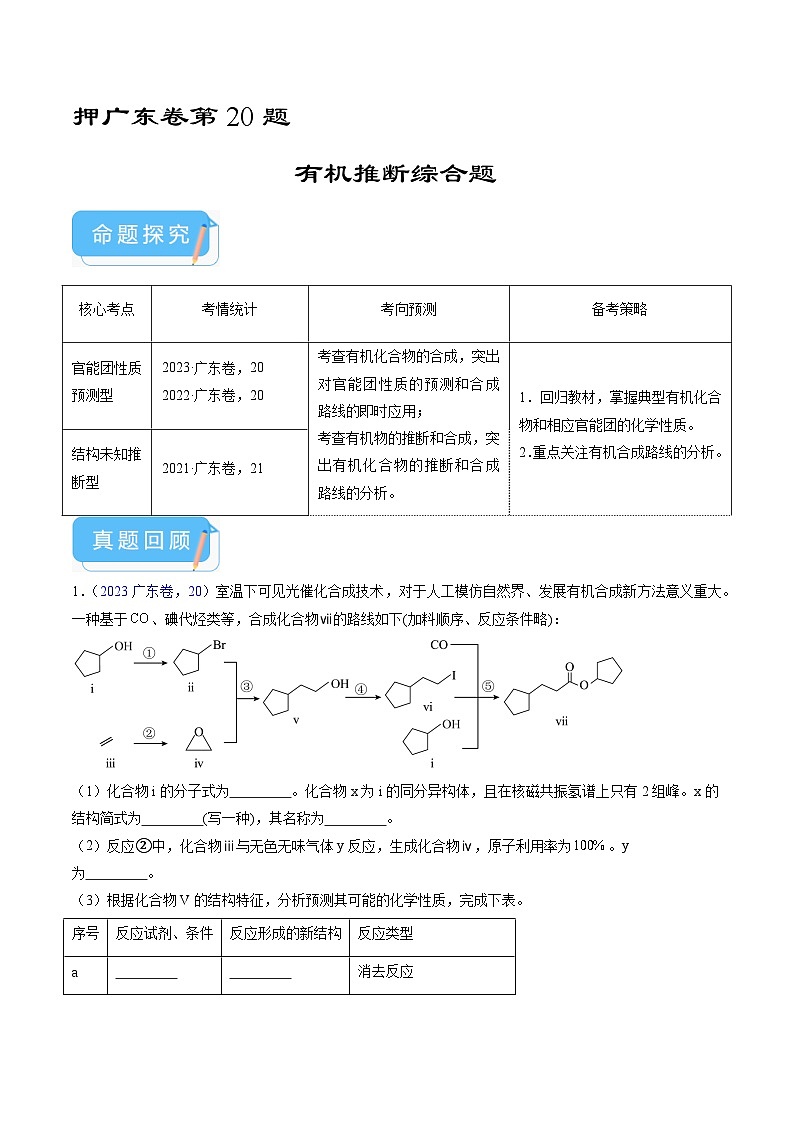
展开1.(2023广东卷,20)室温下可见光催化合成技术,对于人工模仿自然界、发展有机合成新方法意义重大。一种基于、碘代烃类等,合成化合物ⅶ的路线如下(加料顺序、反应条件略):
(1)化合物i的分子式为 。化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰。x的结构简式为 (写一种),其名称为 。
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为。y为 。
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
(4)关于反应⑤的说法中,不正确的有___________。
A.反应过程中,有键和键断裂
B.反应过程中,有双键和单键形成
C.反应物i中,氧原子采取杂化,并且存在手性碳原子
D.属于极性分子,分子中存在由p轨道“头碰头”形成的键
(5)以苯、乙烯和为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。
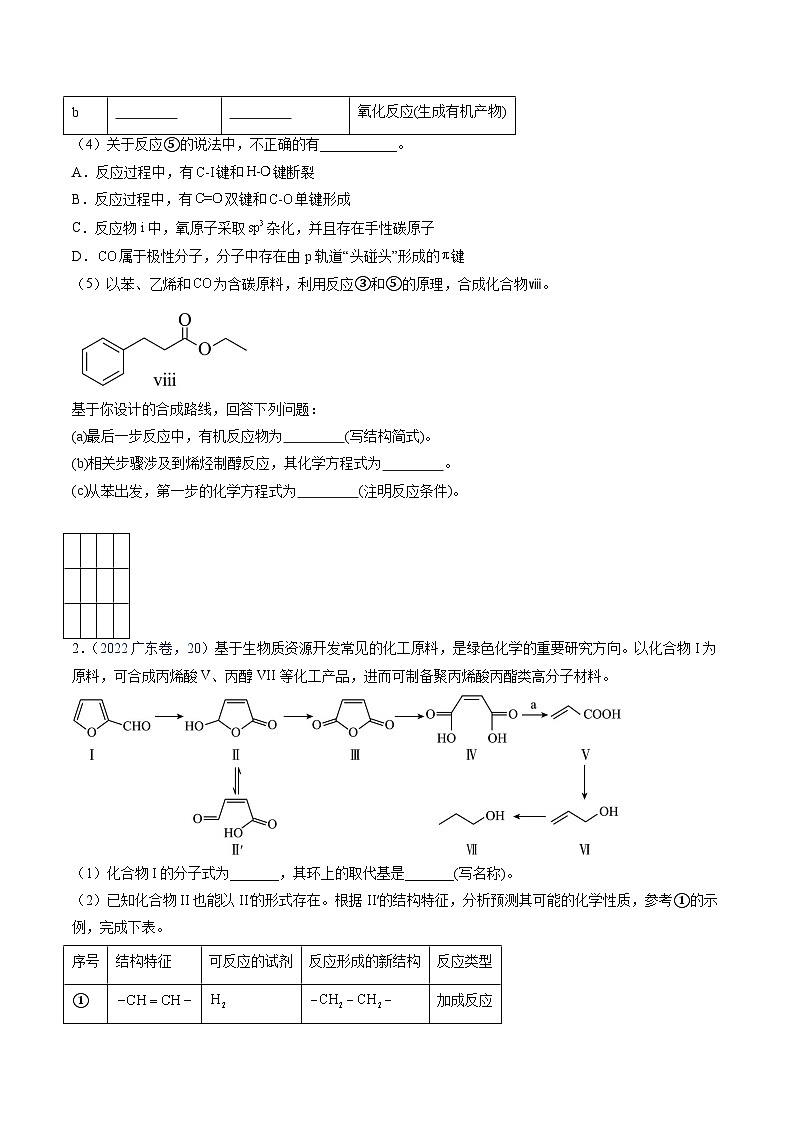
基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为 (写结构简式)。
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为 。
(c)从苯出发,第一步的化学方程式为 (注明反应条件)。
【答案】(1) (或 或 ) 戊酮(或二甲基丙醛或二甲基氧杂环丁烷)
(2)或氧气
(3)浓硫酸,加热 、,加热(或酸性溶液) (或 )
(4)CD
(5) 和
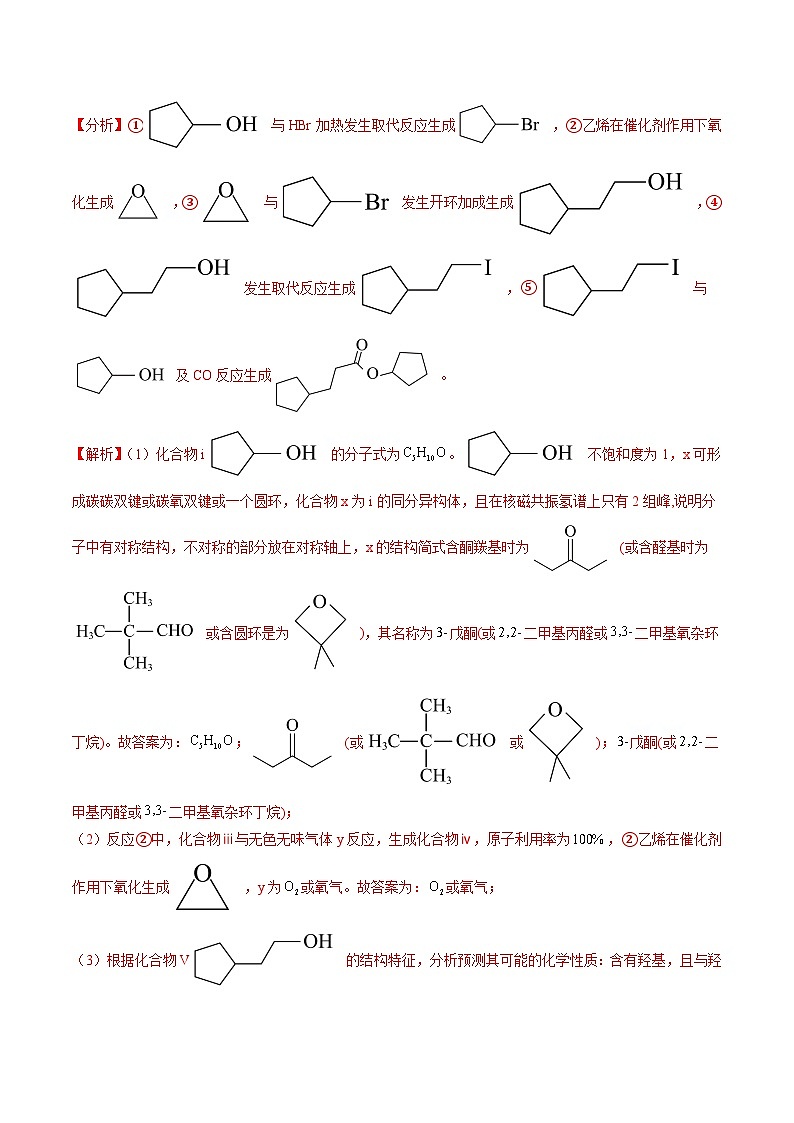
【分析】① 与HBr加热发生取代反应生成 ,②乙烯在催化剂作用下氧化生成 ,③ 与 发生开环加成生成 ,④ 发生取代反应生成 ,⑤ 与 及CO反应生成 。
【解析】(1)化合物i 的分子式为。 不饱和度为1,x可形成碳碳双键或碳氧双键或一个圆环,化合物x为i的同分异构体,且在核磁共振氢谱上只有2组峰,说明分子中有对称结构,不对称的部分放在对称轴上,x的结构简式含酮羰基时为 (或含醛基时为 或含圆环是为 ),其名称为戊酮(或二甲基丙醛或二甲基氧杂环丁烷)。故答案为:; (或 或 );戊酮(或二甲基丙醛或二甲基氧杂环丁烷);
(2)反应②中,化合物ⅲ与无色无味气体y反应,生成化合物ⅳ,原子利用率为,②乙烯在催化剂作用下氧化生成 ,y为或氧气。故答案为:或氧气;
(3)根据化合物V 的结构特征,分析预测其可能的化学性质:含有羟基,且与羟基相连的碳的邻碳上有氢,可在浓硫酸、加热条件下发生消去反应生成 ,与羟基相连的碳上有氢,可在铜名银催化作用下氧化生成 ,或酸性溶液中氧化生成 ,见下表:
故答案为:浓硫酸,加热; ;、,加热(或酸性溶液); (或 );
(4)A. 从产物中不存在键和键可以看出,反应过程中,有键和键断裂,故A正确;
B. 反应物中不存在双键,酰碘基中碘原子离去与羟基中氢离去,余下的部分结合形成酯基中单键,所以反应过程中,有双键和单键形成,故B正确;
C. 反应物i 中,氧原子采取杂化,但与羟基相连的碳有对称轴,其它碳上均有2个氢,分子中不存在手性碳原子,故C错误;
D. 属于极性分子,分子中存在由p轨道“肩并肩”形成的键,故D错误;
故答案为:CD;
(5)以苯、乙烯和为含碳原料,利用反应③和⑤的原理,合成化合物ⅷ。乙烯与水在催化剂加热加压条件下合成乙醇;乙烯在银催化作用下氧化生成环氧乙醚;苯在铁催化作用下与溴生成溴苯,溴苯与环氧乙醚生成 ,与HI反应合成 ,最后根据反应⑤的原理, 与乙醇、CO合成化合物ⅷ。
(a)最后一步反应中,有机反应物为 和。故答案为: 和;
(b)相关步骤涉及到烯烃制醇反应,其化学方程式为。故答案为:;
(c)从苯出发,第一步的化学方程式为 。故答案为: 。
2.(2022广东卷,20)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。以化合物I为原料,可合成丙烯酸V、丙醇VII等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
(1)化合物I的分子式为_______,其环上的取代基是_______(写名称)。
(2)已知化合物II也能以II′的形式存在。根据II′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。
(3)化合物IV能溶于水,其原因是_______。
(4)化合物IV到化合物V的反应是原子利用率的反应,且与化合物a反应得到,则化合物a为_______。
(5)化合物VI有多种同分异构体,其中含结构的有_______种,核磁共振氢谱图上只有一组峰的结构简式为_______。
(6)选用含二个羧基的化合物作为唯一的含氧有机原料,参考上述信息,制备高分子化合物VIII的单体。
写出VIII的单体的合成路线_______(不用注明反应条件)。
【答案】(1) C5H4O2 醛基
(2) -CHO O2 -COOH -COOH CH3OH - COOCH3 酯化反应(取代反应)
(3)Ⅳ中羟基能与水分子形成分子间氢键
(4)乙烯
(5) 2
(6)
【解析】(1)根据化合物Ⅰ的结构简式可知,其分子式为C5H4O2;其环上的取代基为醛基;
(2)②化合物Ⅱ'中含有的-CHO可以被氧化为-COOH;
③化合物Ⅱ'中含有-COOH,可与含有羟基的物质(如甲醇)发生酯化反应生成酯;
(3)化合物Ⅳ中含有羟基,能与水分子形成分子间氢键,使其能溶于水;
(4)化合物Ⅳ到化合物Ⅴ的反应是原子利用率100%的反应,且1 mlⅣ与1 mla反应得到2mlV,则a的分子式为C2H4,为乙烯;
(5)化合物Ⅵ的分子式为C3H6O,其同分异构体中含有,则符合条件的同分异构体有和,共2种,其中核磁共振氢谱中只有一组峰的结构简式为;
(6)根据化合物Ⅷ的结构简式可知,其单体为,其原料中的含氧有机物只有一种含二个羧基的化合物,原料可以是,发生题干Ⅳ→V的反应得到,还原为,再加成得到,和发生酯化反应得到目标产物,则合成路线为。
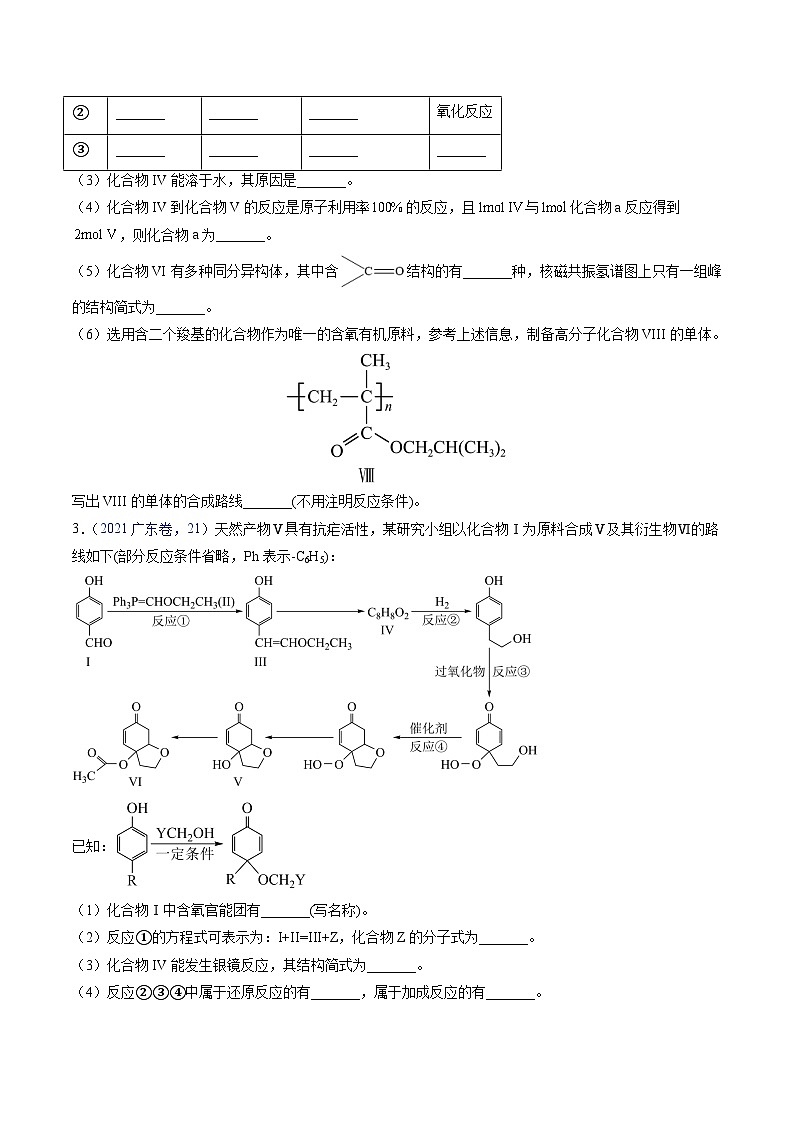
3.(2021广东卷,21)天然产物Ⅴ具有抗疟活性,某研究小组以化合物Ⅰ为原料合成Ⅴ及其衍生物Ⅵ的路线如下(部分反应条件省略,Ph表示-C6H5):
已知:
(1)化合物Ⅰ中含氧官能团有_______(写名称)。
(2)反应①的方程式可表示为:I+II=III+Z,化合物Z的分子式为_______。
(3)化合物IV能发生银镜反应,其结构简式为_______。
(4)反应②③④中属于还原反应的有_______,属于加成反应的有_______。
(5)化合物Ⅵ的芳香族同分异构体中,同时满足如下条件的有_______种,写出其中任意一种的结构简式:_______。
条件:a.能与NaHCO3反应;b. 最多能与2倍物质的量的NaOH反应;c. 能与3倍物质的量的Na发生放出H2的反应;d.核磁共振氢谱确定分子中有6个化学环境相同的氢原子;e.不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
(6)根据上述信息,写出以苯酚的一种同系物及HOCH2CH2Cl为原料合成的路线_______(不需注明反应条件)。
【答案】(酚)羟基、醛基 C18H15OP ② ②④ 10
【解析】
(1)根据有机物Ⅰ的结构,有机物Ⅰ为对醛基苯酚,其含氧官能团为(酚)羟基、醛基;
(2)反应①的方程式可表示为:Ⅰ+Ⅱ=Ⅲ+Z,根据反应中Ⅰ、Ⅱ、Ⅲ的分子式和质量守恒定律可知,反应前与反应后的原子个数相同,则反应后Z的分子式为C18H15OP;
(3)已知有机物Ⅳ可以发生银镜反应,说明有机物Ⅳ中含有醛基,又已知有机物Ⅳ可以发生反应生成,则有机物Ⅳ一定含有酚羟基,根据有机物Ⅳ的分子式和可以得出,有机物Ⅳ的结构简式为;
(4)还原反应时物质中元素的化合价降低,在有机反应中一般表现为加氢或者去氧,所以反应②为还原反应,其中反应②④为加成反应;
(5)化合物Ⅳ的分子式为C10H12O4,能与NaHCO3反应说明含有羧基,能与NaOH反应说明含有酚羟基或羧基或酯基,最多能与2倍物质的量的NaOH反应,说明除一个羧基外还可能含有酚羟基、羧基、酯基其中的一个,能与Na反应的挂能能团为醇羟基、酚羟基、羧基,能与3倍物质的量的发生放出的反应,说明一定含有醇羟基,综上该分子一定含有羧基和醇羟基,由于该分子共有4个碳氧原子,不可能再含有羧基和酯基,则还应含有酚羟基,核磁共振氢谱确定分子中有6个化学环境相同的氢原子,说明含有两个甲基取代基,并且高度对称,据此可知共有三个取代基,分别是-OH、-COOH和,当-OH与-COOH处于对位时,有两种不同的取代位置,即和;当-OH与处于对位时,-COOH有两种不同的取代位置,即和;当-COOH与处于对位时,-OH有两种不同的取代位置,即和;当三个取代基处于三个连续碳时,共有三种情况,即、和;当三个取代基处于间位时,共有一种情况,即,综上分析该有机物的同分异构体共有十种。
(6)根据题给已知条件对甲苯酚与HOCH2CH2Cl反应能得到,之后水解反应得到,观察题中反应可知得到目标产物需要利用反应④,所以合成的路线为。
命题热点1 有机物结构、性质分析与反应类型判断
1.常见有机反应类型总结
2.有机反应方程式的书写要求
(1)反应箭头和配平:书写有机反应方程式时应注意反应物和产物之间用“”连接,有机物用结构简式表示,并遵循原子守恒进行配平,特别注意酯化反应、缩聚反应不能漏掉小分子(如H2O等)。
(2)反应条件:有机反应大多要在一定条件下才能进行,要注意反应条件的标注,有机物反应条件不同,所得产物不同,若不写反应条件要扣分。
(3)有些有机反应须用中文标明,如淀粉、麦芽糖的水解反应等。
命题热点2 限制条件下同分异构体数目判断及书写
1.常见限制条件与结构关系总结
2.限定条件的同分异构体书写技巧
(1)确定碎片:明确书写什么物质的同分异构体,该物质的组成情况怎么样。解读限制条件,从性质联想结构,将物质分裂成一个个碎片,碎片可以是官能团,也可以是烃基(尤其是官能团之外的饱和碳原子)。
(2)组装分子:要关注分子的结构特点,包括几何特征和化学特征。几何特征是指所组装的分子是空间结构还是平面结构,有无对称性。化学特征包括核磁共振氢谱等。
(3)例解思路。
3.含苯环的同分异构体数目确定技巧
(1)若苯环上连有2个取代基,其结构有邻、间、对3种。
(2)若苯环上连有3个相同的取代基,其结构有3种。
(3)若苯环上连有—X、—X、—Y 3个取代基,其结构有6种。
(4)若苯环上连有—X、—Y、—Z 3个不同的取代基,其结构有10种。
命题热点3 合成路线的分析与设计
1.有机合成中官能团的转变
续 表
2.常考的成环反应
3.苯环上的定位效应
(1)邻、对位定位基。
当苯环上已有烷烃基(—R)、—OH、—NH2、—OR、—NHCOR、—OOCR或—X(Cl、Br、I)基团时,新引入的取代基一般在原有取代基的邻位或对位。
(2)间位定位基。
当苯环上已有—NO2、—CHO、—COOH、—CN、—COR、—CF3基团时,新引入的取代基一般在原有取代基的间位。
如:+HNO3+H2O。
4.有机物碳骨架的构建
续 表
5.有机合成的解题技能
考点一 官能团性质预测型
1.(2024届广东省深圳一模)我国科学家从土曲霉中发现了一种抗阿尔茨海默症效果良好的药物,其中间体化合物Ⅸ的合成路线如下(部分反应条件省略):
(1)化合物Ⅰ中的含氧官能团的名称为 。
(2)化合物Ⅰ还可与化合物M在一定条件下反应,生成化合物Ⅱ,原子利用率为100%,M的化学式为 。
(3)在分子组成上比化合物Ⅳ()少的化合物N有多种同分异构体,能发生银镜反应且属于芳香族化合物的有 种,其中核磁共振氢谱有4组峰的结构简式为 (任写一种)。
(4)根据化合物Ⅴ的结构特征,分析预测其可能的化学性质,完成下表。
(5)下列与反应⑦相关的描述不正确的有________(填标号)。
A.反应过程中,有断裂和键形成
B.中的空间结构为正四面体形
C.化合物Ⅶ和Ⅷ的分子中均含有手性碳原子
D.化合物Ⅶ分子中,存在由轨道“头碰头”形成的键
(6)参照上述合成路线,请设计以为主要原料合成的路线 (不用注明反应条件)。
【答案】(1)酯基
(2)HBrO
(3)14 或
(4)氢气、催化剂,加热 加成反应
(5)AD
(6)
【分析】
本题根据题中所给物质进行分析即可。
【解析】(1)由I的结构简式可知,化合物Ⅰ中的含氧官能团的名称为酯基,故答案为:酯基;
(2)化合物Ⅰ的分子式为C12H20O2,化合物Ⅱ的分子式为C12H21O3Br,化合物I可与化合物M在一定条件下反应,生成化合物Ⅱ,原子利用率为100%,则M的化学式为HBrO,故答案为:HBrO;
(3)在分子组成上比化合物Ⅳ(C13H20O)少C4H10的化合物N的分子式为C9H10O,不饱和度为5,能发生银镜反应且属于芳香族化合物,则该化合物含有苯环和醛基,若苯环上连有一个取代基,该取代基可能为-CH2CH2CHO或-CH(CHO)CH3,共两种,若苯环上连有2个取代基,则可能连有-CH3和-CH2CHO、-CH2CH3和-CHO,分别有邻间对三种,共有6种,若苯环上连有三个取代基,则连有两个—CH3和一个-CHO,共有6种,因此化合物N共有14种;其中核磁共振氢谱有4组峰的结构简式为或,故答案为:14;或。
(4)化合物Ⅴ中含有碳碳双键,可以在催化剂加热的条件下与氢气发生加成反应,含有羟基,在浓硫酸加热条件下可发生消去反应,故答案为:氢气、催化剂,加热;加成反应;。
(5)A.观察化合物Ⅶ和Ⅷ的结构可知,反应过程中有C=O断裂和O-H、C-H键形成,故A错误;
B.中心原子的价电子对数为,孤电子对数为0,因此的空间结构为正四面体形,故B正确;
C.手性碳原子指连有四个不同的原子或原子团的碳原子,化合物VII和VIII的分子中均含有手性碳原子,故C正确;
D.“头碰头”形成σ键,“肩并肩”形成π键,故D错误;
故答案为:AD。
(6)参照上述流程可得以为主要原料合成的路线为:,故答案为:。
2.(2024届广东省2月大联考)碳中和、碳循环是科学家们研究的热门课题,一种以CO2为碳源和胺类化合物合成甲基红(化合物ⅷ)的路线如图所示(加料顺序、反应条件略):
已知:重氮盐(含结构)与胺类或酚类发生偶合反应,偶合位置优先选择氨基或酚羟基的对位。
回答下列问题:
(1)化合物ⅰ的分子式为 ;芳香族化合物x为化合物ⅰ的同分异构体,其核磁共振氢谱有4组峰,则x的结构简式为 ,其化学名称为 。
(2)反应①中,除了生成化合物ⅱ外,还有另外一种产物y为 (填化学式)。
(3)根据化合物ⅱ的结构特征,分析预测其可能的化学性质,完成下表。
(4)下列关于反应⑤的说法正确的有______(填选项字母)。
A.反应⑤中,有键和键的断裂
B.反应物ⅵ中,C原子和N原子的杂化方式完全相同
C.产物ⅶ中,不存在手性碳原子
D.反应⑤的另一种产物z属于极性分子,存在仅由p轨道“头碰头”形成的键
(5)以苯为含碳原料,利用上述有机合成路线的原理,合成化合物,基于你设计的合成路线,回答下列问题:
①最后一步反应的化学方程式为 .
②相关步骤涉及卤代烃制酚的反应,写出该反应第一步的化学方程式: .
③从苯出发制重氮盐,经过第一步反应得到的产物为 (填结构简式)。
【答案】(1) 对甲基苯胺
(2)
(3),催化剂, 溶液, ,HCOONa
(4)AC
(5)
【分析】ⅰ与CO2、H2发生反应生成ⅱ,ⅱ去O加H发生还原反应生成ⅲ,ⅳ还原得到ⅴ,ⅴ转化为ⅵ,ⅲ与ⅵ偶合得到ⅶ,ⅶ氧化得到ⅷ。
【解析】(1)结构简式为的化合物ⅰ的分子式为;x为芳香族化合物,含有苯环,核磁共振氢谱上只有4组峰,不对称的部分放在对称轴上,x的结构简式为,其化学名称为对甲基苯胺(或对甲苯胺或4-甲基苯胺或对氨基甲苯或4-氨基甲苯);
(2)反应①中,除了生成化合物ⅱ外,还有另外一种产物y,根据元素质量守恒,可推出y中O与H的比值1∶2,y为。
(3)化合物ⅱ含有苯环,可发生加成反应,含有酰胺基,可以发生水解反应,填表为:
(4)A.从反应物ⅲ到产物ⅶ,是ⅵ取代了ⅲ中叔胺基对位的原子,涉及键的断裂,从ⅵ到ⅶ的过程中,有键断裂,形成了键,A项正确;
B.化合物ⅵ中碳原子为杂化和杂化,与氮原子的杂化方式不完全相同,B项错误;
C.产物ⅶ中有C原子采取杂化,但该原子上连接的是三个,不存在手性碳,C项正确;
D.根据元素质量守恒,可以推出另外一种产物为,属于极性分子,是由原子轨道和原子轨道“头碰头”形成的s-p键,D项错误;
答案选AC。
(5)化合物中两个苯环相接是利用题目信息中重氮盐与酚类或胺类发生的偶合反应,通过逆推法知在酚羟基对位将重氮盐与苯酚偶合,合成路线如图所示:(反应条件与所需试剂略)
①最后一步反应是偶合反应,化学方程式为。
②从氯代烃到酚,需要先碱性水解再酸化,反应第一步水解的化学方程式为。
③模仿反应信息,从苯出发得到重氮盐需要先得到硝基苯,再进行反应③、④,故答案为。
3.(2024届广东省广州市黄浦区二模)温室气体资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。
(1)化合物E的分子式为 ,它的芳香同分异构体中,核磁共振氢谱为四组峰,峰面积比为的结构简式为 (写一种)。
(2)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(3)A与x反应生成B,该反应的原子利用率为100%,x为 。
(4)C到D反应的化学方程式为 。
(5)下列有关说法正确的有_______。
A.F到G的反应过程中,有C=C双键的断裂和C-O键的形成
B.G到H的反应过程中,有C=O双键和C-O键的形成
C.化合物E中的碳原子只有sp和sp2两种杂化方式,且不存在手性碳原子
D.CO2属于非极性分子,其分子空间结构为直线型
(6)选用A的同系物和x为原料,参考上述信息,制备和。写出该合成路线 (无机试剂任选)。
【答案】(1)C9H8O (其余符合条件的物质也可)
(2)O2、Cu/△ -CHO
(3)
(4)+Br2+HBr
(5)C
(6)+
【解析】(1)由图可知,E的分子式为:C9H8O;其芳香同分异构体中,核磁共振氢谱为四组峰,峰面积比为3:2:2:1,即该物质有苯环,有四种等效氢,且其数目比为:3:2:2:1,符合条件的物质为:(其余符合条件的物质也可);
(2)E发生生成有机产物的氧化反应,即E与O2在Cu作催化剂且加热的条件下生成;
(3)A与x反应生成B,该反应的原子利用率为100%,根据A和B的结构可知,x为;
(4)C到D即苯环上有一个H被Br取代,化学方程式为:+Br2+HBr;
(5)A.由图可知,F到G有C=C双键的断裂和C-O键的形成,故A正确;
B.G与O=C=O反应得H,有C=O双键和C-O键的形成,故B正确;
C.E中与羟基相连的C为sp3杂化,故C错误;
D.CO2结构为O=C=O,C为sp杂化,属于直线型分子,分子的正电中心和负电中心重合,属于非极性分子,故D正确;
故选C。
(6)根据和的结构可知,它们由和CO2在TBAB和加热的条件下生成,由和H2O2在催化剂的条件下生成,是与氢气在Pt和加热条件下生成,由此可知原料A的同系物为,即合成路线为:+;
4.(2024届广东省佛山一模)Tapentadl是一种新型止痛药物,合成其中间体ⅷ的路线如下:
回答下列问题:
(1)化合物ⅰ的分子式为 ,含有的官能团名称为 。
(2)根据化合物iii的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应⑤的方程式可表示为ⅲ+ⅳ→ⅶ+y,化合物y的化学式为 。
(4)关于反应⑥的说法中,正确的有______。
A.反应过程中,有π键发生断裂B.化合物ⅶ的杂化的原子只有C
C.化合物ⅶ所有碳原子一定处于同一平面上D.化合物ⅷ只有1个手性碳原子
(5)化合物x是ⅱ的同分异构体,满足下列条件的同分异构体有 种。
a.含有苯环,且苯环上有两个侧链
b.与溶液反应显紫色
c.1 ml x与足量Na反应,生成1 ml
(6)以和NaCN为含碳原料,合成化合物。
基于你设计的合成路线,回答下列问题:
①相关步骤涉及到卤代烃制醇反应,其化学方程式为 。
②最后一步反应中,能与反应产生的有机反应物为 (写结构简式)。
【答案】(1)C7H8O2 羟基
(2) 氧化反应 HCN、催化剂 加成反应
(3)H2O
(4)A
(5)6
(6)+NaOH+NaCl
【解析】(1)由结构简式可知,化合物ⅰ的分子式为C7H8O2,含有的官能团为羟基。
(2)a.醛基与新制在加热条件下反应生成羧基,故反应生成的新物质为。
b.由反应形成的新物质为可知,化合物iii中的醛基与HCN在催化剂条件下发生加成反应。
(3)ⅲ+ⅳ→ⅶ+y,化学方程式为+ →+y,结合物质的结构简式可知,ⅲ和ⅳ发生加成反应生成ⅶ和y,反应前后原子个数守恒,故y为H2O。
(4)A.反应⑥过程中,碳碳双键变为碳碳单键,有π键发生断裂,A正确;
B.化合物ⅶ的杂化的原子有C、O,B错误;
C.化合物ⅶ有醚键和乙基,单键可以旋转,则所有碳原子不可能处于同一平面上,C错误;
D.化合物ⅷ含有2个手性碳原子,如图,D错误;
故选A。
(5)化合物x是ⅱ的同分异构体,满足条件:含有苯环,且苯环上有两个侧链;与溶液反应显紫色,则含有酚羟基;1 ml x与足量Na反应,生成1 ml ,则含有2个羟基。x的苯环上连有—OH、—CH2CH2OH或—OH、—CHOHCH3,两组取代基在苯环上均有邻、间、对三种位置关系,因此x共有6种。
(6)采用逆推法可知,由和发生酯化反应得到,由水解得到,由水解得到,由和NaCN反应得到。①涉及的卤代烃制醇反应的化学方程式为+NaOH+NaCl。②最后一步反应为和的酯化反应,能与反应产生的有机反应物为。
5.(2024届广东省广州一模)利用不对称催化合成方法选择性的引入手性碳原子,对天然分子的人工合成意义重大,一种天然产物的部分合成路线如下图所示(加料顺序、部分反应条件略):
(1)I的名称是 ,Ⅱ中含氧官能团的名称是 。
(2)根据化合物Ⅲ的结构特征,分析预测其可能的化学性质,完成下表。
(3)反应③的化学方程式可表示为,则化合物的分子式为 。
(4)关于反应⑥的说法中,正确的有_______。(填字母)
A.反应过程中,有键断裂和键、键形成
B.反应过程中,不涉及键的断裂和形成
C.化合物Ⅵ中原子的杂化轨道类型只有和
D.每个Ⅵ和Ⅶ分子的手性碳原子个数相同
(5)化合物是Ⅳ的同分异构体,能与反应且在核磁共振氢谱上只有3组峰。的结构简式为 。
(6)以甲苯和为有机原料,利用反应⑤的原理,制备高分子化合物Ⅷ。基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为 (写结构简式)
(b)相关步骤涉及卤代烃制醇反应,其化学方程式为 。
(c)从甲苯出发第一步反应的试剂及反应条件为 。
【答案】(1)2-甲基丙醛 酯基
(2) 乙酸,浓硫酸、加热 取代反应
(3)C4H10O
(4)AC
(5)
(6) +NaOH+NaCl Cl2、光照
【分析】
以甲苯和为有机原料,利用反应⑤的原理,制备高分子化合物Ⅷ ,Ⅷ可由发生加聚反应得到,可由和发生反应⑤的原理得到,可由发生催化氧化反应得到,可由发生水解反应得到,可由甲苯先发生取代得到。
【解析】(1)I的名称是2-甲基丙醛,Ⅱ中含氧官能团的名称是酯基。
(2)Ⅲ中含有碳碳双键可以和Br2发生加成反应生成,Ⅲ中含有羟基,反应后变为乙酸酯,因此反应条件为浓硫酸、加热,反应试剂为乙酸,反应类型为取代反应。
(3)由原子守恒结合Ⅲ和Ⅳ的结构可知,化合物的分子式为C4H10O。
(4)A.分析Ⅵ和Ⅶ的结构简式可知,反应过程中,环氧环处有C−O键断裂,C-O断裂后有O-H的形成,也有C−H键形成,故A正确;
B.该反应中双键的位置发生了变化,涉及π键的断裂和形成,故B错误;
C.化合物Ⅵ中含有碳碳双键、酯基和甲基,C原子的杂化轨道类型只有sp2和sp3,故C正确;
D.手性碳原子是指与四个各不相同原子或基团相连的碳原子,Ⅵ中有2个手性碳原子,Ⅶ中只有1个手性碳原子,故D错误;
故选AC。
(5)化合物是Ⅳ的同分异构体,能与反应,说明其中含有-COOH,在核磁共振氢谱上只有3组峰,说明Y是对称的结构,含有3种环境的H原子,的结构简式为。
(6)Ⅷ可由发生加聚反应得到,可由和发生反应⑤的原理得到,可由发生催化氧化反应得到,可由发生水解反应得到,可由甲苯先发生取代得到,最后一步反应中,有机反应物为,相关步骤涉及卤代烃制醇反应,其化学方程式为+NaOH+NaCl;从甲苯出发第一步反应的试剂及反应条件为Cl2、光照。
6.(2024届广东省江门一模)化合物ⅷ是某合成药物的一种中间体,可采用如下路线合成(部分条件和试剂未标明):
(1)化合物ⅰ的名称为 ,化合物ⅱ的分子式为 。
(2)六元碳环化合物ⅸ是化合物ii的同分异构体,且在核磁共振氢谱上只有3组峰,写出符合上述条件的化合物ⅸ的结构简式 (写出两种)。
(3)化合物为化合物ⅲ的同分异构体,根据的结构特征,分析预测其可能的化学性质,完成下表。
(4)下列说法中不正确的有______。
A.化合物ⅵ中,元素电负性由大到小的顺序为
B.反应⑤过程中,有键和键形成
C.化合物ⅳ存在手性碳原子,氧原子采取杂化
D.属于非极性分子,存在由p轨道“头碰头”形成的键
(5)以和为含碳原料,利用反应①和②的原理,合成化合物。基于你设计的合成路线,回答下列问题:
①最后一步反应中,环状有机反应物为 (写结构简式)。
②相关步骤涉及到醇的氧化反应,该反应的化学方程式为 。
③从出发,第一步的化学方程式为 (注明反应条件)。
【答案】(1)环戊酮 C6H10N2
(2)、
(3)氢氧化钠醇溶液,加热 消去反应 新制氢氧化铜加热,酸化 -COOH
(4)CD
(5) +O2+H2O +NaOH+NaBr
【分析】
由流程可知,ⅰ中羰基加成得到ⅱ,ⅱ和ⅲ发生取代引入支链得到ⅳ,ⅳ在过氧化氢作用下,-CN转化为酰胺基得到ⅴ,ⅴ在氢氧化钠作用下转化为ⅵ,ⅵ和ⅶ发生取代反应生成ⅷ;
【解析】(1)由图可知,化合物ⅰ的名称为环戊酮,化合物ⅱ的分子式为C6H10N2;
(2)六元碳环化合物ⅸ是化合物ii的同分异构体,且在核磁共振氢谱上只有3组峰,则分子结构对称,可以为、;
(3)卤代烃在氢氧化钠醇溶液加热条件下,发生消去反应可以生成碳碳双键;醛基具有还原性,在碱性条件下可以和新制氢氧化铜沉淀加热发生氧化还原反应转化为羧酸盐,酸化后得到羧基;
(4)A.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;化合物ⅵ中,元素电负性由大到小的顺序为,正确;
B.反应⑤过程中溴原子取代氨基氢生成HBr和ⅷ,故反应过程中有键和键形成,正确;
C.手性碳原子是连有四个不同基团的碳原子;由接哦股可知化合物ⅳ中不存在手性碳原子;,氧原子形成碳氧双键,且存在2对孤电子对,O采取杂化,错误;
D.分子中正负电荷重心不重合,属于极性分子,错误;
故选CD;
(5)在氢氧化钠水溶液条件下发生取代反应生成,羟基氧化为铜极得到,发生反应①原理得到,再和发生②原理得到产物;故:
①最后一步反应中,环状有机反应物为。
②相关步骤涉及到醇的氧化反应,该反应的化学方程式为+O2+H2O。
③从出发,第一步的化学方程式为+NaOH+NaBr。
7.(2024届广东省梅州一模)11月14日是世界糖尿病日,“均衡饮食,增强锻炼”是预防糖尿病行之有效的方法。化合物H为某种用于2型糖尿病药物的中间体,其合成路线如下:
(1)化合物A的分子式为 。写出化合物E的任意一种含有苯环的同分异构体的结构简式 ,该同分异构体的名称为 。
(2)反应③中,化合物C与生成化合物D、HCl和常见气体X,则X为 。
(3)已知表示,根据化合物B的结构特征,分析预测其可能的化学性质,完成下表。
(4)关于反应⑥,下列说法不正确的是__________。
A.反应过程中,有键断裂B.反应过程中,有单键形成
C.化合物H中,氧原子采取杂化D.反应①和⑥的目的是为了保护羟基不被氧化
(5)以甲苯为含碳原料,利用反应③和④的原理,合成化合物K。
①从甲苯出发,第一步反应需要用到的无机试剂为 。
②最后一步反应的化学方程式为 。
【答案】(1)C8H8O3 或或, 邻二甲苯或1,2二甲苯、间二甲苯或1,3二甲苯、对二甲苯或1,4二甲苯
(2)SO2
(3)H2、催化剂、加热 NaOH水溶液 取代反应
(4)CD
(5)酸性高锰酸钾溶液 ++HCl
【分析】
A和Ac2O发生取代反应生成B,B和I2发生取代反应生成C,C和SOCl2发生取代反应生成D,D和E发生取代反应生成F,F在一定条件下发生氧化反应生成G,G发生取代反应生成H,以此解答。
【解析】(1)化合物A的分子式为C8H8O3,化合物E的含有苯环的同分异构体的结构简式为、、,命名分别为:邻二甲苯或1,2二甲苯、间二甲苯或1,3二甲苯、对二甲苯或1,4二甲苯。
(2)化合物C与发生取代反应生成化合物D、HCl和常见气体X,该过程中SOCl2首先分解出1个氯负离子,剩下的部分和醇形成氯化亚硫酸酯(C-O-SO-Cl),这个氯负离子攻击碳原子,同时断裂碳氧键和硫氯键,释放出SO2,X为SO2。
(3)B中含有苯环,可以和H2在催化剂、加热的条件下发生加成反应生成,B中含有羧基和酯基,可以和NaOH水溶液发生取代反应生成。
(4)A.反应⑥中Ac-转化为-OH,-C-O-键发生断裂,不存在-O-O-键断裂,A错误;
B.反应⑥中Ac-转化为-OH,没有C−O单键形成,B错误;
C.化合物H中存在-OH,O原子形成2个键和2个孤电子对,价层电子对数为4,采取杂化,C正确;
D.反应①和⑥羟基先被反应后又生成,目的是为了保护羟基不被氧化,D正确;
故选CD。
(5)以甲苯为含碳原料,利用反应③和④的原理,合成化合物K,甲苯先和酸性高锰酸钾溶液发生氧化反应生成,和SOCl2发生取代反应生成,和甲苯发生④的原理得到,
①第一步反应需要用到的无机试剂为:酸性高锰酸钾溶液;
②最后一步反应的化学方程式为++HCl。
8.(2024届广东省汕头一模)某研究小组按下列路线合成第三代喹诺酮类抗菌药物环丙沙星(Ⅰ)。
回答下列问题:
(1)C中含氧官能团名称是 。
(2)化合物D到化合物E的反应是原子利用率100%的反应,且1mlD与1ml化合物a反应生成1mlE,则化合物a的结构简式为 。
(3)F→G的反应类型为 。
(4)试用*在下图标出化合物E中的手性碳原子。
(5)化合物的同分异构体中,同时满足如下条件的有 种,
a)能与碳酸氢钠反应;b)最多能与2倍物质的量的Na反应。
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式为 。(写出一种即可)
(6)某研究小组设计以和为原料合成的路线如下。
(a)化合物Ⅱ的结构简式为 。
(b)写出Ⅱ→Ⅲ反应所需的试剂和条件 。
(c)写出反应Ⅳ→Ⅴ的化学反应方程式 。
【答案】(1)羰基、酯基
(2)
(3)取代反应
(4)
(5)12
(6) 氢氧化钠的水溶液加热
【分析】
化合物D到化合物E的反应是原子利用率100%的反应,则D和a发生加成反应生成E,由E逆推,可知化合物a的结构简式为;由B生成C的转化,可推出合物Ⅱ是, Ⅱ发生水解反应生成,发生催化氧化生成。
【解析】(1)根据C的结构简式,可知C中含氧官能团名称是羰基、酯基;
(2)化合物D到化合物E的反应是原子利用率100%的反应,且1mlD与1ml化合物a反应生成1mlE,则D和a发生加成反应生成E,由E逆推,可知化合物a的结构简式为。
(3)F→G是F中 苯环上去掉1个氯原子、亚氨基去掉1个 H原子,形成C-N键,反应类型为取代反应;
(4)手性碳是连接4个不同原子团的碳原子,化合物E中的手性碳原子为。
(5)a)能与碳酸氢钠反应,说明含有羧基;b)最多能与2倍物质的量的Na反应,说明含有1个羧基和1个羟基。同时满足条件的结构有CH3CH2CH2CH(OH)COOH、CH3CH2CH(OH)CH2COOH、CH3CH(OH)CH2CH2COOH、CH2(OH)CH2CH2CH2COOH、、、、、、、、,共12种;
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:1:1的结构简式为。
(6)(a)根据B生成C的转化,可知化合物Ⅱ的结构简式为;
(b)先水解为,再发生催化氧化生成,所以Ⅲ是,Ⅱ→Ⅲ反应所需的试剂和条件为氢氧化钠的水溶液加热。
(c)在一定条件下发生反应生成和水,反应Ⅳ→Ⅴ的化学反应方程式。
9.(2024届广东省韶关一模)水杨酸A具有解热镇痛的功效,其可作为医药工业的原料,用水杨酸制备平喘药沙丁胺醇的路线如下(Ac表示-COCH3;Ph表示-C6H5)。
(1)化合物 A的分子式为 ; 的反应类型为 。
(2)化合物 D中含有四种官能团,任选两种官能团进行检验。
限选试剂:NaOH溶液、稀硝酸、稀硫酸、新制氢氧化铜悬浊液、饱和溴水、硝酸银、NaHCO3溶液、FeCl3溶液。
(3)化合物M()是化合物A的同分异构体,其沸点M A(填“高于”或“低于”),理由是 。
(4)化合物C有多种同分异构体,写出其中一种能同时满足下列条件的芳香族化合物的结构简式 。
①能发生水解反应且最多能与4倍物质的量的NaOH反应
②核磁共振氢谱有四组峰,峰面积之比为 3:2:2:1
(5)以水杨酸、乙二醇以及甲基丙烯酸()为原料,利用的原理及所学知识,合成
基于你设计的路线,回答下列问题。
①从水杨酸出发,第一步反应的化学方程式为 。
②最后一步反应中,反应物为 (写结构简式)。
【答案】(1)C7H6O3 还原反应
(2)羟基 FeCl3 溶液混合后溶液变色 羧基 NaHCO3溶液 有无色气泡生成
(3)高于 M形成分子间氢键,A形成分子内氢键
(4)或者
(5)
【分析】A与Ac2O发生取代反应生成B,B在氯化铝催化作用下发生分子内取代反应生成C,C与溴单质发生取代反应生成D,D与发生取代反应生成E,E发生加氢反应生成F,F与氢气在催化剂条件下发生取代反应生成G,据此分析解答。
【解析】(1)根据A的结构简式可知其分子式为C7H6O3;E→F的转化过程中E的羰基转化为醇羟基,可知发生加氢反应,属于还原反应;
(2)D中官能团有酚羟基、羧基、羰基和溴原子,结合给定试剂可检验酚羟基和羧基,取D与氯化铁溶液混合,若溶液变紫色,可知存在酚羟基;取D与碳酸氢钠溶液混合,若产生无色气泡,可知存在羧基;
(3)由结构可知M中羧基、羟基位于苯环的对位,易形成分子间的氢键,使其沸点升高,而A中羟基、羧基位于苯环邻位,易形成分子内氢键,导致分子间作用力变小,沸点降低,因此M的沸点高于A;
(4)C满足下列条件的芳香族化合物的同分异构体:①能发生水解反应且最多能与4倍物质的量的NaOH反应,结合C的组成可知该结构中含有2个-OOCH,且处于对称位置;②核磁共振氢谱有四组峰,峰面积之比为3:2:2:1,结构中含有1个甲基;符合的结构有:和;
(5)可由发生加聚反应得到,可由乙二醇、甲基丙烯酸 以及发生酯化反应得到,可由与乙酸酐反应得到,由水杨酸出发,第一步反应的化学方程式为:;最后一步反应是加聚反应,反应物为。
10. (2024届广东省茂名一模)环状内酯(如)可以通过环状酮()在过氧乙酸()的氧化重排进行转化获得,其合成路线如下。回答下列问题:
(1)化合物的分子式为________。化合物为的同分异构体,红外光谱显示中含有碳碳三键,且在核磁共振氢谱上只有3组峰,峰面积之比为。的结构简式为________,其用系统命名法的名称为________。
(2)反应④产物与乙醇钠()反应,生成化合物Ⅶ和Y,Y为________。
(3)根据化合物Ⅳ的结构特征,分析预测其可能的化学性质,完成下表。
(4)关于反应①的说法中,不正确的有_________(填字母)。
A. 该反应是加成反应B. 生成物Ⅲ中所有原子共平面
C. 物质Ⅰ、Ⅲ、Ⅱ中C原子的杂化方式完全相同D. 反应过程中有非极性键的形成
(5)以戊二酸[]、乙醇()、乙醇钠()和过氧乙酸()为含碳原料以及无机酸、碱,利用上述流程中Ⅵ→Ⅷ的反应原理,合成化合物IX。基于你设计的合成路线,回答下列问题:
①最后一步反应中,有机反应物有过氧乙酸()和_______(写结构简式)。
②相关步骤涉及酯在碱性条件下的水解,以为例,写出其反应的化学方程式:______。
【答案】(1) ①. C8H14 ②. CH2CH2CH2C≡CCH2CH2CH3 ③. 4-辛炔
(2)乙醇 (3) ①. 浓硫酸,加热 ②. ③. 氢气,催化剂 ④. (4)BC
(5) ①. ②. +NaOH+EtOH
【分析】Ⅰ和Ⅱ发生加成反应生成Ⅲ,Ⅲ被还原生成羟基得到Ⅳ,Ⅳ中-CH2OH转化为甲基得到Ⅴ,Ⅴ氧化得到羧基生成Ⅵ,Ⅵ成环得到Ⅶ,Ⅶ氧化重排转化为Ⅷ;
【小问1详解】
由结构可知,化合物的分子式为C8H14;X的不饱和度为2,化合物为的同分异构体,红外光谱显示中含有碳碳三键,则不含有其它环和不饱和键,且在核磁共振氢谱上只有3组峰,峰面积之比为,则其结构对称,的结构简式为CH2CH2CH2C≡CCH2CH2CH3,其用系统命名法的名称为4-辛炔;
【小问2详解】
反应④为酯化反应生成,与乙醇钠()反应生成化合物Ⅶ和Y,结合结构变化可知中下侧的酯基中-EtO-脱去后生成Y乙醇,主体部分成环得到Ⅶ,故Y为乙醇;
【小问3详解】
Ⅳ中含有羟基,可以在浓硫酸、加热条件下发生消去反应转化为碳碳双键得到:;
分子中含有碳碳双键,能和氢气在催化剂下发生加成反应生成;
【小问4详解】
A.反应①为碳碳不饱和键的加成反应,正确;
B.生成物Ⅲ中含有饱和碳原子,饱和碳原子为四面体形,故所有原子不共平面,错误;
C.物质Ⅰ中碳原子均为碳碳双键碳,为sp2杂化;Ⅲ中碳碳双键碳、羰基碳为sp2杂化;Ⅱ中碳碳双键碳为sp2杂化、饱和碳为sp3杂化;C原子的杂化方式不完全相同,错误;
D.反应①中碳碳双键断裂,形成新的碳碳双键和碳碳单键,反应过程中有非极性键的形成,正确;
故选BC;
【小问5详解】
戊二酸[]通过反应④、⑤的反应原理成环转化为,通过3步反应:1.碱性水解将酯基转化为羧酸盐、2.酸化将羧酸盐转化为羧酸、3.加热去掉羧基得到环丁酮,在过氧乙酸()的氧化重排下进行转化获得产品;
①由分析可知,最后一步反应中,有机反应物有过氧乙酸()和;
②涉及酯在碱性条件下的水解反应为转化为的第1步反应中:1.碱性水解将酯基转化为羧酸盐,中含有酯基,在氢氧化钠条件下发生碱性水解生成和乙醇,反应为:+NaOH+EtOH。
考点二 结构未知推断型
11.(2024届广东省大湾区一模)本维莫德是一种天然微生物代谢产物中分离出来的非激素类小分子化合物,在治疗银屑病方面,具有治疗效果好、不良反应小、停药后复发率低等优势。一种合成路线如下:
回答下列问题:
(1)化合物A的分子式为 。
(2)C与乙醇反应的化学方程式 。
(3)根据化合物E的结构特征,分析预测其可能的化学性质,完成下表。
(4)关于反应⑥,以下说法正确的是
a.反应过程中有键和键的断裂
b.反应中涉及到的有机物均易溶于水
c.化合物G中C原子只采用了杂化
d.化合物F、H中均含有手性碳原子
(5)在B的同分异构体中,同时满足下列条件的共有 种。
①苯环上有三个取代基且有两个取代基相同;
②遇溶液显紫色;
③能发生水解反应和银镜反应。
(6)以苯甲醛为原料,参考上述信息,合成,基于你设计的合成路线,回答下列问题:
①最后一步反应中,有机反应物为 、 。
②相关步骤中,涉及到醛变醇的反应,其化学方程式为 。
【答案】(1)C7H6O4
(2)+C2H5OH+H2O
(3) 加成反应 NaOH水溶液 -OH 取代反应
(4)ac
(5)12
(6) +H2
【分析】A和CH3I发生取代反应生成B,结合B和异丙醇生成C可推断推出 B 为,B和异丙醇发生取代反应生成C,根据 C还原得D,D羟基被氯原子取代得E,E中氯原子被取代得F,F与G反应得H,H与O连接的甲基被氢取代得I;
【解析】(1)由A的结构简式可以得到A的分子式为C7H6O4;
(2)C中含有羧基,与乙醇发生酯化反应,反应的化学方程式为
+C2H5OH+H2O;
(3)E的结构中有官能团氯原子及苯环结构,根据表格中H2的提示,①应当为苯环,H2与苯环加成,生成饱和的六元碳环结构,故②填,反应类型③为加成反应,氯原子可以通过卤代烃的水解反应转化为羟基,④中可反应的试剂为NaOH水溶液,条件是加热,反应形成的新结构⑤为-OH,反应类型⑥为取代反应;
(4)a.反应⑥F中P-O键断裂,是σ键断裂,G有C=O键断裂,是σ键和π键的断裂,a正确;
b.反应中涉及到的有机物均F、G、H分子极性都较小,都不易溶于水,b错误;
c.化合物G中C原子对应有双键或苯环结构,只采用了sp2杂化,c正确;
d.手性碳原子是连接四个基团都不同的碳原子,化合物F、H中均不含有手性碳原子,d错误;
故选ac;
(5)B的结构简式为,除苯环外只有一个不饱和度,能发生水解反应和银镜反应,说明含有甲酸酯基-OCHO,且只有1个,其余基团都为饱和,遇FeCl3溶液显紫色说明有酚羟基,根据苯环上有三个取代基且有两个取代基相同,说明酚羟基有两个,甲酸酯基和剩下两个碳原子在同一个基团上,有-CH2CH2OCHO和-CH(OCHO)CH3两种连接方式,当苯环上含有两个相同的取代基和一个不同的取代基时,同分异构体的数目为6种,结合两种连接方式,B的同分异构体中,同时满足条件的共有12种;
(6)分析目标分子的结构和题目合成路线中H的结构以及题给已知信息,可推出中间产物1为, 中间产物2为, 由苯甲醇取代-OH得到,苯甲醇由苯甲醛与H2加成得到,然后正向写出合成路线:,故最后一步反应中,有机反应物为、,涉及到醛变醇的反应是苯甲醛还原为苯甲醇,其化学方程式为+H2。
12.(2024届广东省肇庆二模)PET是一种用途广泛的高分子材料,其合成的方法如图所示(反应所需的部分试剂与条件省略)。
(1)化合物I的分子式为 。化合物Ⅲ与酸性KMnO4溶液反应可得到化合物Ⅳ,则化合物Ⅳ的名称为 。
(2)化合物Ⅴ是环状分子,与H2O加成可得到化合物Ⅵ,则化合物Ⅴ的结构简式为 。
(3)化合物Ⅶ是化合物Ⅱ与足量H2加成后所得产物的一种同分异构体,其核磁共振氢谱中峰面积比为3:1:3,请写出一种符合条件的化合物Ⅶ的结构简式: 。
(4)根据化合物Ⅲ的结构特征,分析预测其可能具有的化学性质,并完成下表:
(5)下列关于反应①②的说法中正确的有___________(填标号)。
A.反应①为加成反应
B.化合物Ⅲ中所有原子共平面
C.反应②过程中,有C-O键和C-H键的断裂
D.化合物Ⅱ中,氧原子采取sp3杂化,且不含手性碳原子
(6)请以与丙烯为含碳原料,利用所学知识与上述合成路线的信息,合成化合物,并基于你的合成路线,回答下列问题:
(a)从出发,第一步反应的产物为 (写结构简式)。
(b)相关步骤涉及酯化反应,其化学方程式为 (注明反应条件)。
【答案】(1)C6H8O 对苯二甲酸(或1,4-苯二甲酸)
(2)
(3)
(4)H2,催化剂、△ 加成反应或还原反应 Br2,Fe或FeBr3(或Cl2,光照) (或)
(5)AC
(6) + CH3CHOHCH3+H2O
【分析】Ⅰ和乙烯发生加成反应生成Ⅱ,Ⅱ转化为Ⅲ:对二甲苯,对二甲苯与酸性KMnO4溶液反应可得到化合物Ⅳ,则为甲基被氧化为羧基得到Ⅳ:对苯二甲酸(或1,4-苯二甲酸);乙烯转化为Ⅴ,化合物Ⅴ是环状分子,与H2O加成可得到化合物Ⅵ,则Ⅴ为环氧乙烷;Ⅳ:对苯二甲酸与Ⅵ:乙二醇发生缩聚反应生成PET;
【解析】(1)由图可知,化合物I的分子式为C6H8O。化合物Ⅲ与酸性KMnO4溶液反应使得甲基被氧化为羧基得到化合物Ⅳ,则化合物Ⅳ的名称为对苯二甲酸(或1,4-苯二甲酸);
(2)由分析可知,化合物Ⅴ的结构简式为;
(3)化合物Ⅱ与足量H2加成后得到,分子中含有8个碳、1个氧、不饱和度为2,其同分异构体中核磁共振氢谱中峰面积比为3:1:3,则为对称结构且应该含有2组每组2个甲基,结构可以为:;
(4)苯在催化剂加热条件下和氢气发生加成反应生成,故答案为: H2,催化剂、△;加成反应或还原反应;
Ⅲ中苯环氢、甲基氢均可以发生取代反应,在铁催化作用下苯环氢可以被溴取代生成;在光照条件下,甲基氢可以被氯气中氯取代生成;故答案为:Br2,Fe或FeBr3(或Cl2,光照);(或);
(5)A.反应①得到产物的不饱和度减小,为加成反应,正确;
B.化合物Ⅲ中含有甲基,甲基为四面体结构,所有原子不共平面,错误;
C.反应②过程中,有C-O键和C-H键的断裂,反应生成苯环和小分子水,正确;
D.化合物Ⅱ中,氧原子形成2个共价键且存在2对孤电子对,采取sp3杂化;分子中含手性碳原子,错误;
故选AC;
(6)本题采用逆向合成法,即可由和CH3CHOHCH3通过酯化反应制得,CH3CHBrCH3在NaOH水溶液中加热发生水解反应即可制得CH3CHOHCH3,根据题干转化③信息可知,苯甲酸可由甲苯氧化得到,根据题干转化②信息可知,甲苯可由转化而得,根据题干转化①信息可知,可由和CH2=CHCH3转化而得,而CH3CHBrCH3在NaOH醇溶液中加热发生消去反应即可制得CH2=CHCH3;
(a)由分析可知,从出发,第一步反应的产物为。
(b) 由分析可知,相关步骤涉及酯化反应,其化学方程式为:+ CH3CHOHCH3+H2O。
13.(2024届广东省省一模)偏苯三酸是工业上重要的日用化学品,其合成路线如下:
已知:
(1)化合物i的分子式为 ,其含氧官能团的名称为 。化合物x为化合物i的同分异构体,其分子中含碳碳双键,能与NaHCO3溶液反应,且核磁共振氢谱峰面积比为1:1:6的化合物的结构简式为 (写一种)。
(2)反应①为两分子化合物ii合成化合物iii,原子利用率为100%,则化合物ii的结构简式为 。
(3)根据化合物vii的结构特征,分析预测其可能的化学性质,完成下表:
(4)反应③中,化合物iv脱水可得到两种产物,两种产物之间存在转化平衡反应:
,其中一种产物v与化合物i反应生成化合物vi。下列说法不正确的有______(填字母)。
A.化合物v的结构简式为
B.反应④发生时,转化平衡反应逆向移动
C.化合物iv易溶于水,因为它能与水分子形成氢键
D.化合物vi中存在sp2与sp3杂化碳原子间的键,且每个vi分子中存在1个手性碳原子
(5)以2-丁烯为含碳原料,结合反应④~⑦的原理合成。基于你设计的合成路线,回答下列问题:
(a)反应过程中生成的苯的同系物为 (写结构简式)。
(b)相关步骤涉及卤代烃的消去反应,其化学方程式为 (注明反应条件)。
【答案】(1) 酯基
(2)
(3)H2,催化剂、加热 Cl2,光照
(4)BD
(5) +2NaOH+2NaBr+2H2O
【分析】反应①为两分子化合物ii合成化合物iii,原子利用率为100%,则化合物ii的结构简式为,发生加成反应生成ⅲ,ⅲ发生还原反应生成ⅳ,结合ⅰ和ⅴ发生已知反应生成ⅵ,ⅴ为,其他物质结构已知,据此解答。
【解析】(1)化合物i的分子式为,其含氧官能团的名称为酯基。化合物x为化合物i的同分异构体,其分子中含碳碳双键,能与NaHCO3溶液反应,说明含有羧基,且核磁共振氢谱峰面积比为1:1:6的化合物的结构简式为。
(2)反应①为两分子化合物ii合成化合物iii,原子利用率为100%,则化合物ii的结构简式为。
(3)a. vii含有苯环,可以发生加成反应,反应试剂、条件H2,催化剂、加热,生成;b. vii中甲基可以发生取代反应,反应试剂、条件Cl2,光照,生成。
(4)A. 结合分析,化合物v的结构简式为,A正确;
B. 反应④发生时,消耗,转化平衡反应正向移动,B错误;
C. 化合物iv含有氧原子,能与水分子形成氢键,易溶于水,C正确;
D. 化合物vi中存在sp2与sp3杂化碳原子间的键,且每个vi分子中存在2个手性碳原子,如图,D错误;
故选BD。
(5)以2-丁烯为含碳原料,CH3-CH=CH-CH3发生加成反应生成,发生消去反应生成CH2=CH-CH=CH2和CH3-CH=CH-CH3发生加成反应生成,,让后发生反应④~⑦的合成。
(a)反应过程中生成的苯的同系物为。
(b)相关步骤涉及卤代烃的消去反应,其化学方程式为+2NaOH+2NaBr+2H2O。
14.(2024届广东省天河区二模)高分子材料PET聚酯树脂和PMMA的合成路线如图:
已知:Ⅰ.RCOR'(R、R′、R″代表烃基,下同)
Ⅱ.
Ⅲ.RCOOR′+R″18OHRCO18OR″+R′OH
回答下列问题:
(1)B的分子式是 ,化合物X是B的同分异构体且能被新制氧化,则X的化学名称是 。
(2)步骤②发生反应的化学方程式为 。
(3)PET单体含有的官能团名称是 。
(4)根据D的结构特征,分析预测可能的化学性质,完成下表:
(5)关于反应⑦的说法中,正确的是_______(填字母)。
A.反应过程中有C-O的断裂和形成
B.反应物D中所有碳原子共平面,碳原子均采用杂化
C.反应物G与水均为极性分子,两者形成的溶液中存在氢键
D.产物PMMA单体分子中只存在“头碰头”形成的σ键
(6)结合题中所给信息,以、和为原料合成。基于你的设计,回答下列问题:
①最后一步反应中的有机反应物为 (写结构简式)。
②步骤中涉及烯烃制醇的反应,其化学反应方程式为 。
【答案】(1)C3H6O 丙醛
(2)+H2O
(3)酯基、羟基
(4)加成反应 浓硫酸、加热 R-COO-R'
(5)AC
(6) +HBrCH3CHBrCH3,CH3CHBrCH3+NaOHCH3CHOHCH3+NaBr
【分析】流程图中,乙烯与Br2/CCl4发生加成反应生成BrCH2CH2Br(E),E在NaOH溶液中发生水解生成HOCH2CH2OH(F)和NaBr,F与发生酯交换反应,生成(PET单体)和CH3OH(G);PET单体缩聚生成和HOCH2CH2OH(B)。PMMA的结构简式为,逆推得它的单体为;A经过一系列转化生成D:,结合A化学式可知,A为,A中羟基氧化为酮基得到B:,B发生已知反应Ⅰ原理生成C:;C发生消去反应得到D;
【解析】(1)由分析可知,B为,分子式是C3H6O,化合物X是B的同分异构体且能被新制氧化,则X含有醛基,化学名称是丙醛;
(2)C:;C发生消去反应得到D,反应为+H2O;
(3)(PET单体)含有酯基、羟基官能团;
(4)D:含有碳碳双键,能在催化剂催化下和氢气加成生成碳碳饱和键,故为加成反应;
D:含有羧基,能在浓硫酸催化加热条件下生成酯:R-COO-R',故答案为:浓硫酸、加热;R-COO-R';
(5)A.在生成酯基的过程中存在羧基中的C-O的断裂;卤代烃发生取代生成醇的过程中存在C-O的形成,正确;
B.D:中碳碳双键两端的原子共面,则反应物D中所有碳原子共平面,分子中甲基碳原子均采用杂化,错误;
C.反应物G为甲醇,甲醇具有微弱极性,与水均为极性分子,两者形成的溶液中存在氢键,正确;
D.产物PMMA的单体为,分子中存在头碰头形成的σ键,也存在肩并肩形成π键,错误;
故选AC;
(6)和HBr发生加成反应生成CH3CHBrCH3,再在氢氧化钠水溶液条件下发生取代引入羟基得到CH3CHOHCH3,CH3CHOHCH3氧化为CH3COCH3,CH3COCH3和发生已知Ⅱ原理生成,转化为;
①由分析可知,最后一步反应中的有机反应物为。
②步骤中涉及烯烃制醇的反应,其化学反应方程式为:+HBrCH3CHBrCH3,CH3CHBrCH3+NaOHCH3CHOHCH3+NaBr。
15.(2024届广东省惠州三模)三氟苯胺类化合物广泛应用于新型医药、染料和农药的合成领域,以间三氟甲基苯胺为中间体合成一种抗肿瘤药物H的合成路线如下图所示:
(1)A是芳香族化合物,分子式为C7H8,①则其结构简式为 ,②化合物C中官能团的名称为 ,③化合物H的分子式为 。
(2)F→G的反应类型是 。
(3)该流程中设计C→D的目的是 。
(4)G→H的反应方程式为 。
(5)化合物B的同分异构体中,符合下列条件的有 种;
①-NH2与苯环直接相连
②能与银氨溶液在加热条件下反应产生银镜
其中核磁共振氢谱图显示有4组峰,且峰面积比为1:2:2:2的结构简式为 。
(6)参照上述合成路线和信息,设计以苯和乙酸酐为原料,制备乙酰苯胺合成路线(其它试剂任选) 。
【答案】(1) 氨基 C11H11N2F3O2
(2)取代反应
(3)保护氨基
(4)
(5)13
(6)
【分析】
A是芳香族化合物,分子式为C7H8,B还原生成C,由C逆推,可知B是A是;
【解析】(1)
①A是芳香族化合物,分子式为C7H8,根据以上分析,A的结构简式为,②根据C的结构简式,化合物C中官能团的名称为氨基,③化合物H的分子式为C11H11N2F3O2。
(2)
F→G是F中氨基上的H原子被代替生成G,反应类型是取代反应;
(3)C→D是C中氨基发生反应,E肼解又生成氨基,所以设计C→D的目的是保护氨基;
(4)
G发生硝化反应生成H,反应的反应方程式为;
(5)-NH2与苯环直接相连;
②能与银氨溶液在加热条件下反应产生银镜,说明含有醛基;
若有2个取代基-NH2、-OOCH,在苯环上的位置有3种;若有3个取代基-NH2、-OH、-CHO,在苯环上的位置有10种;符合条件的B的同分异构体共13种;
其中核磁共振氢谱图显示有4组峰,且峰面积比为1:2:2:2的结构简式为;
(6)
苯发生硝化反应生成硝基苯,硝基苯还原为苯胺,苯胺和乙酸酐反应生成乙酰苯胺,合成路线为。
16.(2024届广东省新南方联盟4月联考)有机物M是一种制备液晶材料的重要中间体,其合成路线如图:
已知:①R-X+MgR-MgX(格林试剂)X=Cl、Br、I
②
③
(1)L中含有的官能团名称是 。
(2)反应中使用三甲基氟硅烷()的作用是 。在本流程中起类似作用的有机物还有 (填名称)。
(3)M的结构简式为 。
(4)已知:R1-OH+R2-OHR1-O-R2+H2O
写出以苯、丙酮和格林试剂为原料制备的合成路线流程图 。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)
【答案】(1)(酚)羟基、醚键
(2)保护酚羟基 乙二醇
(3)
(4)
【分析】
在乙酸乙酯作用下与溴共热发生取代反应生成,则A为、B为; 与 发生取代反应生成,在乙醚作用下 一定温度下与镁反应生成,则F为; 一定条件下转化为催化剂作用下 与氢气发生加成反应生成,则E为;在亚硫酸氢钠作用下 与溴酸钠发生氧化反应生成,一定条件下与乙二醇反应生成,则H为; 在浓盐酸作用下与 反应生成, 脱水发生消去反应生成,则K为;催化剂作用下 与氢气共热反应生成, 一定条件下反应转化为,则M为。
【解析】(1)
由L的结构简式可知,L中含有的官能团为(酚)羟基、醚键;
(2)由分析可知,B→D反应中使用三甲基氯硅烷与酚羟基结合,其作用是保护酚羟基,与此类似,在G→H反应中使用乙二醇与G中一个酮羰基缩合,可保护酮羰基;
(3)
由分析可知,M的结构简式为;
(4)
根据题中信息可知,以苯、丙酮为原料合成 的合成步骤为溴化铁做催化剂作用下 与溴发生取代反应生成,在乙醚作用下 一定温度下与镁反应生成, 与丙酮发生加成反应生成,浓盐酸作用下 转化为,浓硫酸作用下 共热发生取代反应生成,则合成路线为:。
17.(2024届广东省湛江一模)莫西赛利(化合物K)是一种治疗心脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。以下为其合成路线之一:
已知:的结构为。
回答下列问题:
(1)化合物A的名称是 。化合物Ⅰ的分子式为 。
(2)写出催化E生成化合物G的反应方程式 。
(3)根据化合物a的结构特征,分析预测其可能的化学性质,完成下表。
(4)下列说法中,不正确的有_______。
A.反应A→B过程中,有C—Br键和H—O键断裂
B.反应G→I过程中,苯环直接连接的N原子由杂化变成sp杂化
C.产物K中不存在手性碳原子
D.CO属于极性分子,分子中存在由p轨道“头碰头”形成的π键
(5)在B的同分异构体中,同时满足下列条件的共有 种(不考虑立体异构):
①含有苯环;②苯环上二取代;③遇氯化铁溶液显紫色。
其中,含有手性碳的同分异构体的结构简式为 (写出一种)。
【答案】(1)间甲基苯酚(3-甲基苯酚)
(2)++HCl
(3)NaOH醇溶液,加热 (或碳碳双键) NaOH水溶液,加热 —OH(或羟基)
(4)AD
(5)12 或或
【分析】
观察A和B的结构,A与2-溴丙烷发生了取代反应生成B,B与亚硝酸钠在HCl条件下生成C,观察E的结构再结合D的分子式可以推断出D的结构是,对比E和G的结构,再结合F的分子式,可以推断出F的结构为,G经过与浓盐酸、氢氧化钠反应得到H,H的结构是,对比I和K的结构,再结合J的分子式,推断J的结构是。
【解析】(1)化合物A的名称是间甲基苯酚(3-甲基苯酚),化合物Ⅰ的分子式为。
(2)由分析可知F的结构,所以E生成G的反应方程式为++HCl。
(3)a的官能团是溴原子,由碳溴键性质可知,在β碳原子上连有氢原子,在NaOH醇溶液加热条件下可以发生消去反应,反应生成新官能团为碳碳双键;碳溴键可以发生取代反应,在NaOH水溶液加热条件下发生水解,溴原子被取代生成羟基。
(4)A.反应A→B过程中,有C—Br键和C—H键断裂,没有O—H键断裂,A项错误;
B.反应物中苯环直接连接的N原子为杂化,转化为Ⅰ中叠氮酸根—中N原子是sp杂化,B项正确;
C.产物K中不存在手性碳原子,C项正确;
D.CO属于极性分子,分子中存在由p轨道“头碰头”形成的σ键和由p轨道“肩并肩”形成的π键,D项错误。
故答案是AD。
(5)
B的同分异构体中,由条件可知苯环上两个取代基,遇氯化铁溶液显紫色则含有酚羟基,另一个为4个碳原子的支链,有CH2CH2CH2CH3、、、四种结构,每种结构分别有邻、间、对三种位置,共12种。其中存在手性碳的结构有、、。
18.(2024届广东省佛山二模)左旋甲基多巴可用于治疗高血压、帕金森等疾病,合成左旋甲基多巴(ⅷ)的一种路线如图所示。
回答下列问题:
(1)ⅰ中含氧官能团名称为 。
(2)ⅱ与ⅲ互为官能团相同的同分异构体,ⅱ的结构简式为 。
(3)ⅲ还有多种同分异构体,其中含有苯环,既能发生水解反应又能发生银镜反应,有9个化学环境相同的氢原子的结构为 (任写1个)。
(4)反应④为加成反应,其化学方程式为 。
(5)根据ⅵ的结构特征,分析预测其可能的化学性质,完成下表
(6)关于上述合成路线,下列说法不正确的是___________(填标号)。
A.反应①目的是保护—OHB.ⅶ中碳原子仅有sp、两种杂化方式
C.ⅷ中原子的电负性:N>O>C>HD.反应⑦中有键、键的断裂和生成
(7)以、为原料合成化合物(无机试剂任选),基于你设计的合成路线,回答下列问题:
①第一步为取代反应,其有机产物的结构产物为 。
②相关步骤涉及消去反应,其化学方程式为 (注明反应条件)。
【答案】(1)羟基、醚键
(2)
(3)
(4)
(5)氢气、催化剂、加热 Br2、催化剂 取代反应
(6)AD
(7)
【分析】
结合i和iii结构以及对比i和ii分子式可知,i发生取代反应生成ii,在KOH作用下ii反应生成iii,iii发生反应成环生成iv,iv在酸性条件下开环生成v,v被氧化生成vi,vi发生加成生成vii,vii发生反应生成viii。
【解析】(1)ⅰ中含氧官能团名称:羟基、醚键;
(2)
ⅱ与ⅲ互为官能团相同的同分异构体,结合分析,ⅱ的结构简式:;
(3)
ⅲ同分异构体满足:含有苯环,既能发生水解反应又能发生银镜反应,说明含甲酸某酯基,其中有9个化学环境相同的氢原子,说明对称性很低,满足要求的结构:;
(4)
反应④为加成反应,其化学方程式:;
(5)物质vi含官能团酮羰基,在催化剂、加热条件下可与氢气发生加成反应形成;苯环上的氢在催化剂作用下可被卤素取代;
(6)A.对比反应物i和最终产物viii可知,反应①目的是保护—OH,A正确;
B.vii中C原子成键形式有单键、双键和三键,杂化类型有sp、sp2和sp3,B错误;
C.同周期元素从左到右元素电负性逐渐增强,所以电负性:,C错误;
D.反应⑦中有碳氮三键的断裂,涉及键和的断裂,有羧基的形成,涉及键和的形成,D正确;
(7)
参考反应①与反应生成,在NaOH醇溶液作用下发生消去反应生成,参考反应②,在KOH作用下反应生成;
①第一步为取代反应,其有机产物的结构产物:;
②相关步骤涉及消去反应,其化学方程式:。
19.(2024届广东省广州二模)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。以玉米芯为原料之一合成化合物ⅷ的路线如下:
(1)化合物ⅰ的分子式为 ,化合物ⅰ环上的取代基的名称是 。
(2)反应③的方程式可表示为:,化合物iv的名称为 。
(3)根据化合物ⅱ的结构特征,分析预测其可能的化学性质,完成下表。
(4)关于反应②的说法中,正确的是______(填字母)。
A.反应过程中,有σ键的断裂
B.反应过程中,碳原子的杂化方式没有发生变化
C.化合物ⅱ的分子中含有2个手性碳原子
D.化合物ⅱ能溶于水,原因是ⅱ能与水分子形成氢键
(5)芳香化合物y是ⅷ的同分异构体,y含有氰基(),遇溶液显紫色,核磁共振氢谱有3组峰,峰面积之比为3∶2∶2,则y的结构有 种,写出其中一种的结构简式 。
(6)以和为原料,参考上述信息,写出制备化合物的合成路线 。
【答案】(1)C5H10O5 (醇)羟基
(2)乙烯
(3)银氨溶液或者新制氢氧化铜、加热 浓HBr、加热
(4)AD
(5)2 或
(6)
【解析】(1)线段的端点与交点省略了碳原子以及该碳原子上的氢原子,所以化合物ⅰ的分子式为C5H10O5;化合物ⅰ环上的取代基的名称是(醇)羟基;
(2)根据以及的结构和原子守恒,则得到iv为,名称为乙烯;
(3)
因为化合物ⅱ含有醛基,所以可以与银氨溶液或者新制氢氧化铜在加热条件下发生氧化反应生成,因为化合物ⅱ含有醇羟基,所以可以与浓HBr加热条件下发生取代反应生成;
(4)A.反应②发生了醇的消去反应,断裂了碳氢与碳氧σ键,正确;
B.反应过程中,环上的碳原子的杂化方式从sp3到了sp2,错误;
C.化合物ⅱ的分子中含有3个手性碳原子,错误;
D.化合物ⅱ能溶于水,原因是ⅱ能与水分子形成氢键,正确;
故选AD;
(5)
y含有氰基(),遇溶液显紫色,说明含有酚羟基,核磁共振氢谱有3组峰,峰面积之比为3∶2∶2,说明是对称结构,则y的结构有2种,即与;
(6)
根据信息知,先要合成,则流程为:
20.(2024届广东省茂名二模)化合物ⅶ是一种药物合成的中间体,合成路线如下:
(1)化合物ⅱ的名称为 。
(2)化合物ⅲ转化为化合物ⅳ的反应可表示为:,则X的结构简式为 。
(3)2-呋喃甲醛()中C原子的杂化方式为 ,化合物y为其同分异构体,y不含环且只含两种官能团,其核磁共振氢谱上只有3组峰的结构简式为 (写一种)。
(4)一个化合物ⅴ分子中含有的手性碳原子数为 。
(5)根据ⅶ的结构特征,分析预测其可能的化学性质,完成下表。
(6)参考反应④、⑤、⑥的原理,合成有机物ⅷ。
(a)可利用上述路线中ⅰ至ⅶ中的 、 两种物质(填罗马数字代号)作为起始原料。
(b)最后一步反应方程式为: (注明反应条件)。
【答案】(1)乙酸(醋酸)
(2)
(3) 或
(4)1
(5)Cu/Ag、、加热 氧化反应 、Ni、加热
(6)ⅰ ⅳ
【分析】乙醛被氧气氧化生成化合物ii为乙酸,乙酸在浓硫酸作用下与乙醇发生酯化反应生成乙酸乙酯;化合物v在酸性条件下发生水解反应生成化合物vi。
【解析】(1)根据分析,化合物ⅱ的名称:乙酸(醋酸);
(2)化合物ⅲ转化为化合物ⅳ的反应可表示为:,则X的结构简式:;
(3)
2-呋喃甲醛()中C原子均形成双键,则其杂化方式为sp2杂化;化合物y为其同分异构体,y不含环且只含两种官能团,根据原子种类、个数及不饱和度可知可含官能团碳碳三键和醛基,则其核磁共振氢谱上只有3组峰的结构简式:或;
(4)一个化合物ⅴ分子中含有1个手性碳原子;
(5)
化合物ⅶ含羟基,可在催化剂的作用下进行催化氧化转化为酮羰基;化合物vii含碳碳双键,可在Ni催化并加热条件下与氢气发生加成反应,反应形成的新结构可能为:;
(6)
参考反应④、⑤、⑥的原理,合成有机物,可选用合成路线中的i和iv为原料进行合成,其中最后一步反应方程式:。
核心考点
考情统计
考向预测
备考策略
官能团性质预测型
2023·广东卷,20
2022·广东卷,20
考查有机化合物的合成,突出对官能团性质的预测和合成路线的即时应用;
考查有机物的推断和合成,突出有机化合物的推断和合成路线的分析。
1.回归教材,掌握典型有机化合物和相应官能团的化学性质。
2.重点关注有机合成路线的分析。
结构未知推断型
2021·广东卷,21
序号
反应试剂、条件
反应形成的新结构
反应类型
a
消去反应
b
氧化反应(生成有机产物)
序号
反应试剂、条件
反应形成的新结构
反应类型
a
浓硫酸,加热
消去反应
b
、,加热(或酸性溶液)
(或 )
氧化反应(生成有机产物)
序号
结构特征
可反应的试剂
反应形成的新结构
反应类型
①
加成反应
②
_______
_______
_______
氧化反应
③
_______
_______
_______
_______
反应类型
特点
具体类型
反应举例
取代
反应
原子或原子团被其他原子或原子团代替
烷烃的卤代
CH4+Cl2CH3Cl+HCl
苯环上的取代
+Br2+HBr
+HO—NO2(浓)+H2O
+HO—SO3H
酯化反应
CH3COOH+C2H5OHCH3COOC2H5+H2O
卤代烃、酯、酰胺的水解反应(多糖、双糖、蛋白质水解)
CH3CH2Cl+NaOHC2H5OH+NaCl
+H2O+CH3CH2OH
+NaOHCH3COONa+C2H5OH
RCONH2+NaOHRCOONa+NH3↑
醇与卤化氢(HX)的反应
C2H5OH+HBrC2H5Br+H2O
加成反应
含双键或三键或苯环的不饱和碳原子变饱和
碳碳双键、三键
的加成
CH2CH2+HClCH3—CH2Cl
CH≡CH+2Br2CHBr2—CHBr2
苯环的加成
+3H2
醛、酮的加成
+H2
CH3CHO+H2CH3CH2OH
+H—CN
消去反应
生成双键
或三键
醇的消去反应
C2H5OHCH2CH2↑+H2O
卤代烃的
消去反应
C2H5Br+NaOHCH2CH2↑+NaBr+H2O
加聚反应
含碳碳双键或三键,相互加成并聚合生成高分子化合物
双键的加聚
nCH2CH2 CH2—CH2
nCH2CH—OOCCH3
三键的加聚
CHCH
共轭双键的加聚
nCH2CH—CHCH2 CH2—CHCH—CH2
缩聚反应
聚合得到高分子的同时生成小分子
生成酯基的缩聚
n+n
+(2n-1)H2O
nHO—CH2—COOH+
(n-1)H2O
氨基酸的缩聚
nH2N—CH2—COOH+(n-1)H2O
酚醛树脂的生成
n+nHCHO+(n-1)H2O
有机氧
化反应
“加氧”或
“去氢”
催化氧化
2C2H5OH+O22CH3CHO+2H2O
2CH3CHO+O22CH3COOH
碳碳双键被酸性
KMnO4溶液氧化
RCHCH2R—COOH+CO2↑
+R″COOH
苯的同系物被
酸性KMnO4
溶液氧化
醛基的氧化
CH3CHO+2Cu(OH)2+NaOHCH3COONa+Cu2O↓+3H2O
CH3CHO+2[Ag(NH3)2]OHCH3COONH4+2Ag↓+3NH3+H2O
有机还
原反应
“加氢”或
“去氧”
醛、酮的还原
CH3CHO+H2CH3CH2OH
硝基被还原
为氨基
+3Fe+6HCl+3FeCl2+2H2O
结构
要求
(邻甲基苯甲酸)
①属于芳香化合物;
②能与银氨溶液反应产生光亮的银镜;
③能与NaOH溶液反应
第一步:确定有机物的类别,找出该有机物常见的类别异构体(可以结合不饱和度)
技巧:原题有机物属于羧酸类,与羟基醛、酯互为类别异构体
第二步:结合类别异构体和已知限定条件确定基团和官能团(核心步骤)
项目
与银氨溶液反应
与NaOH溶液反应
备注
注意细节乃做题制胜法宝
羧酸
×
√
—
羟基醛
√
苯酚 √
醇羟基与NaOH溶液不反应,但酚羟基可以
酯
甲酸酯 √
√
酯与银氨溶液不反应,但甲酸酯可以
综上所述,符合本题条件的有两大类:①羟基醛[(酚)—OH,—CHO];②甲酸酯(—OOCH)
第三步:按类别去找,方便快捷不出错
①若为羟基醛[(酚)—OH,—CHO],则还剩余一个碳原子,分两种情况讨论:
若苯环有两个侧链,此时—CH2—只能和醛基一起,有邻、间、对3种;
若苯环有三个侧链,则为—OH、—CHO、—CH3,苯环连接三个不同的取代基共有10种。
②若为甲酸酯(—OOCH):则用—OOCH取代甲苯上的氢原子,共4种。
共3+10+4=17(种)
(1)原则
基础原料要价廉、易得、低毒性、低污染;产品易于分离、产率较高;合成线路简捷,操作简便,能耗低,易于实现
(2)官能团的引入
引入官能团
有关反应
羟基(—OH)
烯烃与水加成、醛(酮)加氢、卤代烃水解、酯的水解
碳卤键()
烷烃、苯及其同系物与X2取代、不饱和烃与HX或X2加成、醇与HX取代
碳碳双键()
某些醇或卤代烃的消去、炔烃与H2、HX、X2的不完全加成反应
醛基
RCH2OH(伯醇)的氧化、羟醛缩合、烯烃(臭氧)的氧化等
羧基(—COOH)
醛的氧化、酯的酸性水解、羧酸盐的酸化、苯的同系物(侧链上与苯环相连的碳原子上有氢原子)被强氧化剂氧化
酯基()
酯化反应
(3)官能团的消除
①通过加成或氧化消除不饱和键(如碳碳双键、碳碳三键等)
②通过还原或氧化等消除醛基(—CHO)
③通过取代、消去、氧化或酯化反应等消除羟基(—OH)
④通过水解反应消除酯基、肽键、卤素原子
(4)官能团的改变
①通过官能团之间的衍变关系改变
如:醇醛羧酸
②通过某些化学方法改变官能团个数或位置
如:CH3CH2OHCH2CH2XCH2CH2XHOCH2CH2OH,CH3CH2CHCH2CH3CH2CHXCH3CH3CHCHCH3
③有机合成中常见官能团的保护
A.酚羟基的保护:因酚羟基易被氧化,在氧化前用NaOH(Na2CO3)溶液先转化为酚钠,后酸化重新转化为酚或在氧化其他基团前用碘甲烷(CH3I)先转化为苯甲醚,后用氢碘酸酸化重新转化为酚,即或
B.碳碳双键的保护:碳碳双键也容易被氧化,在氧化其他基团前可以利用其与HCl等的加成反应将其保护起来,后再利用消去反应转变为碳碳双键
C.氨基(—NH2)的保护:氨基易被氧化,在氧化其他基团前可以用醋酸酐将氨基转化为酰胺,然后再水解转化为氨基,即或先用盐酸转化为盐酸盐,再用NaOH溶液重新转化为氨基
D.醛基的保护:醛基易被氧化,在氧化其他基团前可以用乙醇(或乙二醇)加成保护,即
类型
反应
举例
成环
反应
脱水反应
(不属于基本有
机反应类型)
生成内酯
+H2O
二元酸与
二元醇形成酯
++2H2O
生成醚
+H2O
Diels-Alder反应
项目
反应特点
举例
延长碳链
醛、酮与格氏试剂反应
CH3CHO
卤代烃与氰化物的取代
R—ClR—CNR—COOH
醛、酮与HCN的加成
CH3CHO
羟醛缩合(常用)
2CH3CHO
烷基化(苯环上引入烷基)
+R—Cl+HCl
酰基化(苯环上引入酰基)
++HCl
项目
反应特点
举例
缩短碳链
羧酸盐脱羧减少一个碳原子
+NaOHRH+Na2CO3
烯烃氧化,双键断裂
R1—CHCH—R2R1CHO+R2CHO
苯的同系物被氧化
序号
反应试剂、条件
反应形成的新结构
反应类型
a
b
浓,加热
消去反应
序号
反应试剂、条件
反应形成的新结构
反应类型
a
加成反应
b
水解反应
序号
反应试剂、条件
反应形成的新结构
反应类型
a
,催化剂,
加成反应
b
溶液,
,HCOONa
水解反应
b
稀硫酸,
,HCOOН
水解反应
序号
反应试剂、条件
反应形成的新结构
反应类型
a
、催化剂/
或
加成反应
b
氧化反应(生成有机产物)
序号
反应试剂、条件
反应形成的新物质
反应类型
a
新制、加热
b
序号
反应试剂、条件
反应形成的新结构
反应类型
a
加成反应
b
序号
反应的官能团
反应试剂、条件
反应形成的新结构
反应类型
a
b
氧化反应(生成有机物)
序号
反应试剂、条件
反应形成的新结构
反应类型
Ⅰ
加成反应
Ⅱ
官能团名称
所选试剂
实验现象
序号
反应试剂、条件
反应形成的新结构
反应类型
a
___________
___________
消去反应
b
___________
___________
加成反应
序号
结构特征
可反应的试剂
反应形成的新结构
反应类型
a
b
序号
反应试剂、条件
反应生成的新结构
反应类型
1
2
取代反应
序号
反应试剂、条件
反应形成的新结构
反应类型
a
加成反应
b
取代反应
序号
可反应的试剂及条件
反应形成的新结构
反应类型
①
,催化剂/△
②
取代反应
序号
反应试剂、条件
反应形成的新结构
反应类型
①
消去反应
②
水解反应
序号
反应试剂、条件
反应形成的新结构
反应类型
①
还原反应
②
序号
反应试剂、条件
反应形成的新结构
反应类型
①
氧化反应(生成有机产物)
②
取代反应
序号
反应试剂、条件
反应形成的新结构
反应类型
a
b
加成反应
(广东版)新高考化学三轮冲刺强化练习 第19题 化学反应原理综合题(解析版): 这是一份(广东版)新高考化学三轮冲刺强化练习 第19题 化学反应原理综合题(解析版),文件包含广东版新高考化学三轮冲刺强化练习第19题化学反应原理综合题原卷版docx、广东版新高考化学三轮冲刺强化练习第19题化学反应原理综合题解析版docx等2份试卷配套教学资源,其中试卷共89页, 欢迎下载使用。
(广东版)新高考化学三轮冲刺强化练习 第18题 工艺流程综合题(解析版): 这是一份(广东版)新高考化学三轮冲刺强化练习 第18题 工艺流程综合题(解析版),文件包含广东版新高考化学三轮冲刺强化练习第18题工艺流程综合题原卷版docx、广东版新高考化学三轮冲刺强化练习第18题工艺流程综合题解析版docx等2份试卷配套教学资源,其中试卷共79页, 欢迎下载使用。
(广东版)新高考化学三轮冲刺强化练习 第17题 化学实验综合题(解析版): 这是一份(广东版)新高考化学三轮冲刺强化练习 第17题 化学实验综合题(解析版),文件包含广东版新高考化学三轮冲刺强化练习第17题化学实验综合题原卷版docx、广东版新高考化学三轮冲刺强化练习第17题化学实验综合题解析版docx等2份试卷配套教学资源,其中试卷共85页, 欢迎下载使用。













