

四川省遂宁市射洪中学校2024-2025学年高二(强基班)上学期开学考试化学试题
展开(时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的班级、姓名、考号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡对应题号的位置上。写在本试卷上无效。
4.考试结束后,将答题卡交回。
可能用到的相对 H-1 C-12 N-14 O-16 S-32 Na-23 K-39 Cu-64 Fe-56
第I卷(选择题)
一、选择题(本题共14小题,每小题3分,共42分,在每小题给出的4个选项中只有一项是符合题目要求的。)
1. 化学无处不在,与化学有关的说法不正确的是
A. 施用化肥和农药可能破坏生态环境,须注意施用方法、用量和时机
B. 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C. 碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D. 二氧化氮的排放会导致光化学烟雾和酸雨的产生
2.恩格斯说“劳动创造了人本身”。下列劳动内容的具体做法或涉及的化学知识不合理的是
A.AB.BC.CD.D
3. 下列说法正确的有几个( )
= 1 \* GB3 ①已知 ,则单斜硫比正交硫稳定
= 2 \* GB3 ② 已知 kJ/ml, kJ/ml,则
= 3 \* GB3 ③ H2(g)的燃烧热是,则反应的反应热
= 4 \* GB3 ④ 25℃、101 kPa时, ,则含1 ml H2SO4的稀硫酸与足量氢氧化钡溶液反应放出的热量为57.3 kJ
= 5 \* GB3 ⑤. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/ml,则含40.0 g NaOH稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
= 6 \* GB3 ⑥. 已知:S(g)+O2(g)=SO2(g) ∆H1;S(s)+O2(g)=SO2(g) ∆H2,则∆H1<∆H2
= 7 \* GB3 ⑦. CO(g)的燃烧热是283.0 kJ/ml,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) △H=-283.0 kJ/ml
= 8 \* GB3 ⑧. 已知:、下,⇌;将和过量的在此条件下充分反应,放出热量
= 9 \* GB3 ⑨在测定中和反应反应热的实验中,只需要测定并记录2次温度
= 10 \* GB3 ⑩已知2C(s)+O2(g)=2CO(g) ΔH=-221kJ•ml-1 ,该反应的反应热为221kJ/ml
A.2B.3C.4D.5
设NA为阿伏加德罗常数的值。下列有关说法正确的是( )
A.46g C2H6O中含有的极性键为7NA
B.氢氧燃料电池正极消耗22.4L气体时,负极消耗的气体分子数目为
C.0.1 ml-OH中所含电子数目为0.9NA
D.含的浓硫酸与共热,生成分子数为
5. 下列离子方程式书写正确的是( )
电解
A.将过量通入氢氧化钠溶液中:
B.用电解法制取金属钠:2NaCl(水溶液) 2Na+Cl2↑
C.向溶液中通入等物质的量的:
D. 向稀溶液中加入盐酸:
6. 海带提碘流程如下:
上述过程中用到的玻璃仪器有
①酒精灯 ②烧杯 ③坩埚 ④分液漏斗 ⑤250 mL容量瓶 ⑥玻璃棒 ⑦漏斗 ⑧蒸发皿
A.①②④⑥⑦ B.①②③④⑤⑦
C.①②④⑥⑦⑧ D.①②③④⑥⑦
7. W、X、Y、Z为原子序数依次增大的短周期元素。W和X原子序数之和等于的核外电子数,化合物可用作化学电源的电解质。下列叙述正确的是
A. X和Z属于同一主族B. 非金属性:
C. 气态氢化物的稳定性:D. 原子半径:
8. 科学家使用研制了一种可充电电池(如图所示)。电池工作一段时间后,电极上检测到和少量。下列叙述正确的是
A. 充电时,向阳极方向迁移
B. 充电时,会发生反应
C. 放电时,正极反应有
D. 放电时,电极质量减少,电极生成了
9. 已知:H2O(g)═H2O(l) ΔH1
C2H5OH(g)═C2H5OH(l) ΔH2
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g ) ΔH3
若使46 g酒精液体完全燃烧,最后恢复到室温,反应热为ΔH4,则ΔH4为
A.ΔH2-ΔH3-3ΔH1B.0.5ΔH2-0.5ΔH3-1.5ΔH1
C.0.5ΔH1-1.5 ΔH2+0.5ΔH3D.ΔH3-ΔH2+3ΔH1
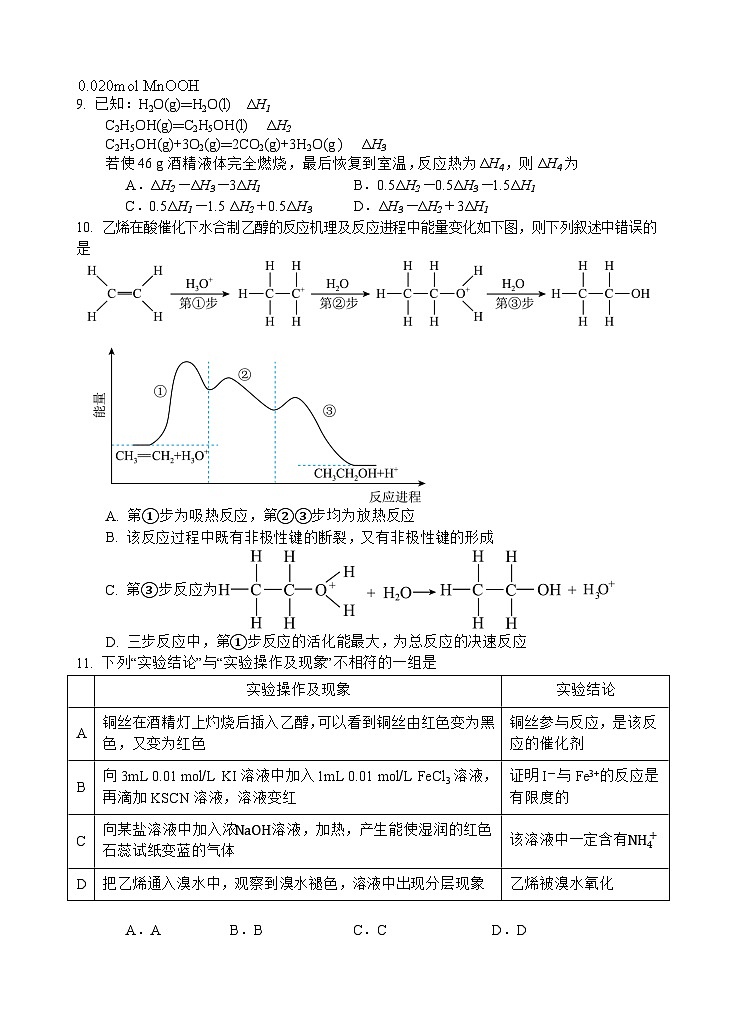
10. 乙烯在酸催化下水合制乙醇的反应机理及反应进程中能量变化如下图,则下列叙述中错误的是
A. 第①步为吸热反应,第②③步均为放热反应
B. 该反应过程中既有非极性键的断裂,又有非极性键的形成
C. 第③步反应为
D. 三步反应中,第①步反应的活化能最大,为总反应的决速反应
11. 下列“实验结论”与“实验操作及现象”不相符的一组是
A.A B.BC.CD.D
12. 目前,常利用催化技术将汽车尾气中的NO和CO转化成CO2和N2。为研究如何增大该化学反应的速率,某课题组设计了以下三组实验探究温度、催化剂的比表面积对反应的影响。
实验测得三组实验中CO的浓度随时间的变化如下图所示。下列有关说法错误的是
A.x=280;y=4.00×10-3
B.曲线1对应的实验中,刚刚达到平衡时,NO的平均反应速率为0.3ml/L⋅s
C.增大催化剂的比表面积,使化学反应的速率增大,但CO的转化率不变
D.曲线1、2、3分别代表的实验编号为Ⅱ、Ⅰ、Ⅲ
13. 阿司匹林(学名为乙酰水杨酸)是一种重要的合成药物,其合成过程如下,下列有关说法错误的是
A.水杨酸的分子式为C7H6O3
B.水杨酸苯环上的一氯取代产物有2种
C.水杨酸和乙酰水杨酸都能使紫色石蕊溶液变红
D.乙酰水杨酸分子中一定共面的原子有12个
14. 实验研究发现,金属与极稀的硝酸反应时,硝酸可被还原为。现将一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,固体完全溶解,反应过程中无气体放出。反应结束后(忽略溶液体积的变化)将溶液平均分成两份,一份滴加KSCN溶液,一份逐滴加入溶液。所加溶液的体积与产生沉淀的物质的量关系如图所示。下列说法正确的是( )
A.加入KSCN的溶液中无现象
B.原混合物中铝粉的物质的量为
C.根据题目数据,无法计算a点数值
D.原溶液中硝酸浓度为
第II卷(非选择题)
二、非选择题(本题共4题,共58分)
15.(12分)回答下列问题:
(1)某实验小组用 NaOH溶液和 溶液进行中和热的测定。取50mL NaOH溶液和30mL 溶液进行实验,实验数据如表所示。
近似认为 NaOH溶液和 溶液的密度都是,中和后混合溶液的比热容,则 (结果保留小数点后一位)。
(2)上述实验数值结果与57.3kJ/ml有偏差,产生偏差的原因可能是(填字母)_______。
A.实验装置保温、隔热效果差
B.量取稀硫酸溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
反应I:
反应Ⅲ:
反应Ⅱ的热化学方程式: 。
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1ml化合物的反应热叫该化合物的生成热()。如图为第VIA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
①图中a对应的氢化物是 (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热的关系: 。
②硒化氢在上述条件下发生分解反应的热化学方程式为 。(沸点:硒化氢-41.3℃;硒:6849℃)
16.(15分)配合物在分析化学中用于的鉴定,其制备装置示意图(夹持装置等略)及步骤如下:
①向三颈烧瓶中加入和热蒸馏水,搅拌溶解。
②磁力搅拌下加入,从仪器a加入50%醋酸。冷却至室温后,再从仪器b缓慢滴入30%双氧水。待反应结束,滤去固体。
③在滤液中加入95%乙醇,静置40分钟。固液分离后,依次用乙醇、乙醚洗涤固体产品,称重。
已知:i.乙醇、乙醚的沸点分别是;
ii.的溶解度数据如下表。
回答下列问题:
(1)仪器a的名称是_______,使用前应_______。
(2)中钴的化合价是_______,制备该配合物的化学方程式为 。
(3)步骤①中,用热蒸馏水的目的是 。
(4)步骤③中,用乙醚洗涤固体产品的作用是 。
(5)已知:(亮黄色)足量与产品反应生成亮黄色沉淀,产品纯度为_______%。
(6)实验室检验样品中钾元素的常用方法是:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,用铂丝蘸取样品在外焰上灼烧, 。
17.(15分)钛(Ti)的性质稳定,有良好的耐高温.抗酸碱.高强度等特性,其合金应用于航天飞机。工业上常用钛铁矿(主要含和少量、等)冶炼获得金属钛,同时得到副产品晶体。其工艺流程如下图所示:
已知:,Ti在高温下易被氧气氧化。回答下列问题:
(1)酸浸时为了提高浸取率,可采用的措施有_________________________(任写两点即可)。
(2滤渣A为_____________,滤液A中加入铁粉的目的是__________________________。
(3)操作I为_____________、_____________、过滤、洗涤、干燥。
(4)实验室用晶体配制500ml0.1000ml/L的硫酸亚铁溶液,需要用到的玻璃仪器有__________、__________、烧杯和玻璃棒,用电子分析天平(精确度0.0001g)称量________g。
(5)反应②生成和一种可燃性气体,其化学方程式为_________________。
(6)反应③须在隔绝空气的条件下进行的原因是_________________________。
18.(16分)研究、、CO等气体的无害化处理对治理大气污染、建设生态文明有重要意义。
(1)已知反应中相关的化学键键能数据如表:
①若有1ml生成,该反应___________(填“吸收”或“放出”)___________kJ能量。
②一定温度下,在恒容的密闭容器中充入1mlCO和2ml发生上述反应,对于该反应,下列说法正确的是___________(填序号)。
A.反应过程中不变
B.升高温度,正反应速率减小
C.往容器中充入He,压强增大,反应速率加快
D.容器内混合气体的平均摩尔质量保持不变时说明反应已达平衡
E. 容器内混合气体的密度保持不变时说明反应已达平衡
(2)利用反应,可实现汽车尾气的无害化处理。一定温度下,在体积为2L的恒容密闭容器中加入等物质的量的NO和CO,测得部分物质的物质的量随时间的变化如图所示。
①X代表的物质是___________;a点正反应速率___________逆反应速率(填“>”“<”或“=”)。
②从反应开始到达到平衡,___________;该条件下,CO的平衡转化率为___________。
(3)工业上也可用还原CO电化学法制备甲醇的工作原理如图所示。通入的一端是电池的________(填“正”或“负”)极,电池工作过程中通过质子膜向_______(填“左”或者“右”)移动,通入CO的一端发生的电极反应为_____________________。
选项
劳动内容
化学知识
A.
雕刻工人用FeCl3溶液在铜板上刻出各种精美图案
FeCl3溶液中Fe3+具有氧化性
B.
酿酒师往葡萄酒中添加适量SO2保鲜
SO2可以杀菌,且具有较强的还原性
C.
电工将铝线和铜线直接相连导电
铝有耐蚀性,铜化学性质不活泼
可长时间使用
D.
工业上铁质槽罐储运浓硫酸
常温下,铁遇浓硫酸钝化
实验操作及现象
实验结论
A
铜丝在酒精灯上灼烧后插入乙醇,可以看到铜丝由红色变为黑色,又变为红色
铜丝参与反应,是该反应的催化剂
B
向3mL 0.01 ml/L KI溶液中加入1mL 0.01 ml/L FeCl3溶液,再滴加KSCN溶液,溶液变红
证明I-与Fe3+的反应是有限度的
C
向某盐溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
该溶液中一定含有NH4+
D
把乙烯通入溴水中,观察到溴水褪色,溶液中出现分层现象
乙烯被溴水氧化
编号
T℃
cNO/mlL
cCO/mlL
催化剂的比表面积/m2g
Ⅰ
280
6.50×10-3
4.00×10-3
80.0
Ⅱ
x
120
Ⅲ
360
y
80.0
温度实验次数
起始温度
终止温度
溶液
NaOH溶液
平均值
1
26.2
26.6
26.4
30.4
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
温度/℃
20
30
40
50
溶解度/
84.5
91.6
98.4
104.1
化学键
H-H
C-O
C≡O(CO)
H-O
C-H
E(kJ·ml)
436
343
1076
465
413
四川省遂宁市射洪中学校2024-2025学年高二上学期开学考试+化学试题: 这是一份四川省遂宁市射洪中学校2024-2025学年高二上学期开学考试+化学试题,文件包含化学试题docx、化学答案docx等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
四川省遂宁市射洪中学校2023-2024学年高一下学期6月期末考试化学试题(强基班)(含答案): 这是一份四川省遂宁市射洪中学校2023-2024学年高一下学期6月期末考试化学试题(强基班)(含答案),文件包含化学试题强基班docx、强基班化学答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
四川省遂宁市射洪中学2023-2024学年高二上学期(强基班)11月月考化学试题(Word版附解析): 这是一份四川省遂宁市射洪中学2023-2024学年高二上学期(强基班)11月月考化学试题(Word版附解析),共19页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












