高考化学模拟试题分类汇编专题3金属及其化合物-铁及其重要化合物含解析答案
展开B.干冰可用在影视剧及戏剧舞台上制造“云雾”
C.“墨子号”量子通信的载体-光纤的主要成分为单晶硅
D.2023年杭州亚运会主火炬燃料零增碳甲醇属于可再生能源
2.化学与生产生活密切相关,下列有关说法不正确的是
A.某管道疏通剂主要成分是NaOH粉末和铝粉,可与“洁厕灵”混合使用提高疏通和清洁效果
B.洗涤棉布衣物不容易“甩干”是因为衣物与水分子间形成了氢键
C.高铁酸钾()在水处理过程中涉及的变化有:蛋白质变性、胶体聚沉、盐类水解、氧化还原反应
D.酱油中添加少量苯甲酸钠作防腐剂
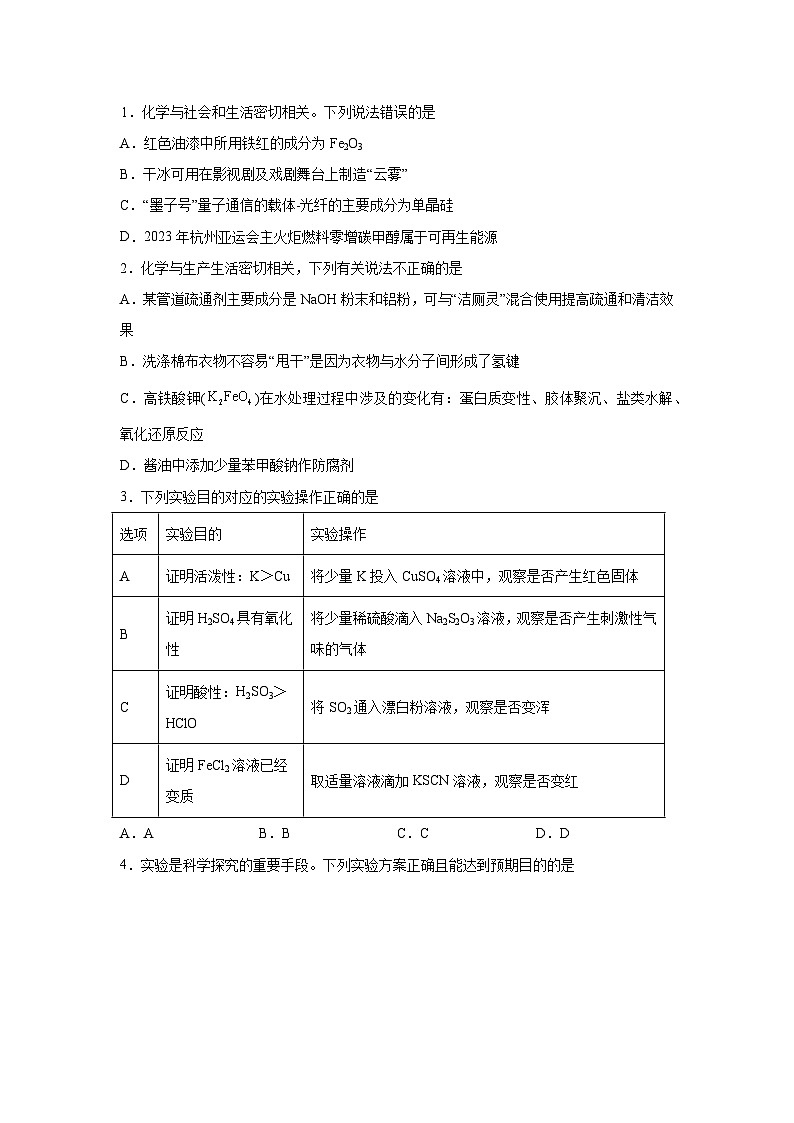
3.下列实验目的对应的实验操作正确的是
A.AB.BC.CD.D
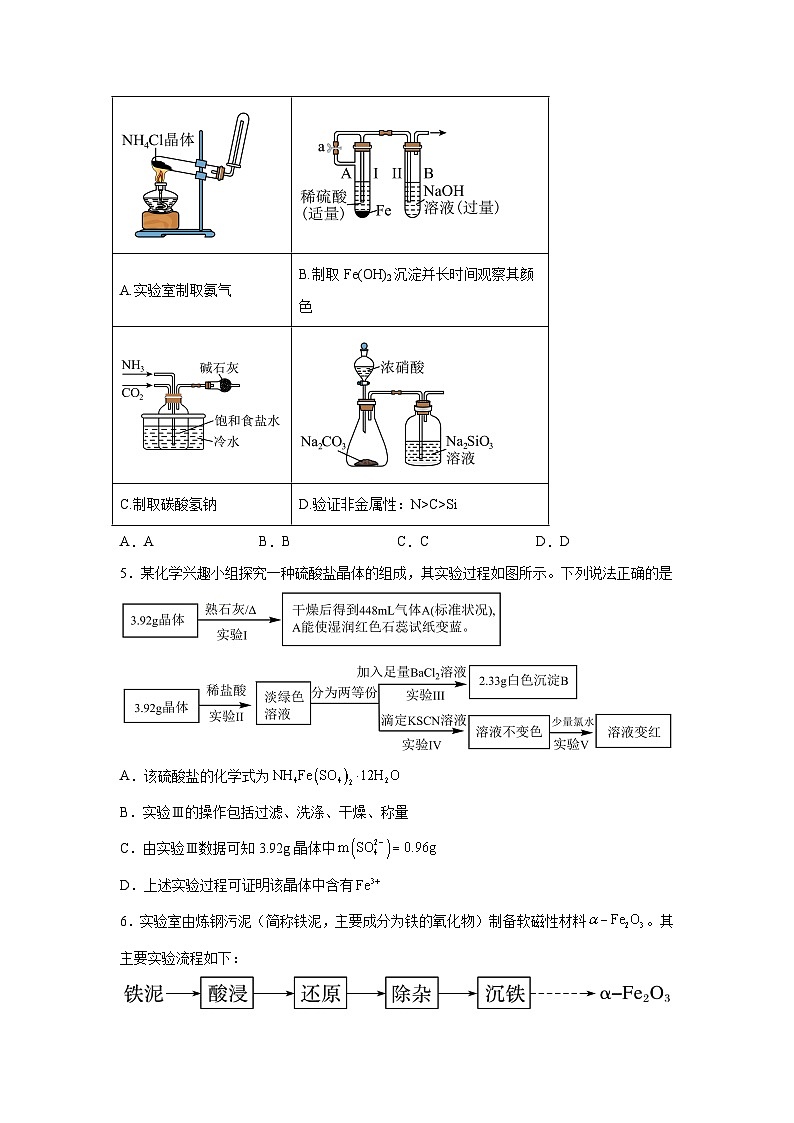
4.实验是科学探究的重要手段。下列实验方案正确且能达到预期目的的是
A.AB.BC.CD.D
5.某化学兴趣小组探究一种硫酸盐晶体的组成,其实验过程如图所示。下列说法正确的是
A.该硫酸盐的化学式为
B.实验Ⅲ的操作包括过滤、洗涤、干燥、称量
C.由实验Ⅲ数据可知3.92g晶体中
D.上述实验过程可证明该晶体中含有
6.实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料。其主要实验流程如下:
下列说法错误的是
A.酸浸:用一定浓度的硫酸浸取铁泥,能提高铁元素浸出率的措施有适当升高温度,加快搅拌速度
B.还原:向“酸浸”后的滤液中加入过量铁粉,可用KSCN溶液检验是否完全还原
C.沉铁:将提纯后的溶液与氨水混合溶液反应,生成沉淀的离子方程式为
D.沉铁步骤中为防止生成,应在搅拌下向氨水混合溶液中缓慢加入溶液
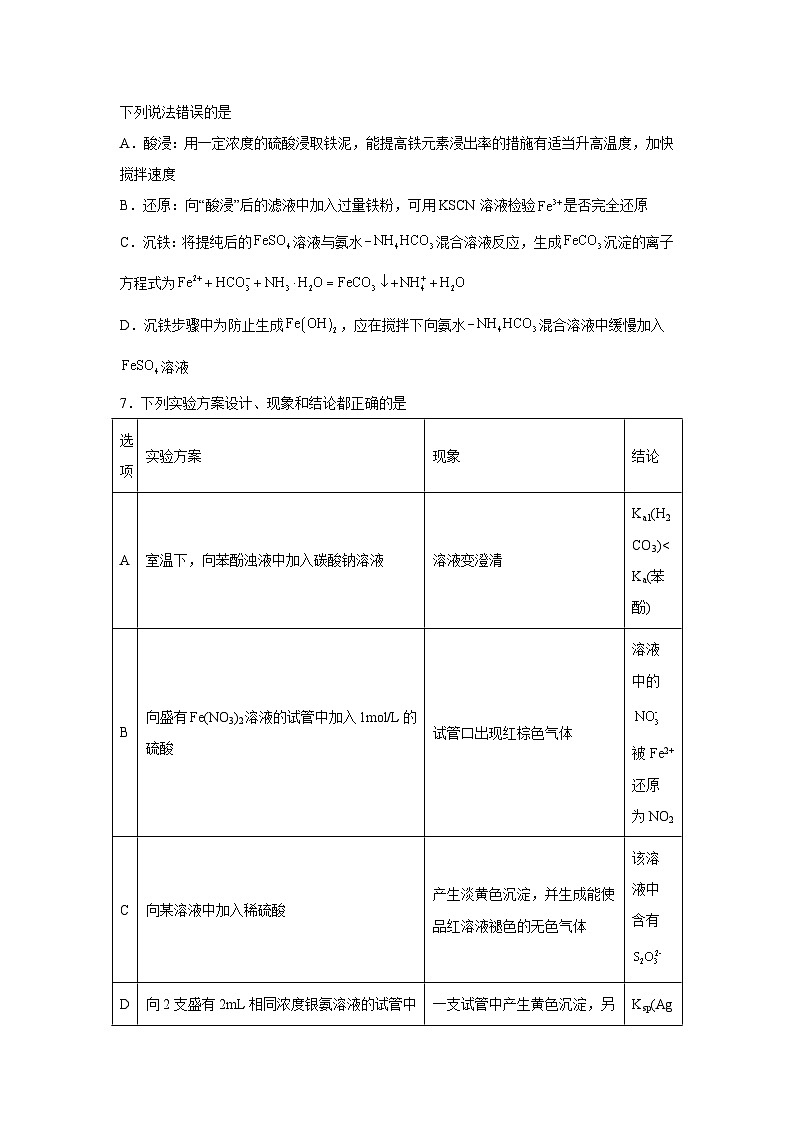
7.下列实验方案设计、现象和结论都正确的是
A.AB.BC.CD.D
8.下列离子方程式书写正确的是
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.将Cl2通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
C.Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2+++OH-=CaCO3↓+H2O
D.CuSO4溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2
9.下列实验操作及现象与对应结论不匹配的是
A.AB.BC.CD.D
10.下列实验操作及现象所得结论正确的是
A.AB.BC.CD.D
选项
实验目的
实验操作
A
证明活泼性:K>Cu
将少量K投入CuSO4溶液中,观察是否产生红色固体
B
证明H2SO4具有氧化性
将少量稀硫酸滴入Na2S2O3溶液,观察是否产生刺激性气味的气体
C
证明酸性:H2SO3>HClO
将SO2通入漂白粉溶液,观察是否变浑
D
证明FeCl2溶液已经变质
取适量溶液滴加KSCN溶液,观察是否变红
A.实验室制取氨气
B.制取Fe(OH)2沉淀并长时间观察其颜色
C.制取碳酸氢钠
D.验证非金属性:N>C>Si
选项
实验方案
现象
结论
A
室温下,向苯酚浊液中加入碳酸钠溶液
溶液变澄清
Ka1(H2CO3)
向盛有Fe(NO3)2溶液的试管中加入1ml/L的硫酸
试管口出现红棕色气体
溶液中的被Fe2+还原为NO2
C
向某溶液中加入稀硫酸
产生淡黄色沉淀,并生成能使品红溶液褪色的无色气体
该溶液中含有
D
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一支试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)
实验操作及现象
结论
A
将表面生锈的铁钉置于稀硫酸中,滴入溶液,溶液的紫色褪去
铁锈中含有二价铁
B
向稀盐酸中加入少量镁粉,有大量气体产生,试管壁发热
镁与稀盐酸反应放热
C
将无水固体暴露在潮湿空气中,产生大量白雾
发生了水解反应
D
将石蜡加强热产生的气体通入溴的四氯化碳溶液中,溶液褪色
气体中含有不饱和烃
选项
实验操作及现象
结论
A
向碳酸钙的悬浊液中通入NO2,悬浊液逐渐变澄清
酸性强于
B
向新制的Cu(OH)2中滴入用碱中和后的蔗糖水解液,加热,产生砖红色沉淀
蔗糖已完全水解
C
取某补铁剂溶于硝酸,向所得溶液中滴加KSCN溶液,溶液变红色
该补铁剂中铁元素的化合价为+3价
D
向CuCl2、MgCl2的混合溶液中滴加NaOH溶液,溶液中先生成蓝色沉淀
参考答案:
1.C
【详解】A.铁红的主要成分是Fe2O3,故A正确;
B.干冰易升华,升华时吸热,造成空气中的水蒸气凝结形成云雾,可用于舞台布景,故B正确;
C.光纤的主要成分为SiO2,故C错误;
D.零碳甲醇是利用废气中捕集的CO2热催化加氢合成甲醇,属于可再生能源,故D正确。
答案选C。
2.A
【详解】A.管道疏通剂主要成分是NaOH粉末和铝粉,原理是二者遇水发生反应产生氢气,“洁厕灵”主要成分是盐酸,混合后氢氧化钠被中和,降低了清洁效果,A错误;
B.棉布的成分是纤维素,纤维素中羟基可以和水形成氢键,B正确;
C.具有很强的氧化性而杀菌消毒,而自身被还原为水解为具有吸附作用吸附悬浮物而聚沉,C项正确;
D.苯甲酸钠为常见的防腐剂,含水和营养成分较多的东西往往需要添加防腐剂,D项正确;
故选A。
3.D
【详解】A.将K直接加入硫酸铜溶液中,会直接和水反应,无法置换出铜,A错误;
B.硫代硫酸钠在酸性条件下会发生歧化反应生成二氧化硫和硫单质,与硫酸的氧化性无关,B错误;
C.将二氧化硫融入漂白粉溶液,次氯酸根离子会将其氧化为硫酸根离子,无法比较二者酸性,C错误;
D.若滴加硫氰化钾溶液后溶液变红,说明溶液中含有铁离子,氯化亚铁溶液已经变质,D正确;
故选D。
4.B
【详解】A.氯化铵加热分解产生的氯化氢和氨气在试管口遇冷会重新结合生成氯化铵,达不到制取氨气的目的,A不符合题意;
B.氢氧化亚铁沉淀容易被氧化,因此可先打开止水夹a,使铁和稀硫酸反应产生的氢气将整个装置中的空气排干净,然后关闭止水夹a,继续产生的氢气可将A中的硫酸亚铁溶液压入B中而得到氢氧化亚铁沉淀,题中所给的图示能达到实验目的,B符合题意;
C.氨气极易溶于水,直接插入溶液中易倒吸,而二氧化碳在水中溶解度较小,则应将通氨气和二氧化碳的导管互换,C不符合题意;
D.硝酸可与碳酸钠反应生成CO2,浓硝酸易挥发,进入硅酸钠溶液的CO2中混有HNO3,由于HNO3也能与硅酸钠溶液反应,HNO3会对CO2与硅酸钠的反应产生干扰,因此不能比较出碳酸和硅酸的酸性大小,也无法验证C和Si的非金属性强弱,D不符合题意;
故选B。
5.B
【分析】3.92g晶体和熟石灰共热得到的A气体能使湿润红色石蕊试纸变蓝,说明A为NH3,晶体中有,干燥后NH3在标准状况下的体积为448mL,NH3的物质的量即晶体中的物质的量为;3.92g晶体与稀盐酸反应后的溶液呈淡绿色,将其分成两等份,其中一份与足量氯化钡溶液反应得2.33g沉淀B,则B为BaSO4,n(BaSO4)=0.01ml,则n()=n(BaSO4)=0.01ml,另外一等份滴加KSCN溶液,溶液不变色,再加氯水溶液变红,说明原晶体中无铁离子,有亚铁离子。
【详解】A.由以上分析可知,3.92g晶体中含0.02ml,则m()=0.02ml×18g/ml=0.36g,n()=2×0.01ml=0.02ml,则m()=0.02ml×96g/ml=1.92g,由电荷守恒可知,溶液中还有Fe2+,且n( Fe2+ )=,则m( Fe2+ )=0.01ml×56g/ml=0.56g,所以结晶水的质量为m(H2O)=3.92g-0.36g-1.92g-0.56g=1.08g,则n(H2O)=,该硫酸盐的化学式为,故A错误;
B.实验Ⅲ的操作是从溶液中得硫酸钡晶体并称重,所以其操作包括过滤、洗涤、干燥、称量,故B正确;
C.由实验Ⅲ的数据可知,3.92g晶体中,故C错误;
D.滴加KSCN溶液,溶液不变色,再加氯水溶液变红,说明原晶体中无铁离子,有亚铁离子,故D错误;
故答案为:B。
6.D
【详解】A.实验中适当升高酸浸温度、适当加快搅拌速度都能提高铁元素浸出率,缩短酸浸时间会降低铁元素浸出率,故A正确;
B.可利用KSCN溶液检验Fe3+是否被完全还原,故B正确;
C.FeSO4溶液与氨水-NH4HCO3混合溶液反应,Fe2+与CO结合生成FeCO3沉淀,促进了HCO的电离,离子方程式为,故C正确;
D.Fe(OH)2开始沉淀的pH约为6.5,沉铁步骤中为防止生成,应控制溶液的pH不大于6.5,与缓慢加入溶液无关,故D错误;
故选D。
7.D
【详解】A.苯酚与碳酸钠反应生成苯酚钠、碳酸氢钠,则溶液变澄清,可知酸性:Ka2(H2CO3) < Ka (苯酚),A错误;
B.在酸性条件下,Fe2+与NO2发生氧化还原,反应3Fe2++NO2 +4H+ = 3Fe3++NO↑+2H2O,对于该反应Fe2+为还原剂,为氧化剂,被还原成NO,试管口出现红棕色气体,为一氧化氮与氧气反应生成红棕色的二氧化氮,B错误;
C.溶液中可能含硫离子、亚硫酸根离子,与稀硫酸反应生成S和二氧化硫,结论不合理,C错误;
D.同类型的不溶物,Ksp小的先沉淀,则由现象可知相同温度、相同浓度的溶液中,AgCl在水中的溶解度大于AgI的溶解度,可以得出Ksp(AgI)
8.C
【详解】A.氢氧化铁溶于氢碘酸后,生成的Fe3+、I-发生氧化还原反应,生成Fe2+、I2等:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,A不正确;
B.将Cl2通入石灰乳中制漂白粉,石灰乳不能改写成离子:2Cl2+2Ca(OH)2=2Ca2++2Cl-+2ClO-+2H2O,B不正确;
C.Ca(HCO3)2溶液中滴加少量NaOH溶液,少量与OH-反应生成等,再与Ca2+反应全部转化为CaCO3:Ca2+++OH-=CaCO3↓+H2O,C正确;
D.CuSO4溶液中加入过量氨水,起初生成的Cu(OH)2全部转化为[Cu(NH3)4]2+等:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,D不正确;
故选C。
9.A
【详解】A.生锈的铁钉置于硫酸中,铁锈与酸反应生成的与Fe反应生成二价铁,该实验操作不能证明铁锈中含有二价铁,A项错误;
B.试管壁发热,说明反应放出热量,B项正确;
C.水解生成的HCl遇空气中的水蒸气形成盐酸小液滴,C项正确;
D.石蜡加强热裂解生成的不饱和烃能与溴发生加成反应,D项正确;
故选A。
10.A
【详解】A.NO2与水反应生成硝酸和NO,硝酸与碳酸钙反应生成硝酸钙,溶液变澄清,则酸性强于,A正确;
B.向新制的Cu(OH)2中滴入用碱中和后的蔗糖水解液,加热,产生砖红色沉淀,能说明蔗糖已经水解,不能说明完全水解,B错误;
C.硝酸具有氧化性,能将Fe2+氧化为Fe2+,滴加KSCN溶液,溶液变红色,不能证明该补铁剂中铁元素的化合价为+3价,C错误;
D.CuCl2、MgCl2的混合溶液中两者浓度未知,应该向等浓度的CuCl2、MgCl2的混合溶液中滴加氢氧化钠溶液,Ksp小的先沉淀,D错误;
故选A。
考点12 铁元素单质及其重要化合物-2024年高考化学试题分类汇编: 这是一份考点12 铁元素单质及其重要化合物-2024年高考化学试题分类汇编,共19页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
高考化学一轮复习第3章金属及其化合物第9讲铁及其重要化合物考点1铁的性质答案PDF版: 这是一份高考化学一轮复习第3章金属及其化合物第9讲铁及其重要化合物考点1铁的性质答案PDF版
高考化学一轮复习第3章金属及其化合物第9讲铁及其重要化合物考点1铁的性质试题PDF版: 这是一份高考化学一轮复习第3章金属及其化合物第9讲铁及其重要化合物考点1铁的性质试题PDF版












