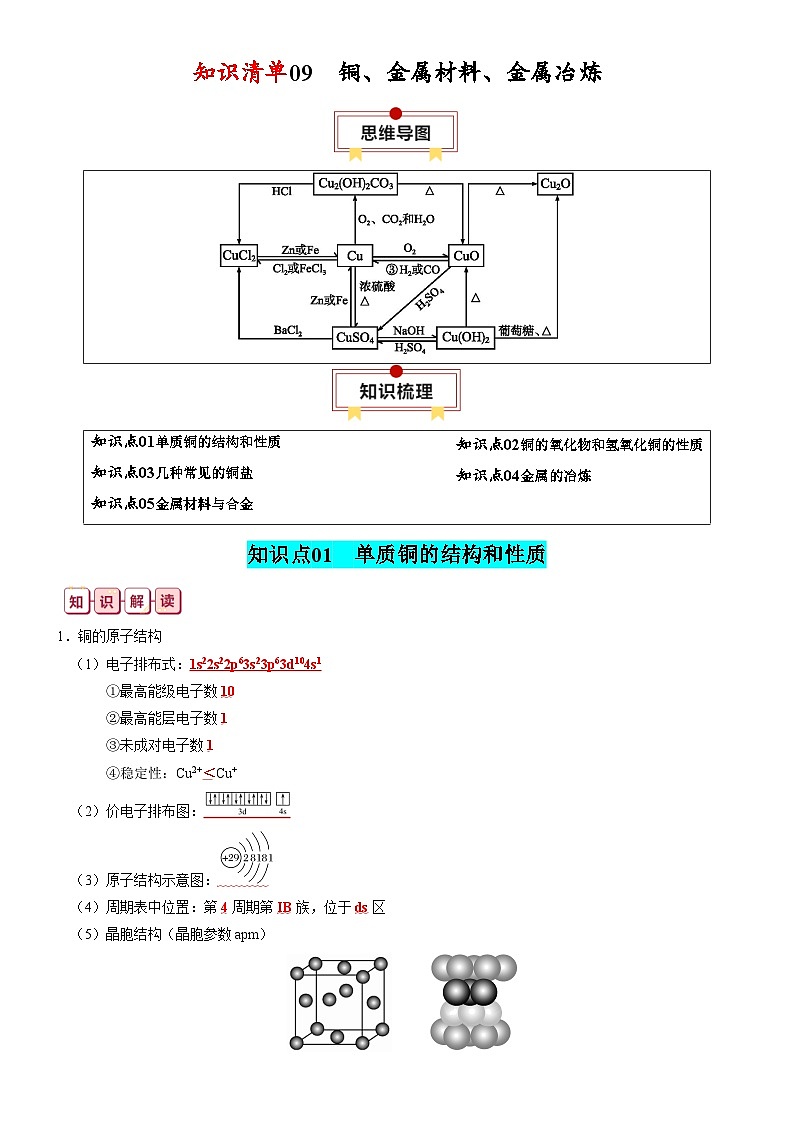


新高考化学一轮复习知识清单09 铜、金属材料、金属冶炼
展开1.铜的原子结构
(1)电子排布式:1s22s22p63s23p63d104s1
①最高能级电子数10
②最高能层电子数1
③未成对电子数1
④稳定性:Cu2+<Cu+
(2)价电子排布图:
(3)原子结构示意图:
(4)周期表中位置:第4周期第IB族,位于ds区
(5)晶胞结构(晶胞参数apm)
①堆积名称:面心立方最密堆积,堆积类型:A1型或铜型
②堆积方式:…ABCABC…
③配位数12
④晶胞中含Cu的个数:4
⑤晶胞密度:==g·cm-3
⑥空间利用率:φ=×100%=×100%=π×100%≈74%
2.铜的物理性质
(1)颜色:呈红色或紫红色
(2)三性:导电性、导热性和延展性良好
3.与非金属单质反应
(1)与氧气反应:条件不同,产物不同
①加热:2Cu+O22CuO
②常温:2Cu+O2+CO2+H2OCu2(OH)2CO3
(2)与其他非金属反应
①Cueq \(-----→,\s\up7(S),\s\d5(加热))Cu2S ②Cueq \(------→,\s\up7(Cl2),\s\d5(点燃))CuCl2
4.与酸反应
(1)稀硫酸
①普通条件:Cu不能置换出H2
②电解条件:Cu+H2SO4(稀)CuSO4+H2↑
(2)浓硫酸:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(3)浓硝酸:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O
(4)稀硝酸:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O
5.与盐溶液反应
(1)硝酸银:2AgNO3+Cu2Ag+Cu(NO3)2
(2)氯化铁:2FeCl3+Cu2FeCl2+CuCl2
6.单质铜在化学实验中的应用
(1)除去某种气体中的氧气
(2)乙醇催化氧化的催化剂
①催化原理:CuCuOCu
②催化反应:2CH3CH2OH+O22CH3CHO+2H2O
(3)防止可燃性气体燃烧回火的安全装置
易错点:铜的易错知识点
(1)铜和氧气在常温下反应生成Cu2(OH)2CO3,在加热条件下生成CuO。
(2)单质铜可以除去某种气体中的氧气,也可以作乙醇催化氧化的催化剂。
(3)在普通条件下Cu不能从稀硫酸中置换出H2,但在通电条件下Cu能从稀硫酸中置换出H2。
【典例01】(2022·大连一模)下列实验的前后,铜的质量一定发生变化的是( )。
A.铜丝在空气中灼烧后立即插入乙醇
B.铜片放入酸化的硝酸钠溶液
C.铜和铁的混合物放入稀硝酸
D.铜、锌、稀硫酸构成的原电池放电
【解析】选B。由于氧化铜能够和乙醇反应生成乙醛和铜,铜变成氧化铜,氧化铜又被还原成铜,最终铜质量没有变化,故A错误;铜和稀硝酸反应生成了硝酸铜,质量一定减少,故B正确;由于铁还原性大于铜的,铁先参加反应,若是铁足量,铜变化消耗,故C错误;铜、锌构成的原电池,锌是负极,铜是正极不消耗,故D错误。
知识点02 铜的氧化物和氢氧化铜的性质
1.氧化铜
(1)物性:黑色粉末状固体
(2)弱氧化性:CuOeq \(-------------------→,\s\up7(H2、CO、C、Al),\s\d5(NH3、乙醇))Cu
①Al:2Al+3CuO3Cu+Al2O3
②C:2CuO+C2Cu+CO2↑
③NH3:2NH3+3CuON2+3Cu+3H2O
④乙醇:CH3CH2OH+CuOCH3CHO+H2O+Cu
(3)热不稳定性
①反应:4CuO2Cu2O+O2↑
②原因:Cu+的价电子构型为3d10的稳定结构
2.氧化亚铜
(1)物性:砖红色固体
(2)Cu2O的晶胞(小黑点实心代表Cu原子)
①含Cu2O数:2
②配位数:Cu的配位数为2;O的配位数为4
(3)用途:作为红色玻璃和搪瓷的着色剂
3.氢氧化铜
(1)物理性质:蓝色不溶于水的固体
(2)化学性质
①弱碱性:Cu(OH)2+2H+Cu2++2H2O
②不稳定性:Cu(OH)2CuO+H2O
③弱氧化性:2Cu(OH)2+RCHO+NaOHRCOONa+Cu2O↓+3H2O
④络合性:Cu(OH)2+4NH3·H2O[Cu(NH3)4]2++2OH-+4H2O
易错点:氢氧化铜的易错知识点
(1)氢氧化铜既能溶于酸又能溶于碱(氨水),但它不是两性氢氧化物。
(2)向硫酸铜溶液中滴加氨水的现象是:先产生蓝色沉淀,后沉淀溶解生成深蓝色溶液
(3)新制的氢氧化铜悬浊液具有弱氧化性,可以用来检验醛基。
【典例02】已知酸性条件下有如下反应:2Cu+Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物做了验证,实验操作和实验现象记录如下:
由此推出本次氢气还原氧化铜实验的产物是( )。
A.Cu
B.Cu2O
C.一定有Cu,可能有Cu2O
D.一定有Cu2O,可能有Cu
【解析】选D。H2还原CuO生成红色固体,可能是Cu和Cu2O中的一种或两种,产物中加入稀H2SO4溶液变蓝并得到红色固体,证明产物中含Cu2O,在酸性条件下2Cu+=Cu2++Cu,故不能证明产物中是否含有Cu。A项,产物中不一定含有铜,错误;B项,产物中一定有Cu2O,也可能有铜,错误;C项,产物中不一定有铜,一定有Cu2O,错误;D项,产物中一定有Cu2O,可能有铜,正确。
【典例03】(2023·张家口模拟)新制氢氧化铜存在平衡:Cu(OH)2+2OH-[Cu(OH)4]2-(深蓝色)。某同学进行下列实验:
下列说法不正确的是( )。
A.①中出现蓝色沉淀
B.③中现象是Cu(OH)2+2OH-[Cu(OH)4]2-正向移动的结果
C.④中现象证明葡萄糖具有还原性
D.对比②和④可知Cu(OH)2氧化性强于[Cu(OH)4]2-
【解析】选D。CuSO4溶液与NaOH溶液反应可生成蓝色沉淀Cu(OH)2,A正确;新制Cu(OH)2存在平衡:Cu(OH)2+2OH-[Cu(OH)4]2-,加入NaOH,氢氧根离子的浓度增大,平衡正向移动,B正确;③中加入葡萄糖溶液有砖红色的沉淀生成,说明葡萄糖中含有醛基,所以葡萄糖具有还原性,C正确;④中氧化葡萄糖的是[Cu(OH)4]2-,而②中未生成砖红色沉淀,可知氧化性:Cu(OH)2<[Cu(OH)4]2-,D错误。
知识点03 几种常见的铜盐
1.可溶性铜盐
(1)水解性:Cu2++2H2OCu(OH)2+2H+
①防水解:加入相应的稀酸
②制无水物:CuCl2·H2OCuCl2,在HCl气氛中加热
(2)与碱反应
①Cu2+Cu(OH)2↓
②Cu2+Cu(OH)2↓[Cu(NH3)4]2+(深蓝色溶液)
(3)硫酸铜晶体(CuSO4·5H2O)
①物性:蓝色晶体,俗称胆矾、蓝矾
②结构:[Cu(H2O)4]SO4·H2O
③晶体中存在的作用力:离子键、共价键、配位键、氢键
2.碱式碳酸铜
(1)俗名:铜锈或铜绿
(2)组成处理:Cu(OH)2·CuCO3
(3)化学性质:具有Cu(OH)2和CuCO3的双重性质
①与盐酸反应:Cu2(OH)2CO3+4H+2Cu2++3H2O+CO2↑
②热分解反应:Cu2(OH)2CO32CuO+CO2↑+H2O
③与氢气反应:Cu2(OH)2CO3+2H22Cu+CO2↑+2H2O
④与铝反应:3Cu2(OH)2CO3+4Al6Cu+CO2↑+2Al2O3+3H2O
易错点:铜盐的易错知识点
(1)CuSO4常用来检验某些气体或液态有机物中微量水的存在,而不是用于除水。
(2)CuSO4溶液与过量氨水反应的过程:Cu2+Cu(OH)2↓[Cu(NH3)4]2+(深蓝色溶液)
(3)碱式碳酸铜可以认为是Cu(OH)2和CuCO3组成的混合型化合物
(4)硫酸铜溶液和消石灰配制波尔多液,其杀菌原理是重金属盐使细菌蛋白质变性
【典例04】某兴趣小组的同学发现,将CuSO4溶液与K2CO3溶液混合会产生蓝绿色沉淀。他们对沉淀的组成很感兴趣,决定采用实验的方法进行探究。
(1)【提出假设】
假设1:所得沉淀为Cu(OH)2;
假设2:所得沉淀为_________;(填化学式)
假设3:所得沉淀为碱式碳酸铜[化学式可表示为[mCu(OH)2•nCuCO3]。
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)
【定性探究】
步骤1:将所得悬浊液过滤,先用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如装置如图(夹持仪器未画)进行定性实验;
(2)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设________成立。
(3)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是_____(填代号)。
A.浓硫酸 B.无水CuSO4 C.碱石灰 D.P2O5
(4)乙同学验证假设3成立的实验现象是________________。
【定量探究】
(5)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在常温时的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是________(填代号)。
A.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
B.Ba(OH)2为强碱,Ca(OH)2为弱碱
C.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
D.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为27.1g,实验结束后,装置B的质量增加2.7g,C中产生沉淀的质量为19.7g。则该蓝绿色固体的化学式为________;A中发生反应的化学方程式为_______________。
【解析】(1)CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,氢氧化铜和碳酸铜都是蓝色沉淀,可能是反应复分解反应生成了碳酸铜沉淀,或双水解生成了氢氧化铜沉淀,或碱式碳酸铜,假设1中沉淀为Cu(OH)2,假设2为CuCO3;(2)加热氢氧化铜生成水蒸气和黑色氧化铜,加热碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,若反应后A中蓝绿色固体变黑,C中澄清石灰水不变浑,证明一定不含有碳酸铜,现象的产生为氢氧化铜,假设1正确。(3)加热氢氧化铜生成水蒸气和黑色氧化铜,加热碳酸铜分解生成二氧化碳和黑色氧化铜,二氧化碳能使澄清的石灰水变浑浊,所以需要验证水的存在和二氧化碳的存在就可以证明产生的物质成分,装置A中加热是否变化为黑色固体,装置B选择无水硫酸铜验证是否生成水,澄清石灰水是否变浑浊证明是否生成二氧化碳。(4)假设3:所得沉淀为碱式碳酸铜[化学式可表示为mCu(OH)2•nCuCO3],氢氧化铜、碳酸铜分解,装置A中加热都会变化为黑色固体,装置B选择无水硫酸铜,根据是否变蓝色验证是否生成水,根据装置C中澄清石灰水是否变浑浊证明是否生成二氧化碳,所以证明假设是否正确的现象为:A中蓝绿色固体变黑色说明氢氧化铜、碳酸铜分解,B中无水CuSO4固体变蓝说明存在Cu(OH)2,C中有白色沉淀产生说明存在CuCO3,即能验证假设3成立,即A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生。(5)①Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2,故A正确;氢氧化钙也为强碱,故B错误;BaCO3的摩尔质量大于CaCO3,测量误差小,故C正确;CaCO3的溶解度和BaCO3溶解度相差不大,故D错误。②B中吸收水的物质的量n(H2O)==0.15ml,C中吸收二氧化碳生成碳酸钡白色沉淀,根据碳原子守恒二氧化碳的物质的量:n(CO2)=n(BaCO3)==0.1ml,m(CO2)=0.1ml×44g·ml-1=4.4g,氧化铜的质量为:m(CuO)=27.1g-2.7g-4.4g=20g,其物质的量为:n(CuO)==0.25ml,则铜离子、氢氧根离子和碳酸根离子的物质的量之比=0.25ml∶0.3ml∶0.1ml=5∶6∶2,所以其化学式为:2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2,2CuCO3•3Cu(OH)2受热分解生成CuO、二氧化碳和水,其反应的方程为:2CuCO3•3Cu(OH)25CuO+3H2O↑+2CO2↑。
【答案】(1)CuCO3(2)1(3)B
(4)A中蓝绿色固体变黑色,B中无水CuSO4固体变蓝,C中有白色沉淀产生
(5)①AC ②2CuCO3•3Cu(OH)2或3Cu(OH)2•2CuCO3或Cu5(OH)6(CO3)2
2CuCO3•3Cu(OH)25CuO+3H2O↑+2CO2↑
知识点04 金属的冶炼
1.金属在自然界中的存在
(1)化合态:大多数金属
(2)游离态:金、铂等极少数金属
2.冶炼实质:金属离子金属原子(Mn++ne-=M)
3.冶炼依据:金属离子的氧化性强弱不同
4.冶炼方法
(1)电解法:冶炼金属活泼性很强的金属(如K、Ca、Na、Mg、Al等)
①2NaCl(熔融)2Na+Cl2↑
②MgCl2(熔融)Mg+Cl2↑
③2Al2O3(熔融)4Al+3O2↑
(2)热还原法:用还原剂(C、CO、H2、Al、Na等)还原金属活泼性介于Zn~Cu之间的金属化合物。
①Fe2O3+3CO2Fe+3CO2
②2CuO+C2Cu+CO2↑
③WO3+3H2W+3H2O
④TiCl4+4NaTi+4NaCl
⑤Cr2O3+2Al2Cr+Al2O3
(3)热分解法:用于冶炼不活泼金属Hg、Ag。
①2HgO2Hg+O2↑ ②2Ag2O4Ag+O2↑
5.铜的冶炼“两方法”
(1)湿法炼铜:Fe+CuSO4=FeSO4+Cu。
(2)高温炼铜
①工业上用高温冶炼黄铜矿的方法获得粗铜
2CuFeS2+4O2Cu2S+3SO2+2FeO(炉渣)
2Cu2S+3O22Cu2O+2SO2
2Cu2O+Cu2S6Cu+SO2↑
②电解精炼铜:用粗铜做阳极,失电子变为Cu2+,用纯铜棒做阴极即可得精铜
易错点1:金属冶炼的易错知识点
(1)在化合物中金属元素都显正价,表现氧化性,但是处于中间价态的金属还表现还原性。
(2)金属冶炼的实质是金属阳离子得电子被还原为金属单质。
(3)金属越不活泼,其相应的金属阳离子的氧化性越强,越容易被冶炼。
易错点2:用还原法来冶炼某些很活泼的金属原理
Na+KCleq \(=====,\s\up7(850 ℃))K↑+NaCl
2RbCl+Mgeq \(========,\s\up7(700~800 ℃))MgCl2+2Rb↑
主要运用了化学平衡移动原理,利用K、Rb沸点低,汽化离开反应体系,使化学反应得以向正反应方向进行。
【典例05】工业上,金属的制取有多种方法,选择何种方法与金属的性质密切相关。
(1)金属Na、Mg、Al等的制取常采用电解法。写出以铂为电极电解熔融氯化镁制镁的电极反应式。
阳极_______________________;阴极________________________________。
(2)金属钾因为易溶于盐而不易分离,且电解时有副反应发生,工业上通常用钠与氯化钾在高温下反应制取,该反应为:Na(l)+KCl(l)NaCl(l)+K(g);ΔH>0,根据下表有关数据回答下列问题:
①制取钾的适宜温度范围为________________。
②制取钾的条件为________________。
A.适当高温高压 B.适当低温低压
C.适当高温低压 D.适当低温高压
③工业上采用此法制得的钾往往不纯,最可能含有的杂质是________________,检验方法为_______________________________________。
(3)用铝热反应方法将Fe3O4中的铁还原出来,写出该反应的化学方程式:
________________________________________________________
若用此法制得0.84t Fe,则转移电子________ml。
【解析】(1)电解熔融氯化镁制镁时,阳极是Cl―失去电子被氧化成Cl2,电极反应式为2Cl――2e―=Cl2↑;阴极是Mg2+得到电子被还原成Mg,电极反应式为Mg2++2e―=Mg。
(2)①K、Na的活泼性相近,要从上述可逆的置换反应中制取K,主要是利用K的沸点比Na的低,而控制温度使K气化,其余三种物质均为液体,便于生成的K蒸气不断逸出,使反应向生成K的方向进行而制得K。所以温度应该高于K的沸点(774℃),高于其余三种物质中熔点最高的NaCl的熔点(801℃),而低于其余三种物质中沸点最低的Na的沸点(890℃),综上分析,合适的温度范围应大于801℃,小于890℃。②从上分析可知,制备钾必须采用适当的高温,保证钾以蒸汽形式存在,而减小压强,平衡Na(l)+KCl(l)NaCl(l)+K(g)正向移动,所以制取钾的条件为适当高温低压。③因为制备反应为可逆反应,而且钾蒸汽和钠蒸汽的沸点差别不是特别大,所以制备的钾蒸汽中一定含有少量的钠蒸汽。检验金属钠可以用焰色试验,钠的焰色为黄色。
(2)铝热反应是热还原法的一种,利用铝的还原性比铁的强将铁置换出来,反应的化学方程式为8Al+3Fe3O49Fe+4Al2O3,该反应转移电子数为24,即9Fe~24e―,所以n(e―)=n(Fe)=×=4×104ml。
【答案】(1)阳极:2Cl――2e―=Cl2↑ 阴极:Mg2++2e―=Mg
(2)①801℃~890℃ ②C ③钠 焰色试验
(3)8Al+3Fe3O49Fe+4Al2O3 4×104ml
知识点05 金属材料与合金
一、金属材料与合金的性质
1.金属材料:包括纯金属及其合金
2.合金的组成和性能
(1)形成:所有成分在一定温度范围内都是液体
(2)合金具有金属特性,如导电、传热等。
(3)合金硬度变大的原因:改变了金属原子有规则的层状排列,使原子层间的相对滑动变得困难。
二、铁合金
1.合金元素:主要是铁和碳
2.铁合金分类:根据含碳的不同分类
(1)生铁:含碳量2%~4.3%,硬度大,抗压、性脆、韧性差
(2)钢:含碳量0.03%~2%,硬度小,延展性好、韧性好、机械性能好
3.钢的分类
(1)碳素钢
①低碳钢:韧性、焊接性好,但硬度低,用于制造钢板、钢丝和钢管等
②中碳钢:硬度高,韧性及加工性好,用于制造钢轨、车轮和建材等
③高碳钢:硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等
(2)合金钢(特种钢)
①形成:在碳素钢中适量加入合金元素,使钢的组织机构发生变化
②性能:强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等
③不锈钢:合金元素主要是铬(Cr)和镍(Ni)
三、其他合金
1.铝合金
(1)硬铝
①合金元素:Cu、Mg、Si、Mn
②性能:密度小、强度高,具有较强的抗腐蚀能力
(2)镁铝合金:制造飞机和宇宙飞船的理想材料
2.青铜:铜和锡合金,最早使用的合金
3.储氢合金
(1)概念:能够大量吸收氢气,并与氢气结合成金属氢化物的材料
(2)实用性要求
①储氢量大
②金属氢化物容易形成,稍微加热容易分解
③室温下吸、放氢速率快
(3)代表物:Ti-Fe合金,La-Ni合金
4.其他新型合金:钛合金、耐热合金、形状记忆合金等
易错点:合金的易错知识点
(1)合金中一定含有金属元素,可能含有非金属元素。
(2)合金是混合物,不是化合物。
(3)在合金中各组成成分元素的化合价都为0价。
(4)合金在空气中容易形成原电池,所以一般合金比纯金属易被腐蚀。但是不锈钢不易被腐蚀。
(5)具有特定组成的合金,具有固定的熔沸点。
【典例06】JerryWdall教授经研究发现,含有95%的铝和5%的镓、铟及锡组成的新型合金与水能快速反应制得氢气,由于整个反应中,只消耗铝,而反应生成的Al2O3可回收再利用,这样不仅降低了制氢气的成本,而且方便快捷,这一发现将燃氢汽车的研发推向新的里程碑。据此,下列说法不正确的是( )。
A.铝作为燃料,有资源丰富的优势
B.组成合金的几种金属元素都位于周期表第ⅢA族
C.合金与水反应的总反应式为:2Al+3H2O=Al2O3+3H2↑
D.合金中的镓、铟及锡对铝与水的反应起到催化作用
【解析】选B。铝是地壳中含有最多的金属,所以铝作为燃料,有资源丰富的优势,故A正确;铝、镓、铟是周期表第ⅢA族元素,锡是周期表第ⅣA族元素,故B错误;整个反应中,只消耗铝,而反应生成的Al2O3,则反应的方程式为2Al+3H2O=Al2O3+3H2↑,故C正确;由镓、铟及锡组成的新型合金与水能快速反应制得氢气,且只有铝反应进行,则合金中的镓、铟及锡对铝与水的反应起到催化作用,故D正确。
知识点01单质铜的结构和性质
知识点03几种常见的铜盐
知识点05金属材料与合金
知识点02铜的氧化物和氢氧化铜的性质
知识点04金属的冶炼
加入试剂
实验现象
稀硫酸
红色固体和蓝色溶液
浓硫酸、加热
无色气体
稀硝酸
无色气体和蓝色溶液
浓硝酸
红棕色气体和绿色溶液
溶解度(S)/g
溶度积(Ksp)
摩尔质量(M)/g•ml﹣1
Ca(OH)2
Ba(OH)2
CaCO3
BaCO3
CaCO3
BaCO3
0.16
3.89
2.9×10﹣9
2.6×10﹣9
100
197
物质
密度(g/cm3)
熔点(℃)
沸点(℃)
Na
0.97
97.81
890
K
0.86
63.65
770
NaCl
801
1465
KCl
776
1437
第4章 第15讲 铜 金属材料 金属冶炼(含答案) 2025年高考化学大一轮复习全新方案 讲义: 这是一份第4章 第15讲 铜 金属材料 金属冶炼(含答案) 2025年高考化学大一轮复习全新方案 讲义,文件包含第4章第15讲铜金属材料金属冶炼教师版2025年高考化学大一轮复习全新方案docx、第4章第15讲铜金属材料金属冶炼学生版2025年高考化学大一轮复习全新方案docx等2份学案配套教学资源,其中学案共20页, 欢迎下载使用。
2025届高中化学全程复习学案全套15铜 金属材料 金属冶炼: 这是一份2025届高中化学全程复习学案全套15铜 金属材料 金属冶炼,共8页。学案主要包含了师说·助学,教考衔接,对点演练等内容,欢迎下载使用。
2025年高考化学一轮复习讲义(新高考版)第4章 第18讲 铜 金属材料 金属冶炼: 这是一份2025年高考化学一轮复习讲义(新高考版)第4章 第18讲 铜 金属材料 金属冶炼,文件包含第4章第18讲铜金属材料金属冶炼docx、2025年高考化学一轮复习讲义新高考版第4章第18讲铜金属材料金属冶炼docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。












