





新高考化学一轮复习课件第5章 热点强化10 其他常考非金属及其化合物综合题专练(含解析)
展开一、有关过氧化氢的结构与性质
1.H2O2是重要的化学试剂,在实验室和实际生产中应用广泛。(1)写出H2O2的结构式:________________,H2O2在MnO2催化下分解的化学方程式:________________________。
(2)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。①写出反应的离子方程式: ____________________________________________。②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在______(填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是________________________________________________________________。
滴入最后半滴酸性KMnO4标准液后,溶液变浅紫色,且30 s 内不褪色
(3)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式: _______________________________。②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是_______________________________。③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
H2O2+Cu+2H+===Cu2++2H2O
2I-+2H+===2H2O+I2
已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为 ,写出此反应的离子方程式:____________________________________。④你认为H2O2被称为绿色氧化剂的主要原因是_______________________________。
还原产物为水,对环境无污染
(4)H2O2是一种二元弱酸,写出其第一步电离的方程式: ______________________,它与过量的Ba(OH)2反应的化学方程式为______________________________。
H2O2+Ba(OH)2===BaO2+2H2O
二、有关硒和碲及其化合物信息题
2.为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为①Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;②SeO2+4KI+4HNO3===4KNO3+Se+2I2+2H2O,下列说法错误的是A.①中SO2是还原产物,SeO2是氧化产物B.②中KI是还原剂,SeO2是氧化剂C.每生成0.4 ml I2共转移1.2 ml电子D.氧化性由强到弱的顺序是H2SO4(浓)>SeO2>HNO3
反应②中,生成2 ml碘单质,转移4 ml电子,则每生成0.4 ml I2共转移0.8 ml电子,故C错误;在同一反应中氧化剂的氧化性大于氧化产物的氧化性,反应①中氧化性:H2SO4(浓)>SeO2,反应②中硝酸既不是氧化剂也不是还原剂,说明氧化性:SeO2>HNO3,故D正确。
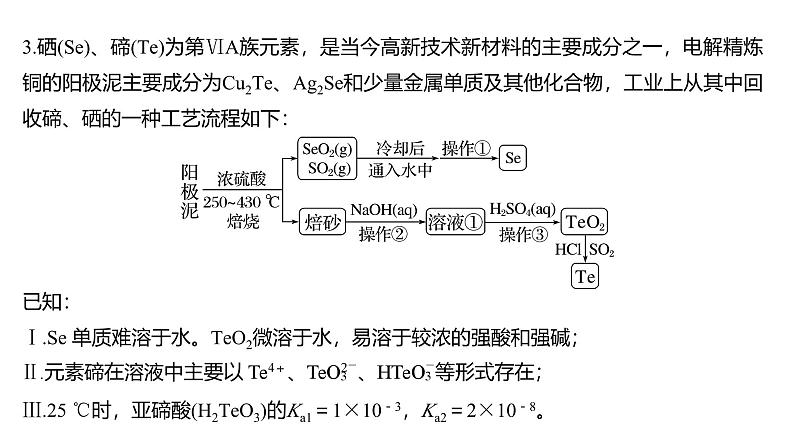
3.硒(Se)、碲(Te)为第ⅥA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:
已知:Ⅰ.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
Ⅲ.25 ℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
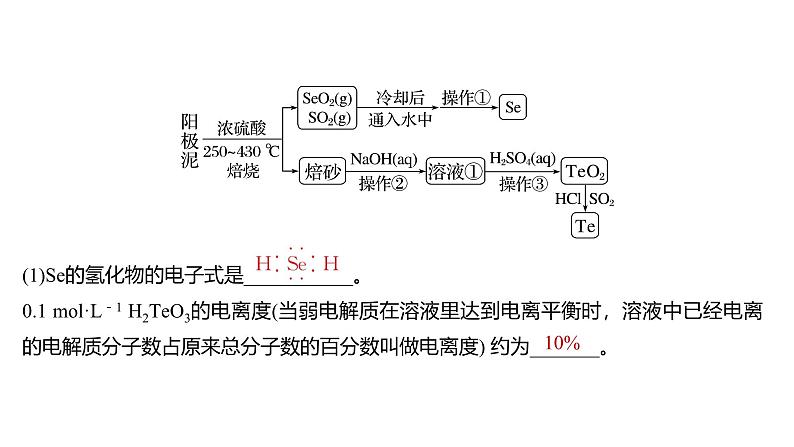
(1)Se的氢化物的电子式是___________。0.1 ml·L-1 H2TeO3的电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_______。
(2)加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是________________________________。(3)SeO2与SO2在冷却后通入水中发生反应的化学方程式: _______________________________________。反应后分离出Se单质的操作①为_________(填操作名称)。
SeO2+2SO2+2H2O
===2H2SO4+Se↓
根据流程图,SeO2与SO2在冷却后通入水中发生反应生成Se,反应的化学方程式为SeO2+2SO2+2H2O===2H2SO4+Se↓,Se单质难溶于水,反应后可以通过过滤操作分离Se单质。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_________(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为_______________________________。
(5)向溶液①中加入硫酸时控制溶液的pH为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率________(填“偏高”“偏低”或“无影响”)。
TeO2易溶于较浓的强酸和强碱,向溶液①中加入硫酸时控制溶液的pH为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致生成的TeO2沉淀偏少,碲的回收率偏低。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,再将SO2通入溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式: ______________________________________。
(7)上述流程中可循环利用的物质是______________(填化学式)。
三、有关磷、砷及其化合物信息题
4.已知:次磷酸(H3PO2)的电离常数Ka(H3PO2)=5.9×10-2。碱性条件下,次磷酸盐可与硝酸银溶液反应进行化学镀银。下列说法不正确的是A.次磷酸具有强还原性B.次磷酸溶液中通入足量氯气,pH增大C.次磷酸钠溶液滴入酚酞变红色
H3PO2中P显+1价,具有还原性,A项正确;H3PO2具有还原性,通入足量氯气发生反应:H3PO2+2Cl2+2H2O===H3PO4+4HCl,故溶液pH减小,B项错误;
5.磷化铝(AlP,熔点:2 000 ℃)通常是作为一种广谱性熏蒸杀虫剂,主要用于熏杀粮食中的储粮害虫等,下列有关说法正确的是A.AlP属于分子晶体B.起熏杀作用的物质通常是Al(OH)3C.AlP能水解或与稀硫酸作用,且均产生一种无毒气体D.常用铝与红磷在一定条件下化合制备AlP
AlP的熔点为2 000 ℃,比较高,属于共价晶体,A项错误;AlP可发生水解:AlP+3H2O===Al(OH)3↓+PH3↑,Al(OH)3没有氧化性,不能熏杀害虫,PH3有剧毒,可熏杀害虫,B项错误;AlP与稀硫酸发生反应:2AlP+3H2SO4===Al2(SO4)3+2PH3↑,AlP水解或与稀硫酸作用均可产生有毒气体PH3,C项错误;红磷和铝粉烧制可得磷化铝,该反应为化合反应,D项正确。
6.砷(As)及其化合物与生产、生活密切相关,广泛应用在杀虫剂以及药物中。回答下列问题:(1)砷是第四周期第ⅤA族元素。下列关于第ⅤA族元素及其化合物的说法不正确的是______(填字母)。a.沸点:PH3<NH3b.酸性:HNO3>H3AsO4c.As的氧化物的水化物是强碱d.形成的简单离子半径随着原子序数递增而增大
(2)工业生产中常用“古氏试砷法”检验微量砷,其反应原理如下:①将含砷化合物转化为具有极强还原性的AsH3。②AsH3与AgNO3溶液反应产生As2O3与另一种固体,该反应的离子方程式:______________________________________________。
2AsH3+12Ag++3H2O===As2O3+12H++12Ag↓
(3)砷及其化合物几乎都有毒,通常+3价砷化合物的毒性强于+5价砷化合物。海产品中含有微量+5价砷化合物,食用海鲜后不能马上进食水果的原因是____________________________________________________________________________________。(4)砷酸(H3AsO4)可用于制造杀虫剂、药物。As2O3溶于稀硝酸中可得砷酸,此反应的化学方程式:________________________________________。
水果中富含还原性物质(如维生素C等),能把+5价砷化合物还原为毒性更大的+3价砷化合物
3As2O3+4HNO3+7H2O===6H3AsO4+4NO↑
(人教版)高考化学一轮复习讲义课件第5章热点强化10 喷泉实验及拓展(含解析): 这是一份(人教版)高考化学一轮复习讲义课件第5章热点强化10 喷泉实验及拓展(含解析),共6页。PPT课件主要包含了打开止水夹挤出胶,头滴管中的水,氨极易溶于水使烧,瓶内的压强迅速减小,NaOH溶液等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第10章 热点强化24 多官能团有机物的结构与性质 (含解析): 这是一份新高考化学一轮复习精品课件 第10章 热点强化24 多官能团有机物的结构与性质 (含解析),共16页。PPT课件主要包含了热点专练等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第5章 热点强化10 其他常考非金属及其化合物综合题专练 (含解析): 这是一份新高考化学一轮复习精品课件 第5章 热点强化10 其他常考非金属及其化合物综合题专练 (含解析),共25页。PPT课件主要包含了H2O2+,增大接触面积,加快反应速率,Na2TeO3,HCl等内容,欢迎下载使用。












