

赤峰市第二实验中学2023-2024学年高一下学期期中考试化学试卷(含答案)
展开一、单选题
1.《厉害了,我的国》展示了中国探索太空,建设世界第一流的高铁、桥梁、码头5G技术联通世界等取得的举世瞩目的成就。它们都与化学有着密切的联系。下列说法正确的是( )
A.5G手机搭载的手机芯片主要成分是硅
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
C.“火树银花合,星桥铁锁开”中涉及的焰色反应是化学变化
D.碳纳米材料是一类有机高分子材料,主要包括富勒烯、碳纳米管和石墨烯等
2.下列过程属于人工固氮的是( )
A.分离液态空气制氮气
B.工业合成氨
C.豆科植物的根瘤菌将氮气转化为氨
D.打雷闪电时氮气转化为含氮化合物
3.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是( )
A.金刚石比石墨稳定
B.等质量的金刚石和石墨完全燃烧释放的热量相同
C.金刚石转化为石墨是吸热反应
D.1mlC(金刚石)比1mlC(石墨)的总能量高
4.分离下列固体混合物时,可按溶解、过滤、蒸发的顺序进行的是( )
A.氯化钠和泥沙B.氧化铜和木炭
C.碳酸铵和硝酸铜D.氢氧化钾和硫酸钠
5.关于化学能与电能或热能的转化,下列说法正确的是( )
A.AB.BC.CD.D
6.物质间纷繁复杂的转化关系是化学魅力所在,下列物质的转化在一定条件下能一步实现的是( )
A.AB.BC.CD.D
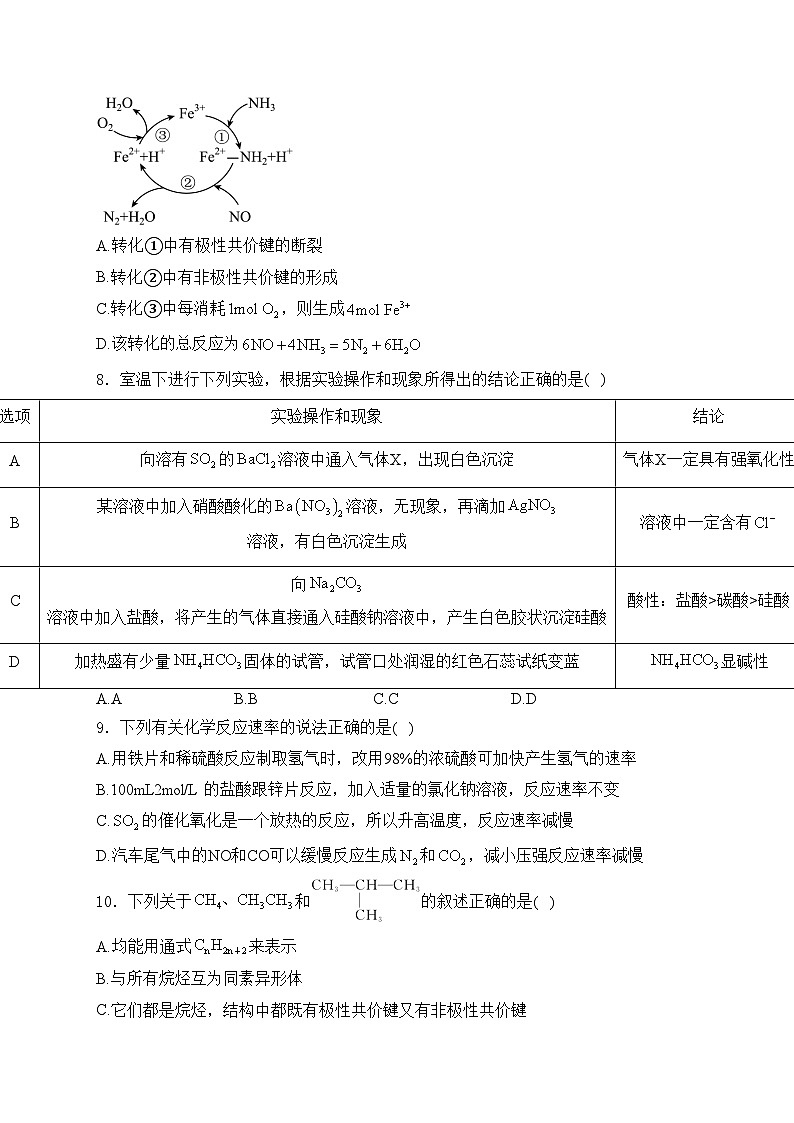
7.还原的反应历程如图。下列说法不正确的是( )
A.转化①中有极性共价键的断裂
B.转化②中有非极性共价键的形成
C.转化③中每消耗,则生成
D.该转化的总反应为
8.室温下进行下列实验,根据实验操作和现象所得出的结论正确的是( )
A.AB.BC.CD.D
9.下列有关化学反应速率的说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B.100mL2ml/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C.的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成和,减小压强反应速率减慢
10.下列关于和的叙述正确的是( )
A.均能用通式来表示
B.与所有烷烃互为同素异形体
C.它们都是烷烃,结构中都既有极性共价键又有非极性共价键
D.它们的性质完全相同
11.下列关于同分异构体的叙述正确的是( )
A.新戊烷的一氯代物有1种
B.丙烷中7个氢原子被溴原子取代的产物有1种
C.丁烷的二氯代物有7种
D.有6种结构
12.纸电池为轻型、高效的新型能源存储带来希望之光。一种碱性纸电池如图所示,薄层纸片的两面分别附着锌和二氧化锰,电池总反应:,[已知中的化合价为+3]。下列有关说法错误的是( )
A. 薄层纸片的作用为载体和传导体
B. 该新型电池工作时,电子由沿内电路流回
C. 为正极材料,电极反应式为
D. 每转移电子,负极材料质量增加17g
13.在4L密闭容器中充入气体和气体,在一定条件下发生反应:,达到平衡时,生成了,经测定,D的浓度为,下列判断正确的是( )
A.
B.B的转化率为40%
C.平衡时A的浓度为
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
14.如下图所示的“化学多米诺实验”装置中分别盛放的物质为①稀硫酸;②锌粒;装置③、④、⑤、⑥中的试剂及反应现象见下表,其中设计合理且实验现象符合预测的是( )
A.AB.BC.CD.D
二、多选题
15.用和催化合成乙烯的反应原理为:,向1L恒容密闭的催化反应器中充入和,测得温度对的平衡转化率和催化剂催化效率的影响如图。下列说法正确的是( )
A.容器内气体密度不变可以作为判断反应达到平衡状态的标志
B.生成乙烯的速率:M点一定大于N点
C.250℃时,反应5min后达到平衡状态,则5min内
D.升高温度,催化剂的催化效率降低
三、填空题
16.在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价—类”二维图。
请回答以下问题。
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有______,______(填化学式,任写两种)。
(2)写出Cu和Z的浓溶液发生反应的化学方程式__________________。
(3)将Y通入品红溶液中,可观察到的现象是______________________________。
(4)工业上处理废气时,通过步骤Ⅲ和步骤w将Y转化为再利用。
①实现步骤Ⅰ的转化所加试剂是______(写出一种即可)。
②实现步骤Ⅱ的转化可选择______试剂(填序号)。
A.B.KIC.D.
(5)欲制备,从氧化还原角度分析,合理的是______(填序号)。
AB.C.D.
(6)将与混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为______。
17.氮氧化物()是大气污染物之一,处理工业废气中的对于环境保护具有重要的意义。
(1)在一定条件下可将还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
①用装置A制备,写出反应的化学方程式为____________;装置B内的试剂是______。
②装置D中发生反应的离子方程式是______,铜丝可抽动的优点是____________。
③在装置M中和充分反应,生成两种对环境友好的物质,该反应中和的物质的量之比为______。
(2)用NaOH溶液吸收法处理(仅含NO、)。已知过程中发生的反应有:
;
①用不同浓度的NaOH溶液吸收含量不同的尾气,关系如图:
(α表示中的含量):用NaOH溶液吸收氮氧化物的最佳条件为:______,______。
②若一定体积的被250mL2ml·L的NaOH溶液恰好完全吸收,溶液质量增加19.8g,则x的值为______。
18.化学反应中伴随着能量变化,请按要求回答下面的问题。
(1)下列反应中,生成物总能量大于反应物总能量的是_________(填序号)。
①酸与碱的中和反应
②碳酸氢钠和盐酸反应
③镁和盐酸反应
④碳与二氧化碳反应
⑤晶体与混合搅拌
(2)汽车发动机工作时会引发和反应,生成等污染大气,如图是和反应生成的能量变化,则图中三种分子最稳定的是_________(写分子式)。若反应生成气体,则_________(填“吸收”或“放出”)_________的热量。
(3)根据原电池原理可以制造化学电池。如:电动汽车上用的铅酸蓄电池,放电时的电池总反应为,写出该铅酸蓄电池放电时正极的电极反应式_________。
(4)根若依据反应设计原电池,其工作原理示意图如图。
①电极上的电极反应式为_________。
②每转移,消耗标准状况下的_________L。
19.化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①各时间段反应速率最大的是__________(填“0~1”“1~2”“2~3”“3~4”或“4~5”)min,原因是__________。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率为__________(设溶液体积不变)。
(2)另一学生为控制反应速率,防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是_______(填字母)。
A.蒸馏水B.KCl溶液C.溶液D.溶液
(3)某温度下,在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是_______。
②该反应达到平衡状态的标志是_______(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1mlY的同时消耗2mlZ
③2min内Y的转化率为_______。
参考答案
1.答案:A
解析:
2.答案:B
解析:A.工业获取氨气,A 错误;B.工业合成氨符合人工固氨的概念,B正确;C.豆科植物的根瘤菌将氮气转化为氨为生物固氮,C错误;D.打雷闪电时氨气转化为含氮化合物为自然固氮,D错误。
3.答案:D
解析:
A.石墨转化为金刚石要吸收能量,说明石墨的能量低,稳定,所以石墨比金刚石稳定,故A错误;
B.金刚石的能量高,等质量的石墨和金刚石完全燃烧时释放的能量金刚石比石墨多,故B错误;
C.石墨转化为金刚石要吸收能量,则金刚石转化为石墨是放热反应,故C错误;
D.石墨转化为金刚石要吸收能量,说明1mlC(金刚石)比1mlC(石墨)的总能量高,故D正确;
故选:D。
4.答案:A
解析:A.氯化钠溶于水而泥沙不溶于水,符合上述分析,A正确;B.氧化铜和木炭都不溶于水,B错误;C.碳酸铵和硝酸铜均溶于水,但二者会反应生成碳酸铜沉淀,不符合题意,C错误;D.氢氧化钾和硫酸钠均溶于水,不可用上述方法分离,D错误;故选A。
5.答案:C
解析:A.没有盐桥,不能形成原电池,故A错误B.原电池的电流是从正极流出,而在锌锰干电池中锌皮是负极,故B错误;C.锂离子电池充电时是电解池原理,发生氧化还原反应,故C正确;D.镁条与稀硫酸的反应是能自发的氧化还原反应,是放热反应,而图中的能量变化体现的是吸热反应,故D错误;故选C。
6.答案:D
解析:A.硅和氧气在高温条件下反应生成二氧化硅,氧化硅不能溶于水,A错误;B.二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮不和水反应,B错误;C.铁与氯气反应生成氯化铁,氯化铁溶液和铜反应生成氯化亚铁和氯化铜,C错误;D.硫燃烧生成二氧化硫,二氧化硫和硫化氢反应生成硫和水,D正确;答案选D。
7.答案:D
解析:A.转化①中 中转化为-;B.转化②中生成了氨气;C.转化中被氧气氧化为,生成1ml,转移1ml电子;D.该转化中,参加反应的除了NO和氨气外,还有气。
8.答案:B
解析:
9.答案:D
解析:A.常温下浓硫酸与铁发生钝化阻碍了反应进行,故改用98%的浓硫酸后不能增大生成氢气的速率,A错误;
B.加入氯化钠溶液后,氯化钠不参与反应,但溶液体积增大,相当于稀释,导致稀硫酸浓度减小,反应速率减小,B错误;
C.升高温度,增大活化分子百分数,增大反应速率,C错误;
D.压强越低反应速率越慢,所以减小压强反应速率减慢,D正确。
故选D。
10.答案:A
解析:A.的分子式为,的分子式为,三者均可以用通式来表示,A正确;
B.由同种元素组成的不同的单质互为同素异形体,三者均为化合物,其他烷烃也为化合物,不互为同素异形体,B错误;
C.三者都是烷烃,但甲烷中只含C-H极性共价键,不含非极性共价键,C错误;
D.三者都是烷烃,化学性质相似,但熔、沸点等物理性质不相同,D错误;
答案选A。
11.答案:A
解析:
12.答案:B
解析:A.薄层纸片的两面分别附着锌和二氧化锰,薄层纸片的作用为载体和传导体,故A正确;B.该新型电池工作时,电子由负极经外电路流向正极,即电子由沿内电路流回,故B错误; C.由分析可知,被还原,应为电池正极,电极反应式为:,故C正确; D.负极反应式为:,每转移电子,负极增加OH-,负极材料质量增加17g,故 D正确;答案选B。
13.答案:A
解析:
14.答案:A
解析:
15.答案:C
解析:A.,m、V不变,密度不可以作为判断反应达到平衡状态的标志,A错误;B.温度升高使反应速率增大的程度与催化剂失去活性使反应速率减小的程度无法比较大小,则N点和M点生成乙烯速率快慢无法判断,B错误;C.根据题意,和的投料比等于改反应的系数之比,则平衡是图示平衡转化率50%,平衡转化率也为50%,故,C正确;D.250℃之前,温度升高,催化剂的催化效率升高,D错误;故选C。
16.答案:(1)S;
(2)
(3)品红溶液褪色
(4)①CaO;②AC
(5)B
(6)1:2
解析:(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质应该处在S的中间价态,可以为S、;
(2)浓硫酸与Cu在加热条件下会发生氧化还原反应产生、、,化学方程式:;
(3)有漂白性,所以通入品红溶液中,可观察到的现象是:品红溶液褪色;
(4)①根据图示可知:步骤Ⅰ可以是被溶液吸收反应产生沉淀和,属于碱,也可以与CaO反应产生,CaO属于碱性氧化物;
②根据图示可知:步骤Ⅱ是转化为,在该转化过程中S元素化合价升高,失去电子被氧化,因此在转化过程中需要加入氧化剂,则:
A.与反应产生,A符合题意;
B.KI具有还原性,不能使转化为,B不符合题意;
C.具有还原性,具有强氧化性,可以使与反应产生、,C符合题意;
D.、都具有还原性,二者不能反应产生,D不符合题意;
故合理选项是AC;
(5)中硫的化合价为+2价,需要化合价高于+2价含硫的氧化剂和低于+2价含有硫的还原剂,只有B满足,故选B;
(6)与混合,可生成淡黄色固体,方程式为:,其中为氧化剂,为还原剂,则氧化剂与还原剂的物质的量之比为1:2。
17.答案:(1);碱石灰
;可控制反应;4∶3
(2)50%;1.25;1.6
解析:(1)①用装置A加热氢氧化钙和氯化铵,制备,其中发生反应的化学方程式为;装置B的作用是干燥氨气,U型管内的试剂是碱石灰,装置B内的试剂是碱石灰。故答案为:;碱石灰;②铜与浓硝酸反应生成硝酸铜。二氧化氮与水,装置D中发生反应的离子方程式是,反应生成的氮的氧化物是大气污染气体,铜丝可抽动的优点是可控制反应。故答案为:;可控制反应;③在装置M中和充分反应,生成两种对环境友好的物质,还原的化学方程式为,该反应中和的物质的量之比为4∶3。故答案为:4∶3;
(2)①用NaOH溶液吸收氮氧化物的最佳条件为:,。故答案为:50%;1.25;②若一定体积的被0.250mL2的NaOH溶液恰好完全吸收,ml,溶液质量增加19.8g,即的质量,g/ml,则x的值为1.6。故答案为:1.6。
18.答案:(1)②④⑤
(2);吸收;90kJ
(3)
(4);11.2
解析:
19.答案:(1)2~3;该反应是放热反应,此时温度高且盐酸浓度较大,故反应速率较快;0.025
(2)CD
(3)3X(g)+Y(g)2Z(g);AC;10%
解析:(1)①相同条件下,反应速率越大,相同时间内收集的气体越多;由表中数据可知,反应速率最大的时间段是2~3min,原因是:该反应是放热反应,温度越高,反应速率越大,故答案为:2~3min;该反应是放热反应,此时温度高,反应速率越大;
②3~4分钟时间段,收集的氢气体积=(576-464)mL=112mL,,根据氢气和HCl关系式得消耗的,则,故答案为:0.025ml/(L•min);
(2)A.加入蒸馏水,氢离子浓度减小,反应速率降低,故A不选;
B.加入KCl溶液,氢离子浓度降低,反应速率降低,故B不选;
C.加入溶液,相当于含有硝酸,硝酸和Zn反应生成NO而不是氢气,故C选;
D.加入4溶液,Zn和铜离子反应生成Cu,Zn、Cu和稀盐酸构成原电池而加快反应速率,故D选;
故选:CD;
(3)①根据图知,随着反应进行,X、Y的物质的量减少而Z的物质的量增加,则X和Y是反应物而Z是生成物,反应达到平衡时,(X)=(1.0-0.4)ml=0.6ml、(Y)=(1.0-0.8)ml=0.2ml、(Z)=(0.5-0.1)ml=0.4ml,同一可逆反应中同一段时间内参加反应的各物质的物质的量变化量之比等于其计算之比,X、Y、Z的计量数之比=0.6ml:0.2ml:0.4ml=3:1:2,则该反应方程式为3X+Y2Z,故答案为:3X+Y2Z;
②A.A.Y的体积分数在混合气体中保持不变,说明各物质的量不变,反应达到平衡状态,故A正确;
B.X、Y的反应速率比为3:1时,如果反应速率都是指同一方向的反应速率,则该反应不一定达到平衡状态,故B错误;
C.反应前后气体压强减小,当容器内气体压强保持不变时,各物质的物质的量不变,反应达到平衡状态,故C正确;
D.容器内气体的总质量一直保持不变,故D错误;
E.只要反应发生就有生成1mlY的同时消耗2mlZ,故E错误;
故选:AC;
③Y的转化率=×100%=10%,故答案为:10%。
A该装置能将化学能转化为电能
B在锌锰干电池中电流从锌皮流出
C锂离子电池充电时发生氧化还原反应
D镁条与稀硫酸反应的能量变化如上图所示
选项
转化关系
A
B
C
D
选项
实验操作和现象
结论
A
向溶有的溶液中通入气体X,出现白色沉淀
气体X一定具有强氧化性
B
某溶液中加入硝酸酸化的溶液,无现象,再滴加溶液,有白色沉淀生成
溶液中一定含有
C
向溶液中加入盐酸,将产生的气体直接通入硅酸钠溶液中,产生白色胶状沉淀硅酸
酸性:盐酸>碳酸>硅酸
D
加热盛有少量固体的试管,试管口处润湿的红色石蕊试纸变蓝
显碱性
③中试剂
④中固体逐渐消失
⑤中溶液褪色
⑥中尾气处理
A
浓盐酸
石蕊试液
溶液
B
浓
溶液
水
C
浓
木炭
品红溶液
饱和溶液
D
浓NaOH溶液
固体
少量溶液
水
时间/min
1
2
3
4
5
氢气体积/mL(标准状况)
100
240
464
576
620
会泽县实验高级中学校2023-2024学年高一下学期5月期中考试化学试卷(含答案): 这是一份会泽县实验高级中学校2023-2024学年高一下学期5月期中考试化学试卷(含答案),共11页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
内蒙古赤峰市第二实验中学2023-2024学年高二下学期5月期中考试化学试题: 这是一份内蒙古赤峰市第二实验中学2023-2024学年高二下学期5月期中考试化学试题,文件包含期中考试化学试题docx、答案docx、高二化学期中考试答题卡docx等3份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
吉林省长春市第二实验中学2023-2024学年高一下学期期中考试化学试题: 这是一份吉林省长春市第二实验中学2023-2024学年高一下学期期中考试化学试题,共11页。试卷主要包含了满分100分,考试时间75分钟,本卷命题范围,用表示阿伏加德罗常数的值,下列离子等内容,欢迎下载使用。












