




湖北省荆州市沙市区湖北省沙市中学2023-2024学年高三下学期7月月考化学
展开命题人:文智丽 审题人:蔡艳
考试时间:2024 年 7 月 26 日
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Sc 45
一、单选题(本题共 15小题,每小题 3分,共 15分。在每小题给出的四个选项中,只有一项符
合题目要求)
1.新材料助力嫦娥六号探月挖“宝”,下列有关说法正确的是
A.“挖宝”所用钻杆由碳化硅增强铝基复合材料制造,碳化硅属于共价晶体
B.月面国旗由超细玄武岩纤维纺织而成,玄武岩纤维属于有机高分子
C.登月中,所用北斗系统的导航卫星,其计算机的芯片材料是高纯度二氧化硅
D.制造一同启程的小卫星“思源二号”,采用了特种镁合金与碳纤维,碳纤维属于纤维素
2.《梦溪笔谈》是北宋科学家沈括(1031 ~ 1095)的著作,书中详细记载了我国劳动人民在科学技
术方面的卓越贡献和他自己的研究成果,被称为“中国科学史的里程碑”,沈括则被称为“中国整
部科学史中的卓越人物”。下列工艺不可能被记载的是
A.湿法炼铜 B.炼铁 C.电解法冶炼铝 D.海水晒盐
3.由下列实验操作和现象得出结论正确的是
选项 实验操作和现象 结论
A 向可能混有苯酚的甲苯中滴加饱和溴水,未出现白色沉淀 甲苯中未混有苯酚
淀粉已经完全水解
花生油在水中的溶解度
C 将花生油与 NaOH 溶液混合,充分加热后分层消失
随温度升高而增大
1-溴丁烷和 NaOH 乙醇溶液共热,将产生的气体通入溴水
D 反应有 1-丁烯生成
中,溴水褪色
A.A B.B C.C D.D
1
司B
向淀粉溶液中加入适量稀硫酸,加热煮沸后,加入过量
NaOH 溶液,再加入少量碘水,溶液不变蓝
4.海洋生物参与氮循环的过程如图所示。下列说法正确的是
A.反应①②均为氧化还原反应
B.反应③④中的氮元素均被还原
C.反应③⑤均属于氮的固定
− 分别参与反应④和⑤, D.等质量的 NO
2
转移电子数之比为4:3
5.化合物 M 能发生如下转化,下列说法错误的是
A.过程 I 中 M 既发生氧化反应,又发生还原反应,过程Ⅱ为取代反应
B.N 中所有原子不可能共平面
C.M、N、L 分子都可以使酸性 KMnO4 褪色
D.1mlN 和足量钠反应可以放出标准状况下 22.4LH2
6.某化工厂的废液中含有乙醇(沸点为 78.5℃)、苯酚、乙酸和二氯甲烷,该工厂设计的回收方
案如图所示,下列说法错误的是
A.操作 I、II 均要用到铁架台
B.回收物 1 一定是二氯甲烷,其空间结构为正四面体形
H+ + CO2− =HCO− C.试剂 a 和试剂 c 反应的离子方程式可能为
3 3
D.加入试剂 b 发生的反应为
2
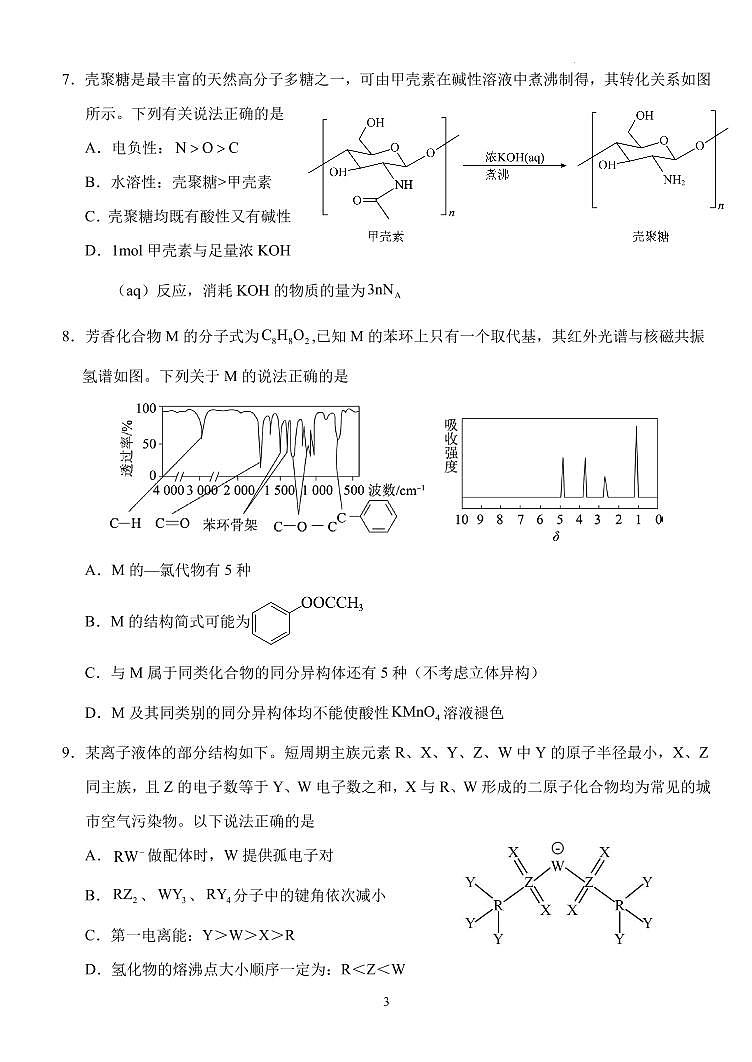
司7.壳聚糖是最丰富的天然高分子多糖之一,可由甲壳素在碱性溶液中煮沸制得,其转化关系如图
所示。下列有关说法正确的是
A.电负性: N > O > C
B.水溶性:壳聚糖>甲壳素
C.壳聚糖均既有酸性又有碱性
D.1ml 甲壳素与足量浓 KOH
(aq)反应,消耗 KOH 的物质的量为3nNA
8.芳香化合物 M 的分子式为C8H8O2 ,已知 M 的苯环上只有一个取代基,其红外光谱与核磁共振
氢谱如图。下列关于 M 的说法正确的是
A.M 的—氯代物有 5 种
B.M 的结构简式可能为
C.与 M 属于同类化合物的同分异构体还有 5 种(不考虑立体异构)
D.M 及其同类别的同分异构体均不能使酸性KMnO4 溶液褪色
9.某离子液体的部分结构如下。短周期主族元素 R、X、Y、Z、W 中 Y 的原子半径最小,X、Z
同主族,且 Z 的电子数等于 Y、W 电子数之和,X 与 R、W 形成的二原子化合物均为常见的城
市空气污染物。以下说法正确的是
A.RW− 做配体时,W 提供孤电子对
B.RZ2 、 WY3 、 RY4 分子中的键角依次减小
C.第一电离能:Y>W>X>R
D.氢化物的熔沸点大小顺序一定为:R<Z<W
3
司10.室温下,某化学研究小组通过下列 3 组实验探究 H2O2 溶液的性质。
实验 实验操作和现象
I 向CrO3 溶液中滴加少量0.1ml/LH2O2 溶液,溶液变深蓝色
已知:①Cr 最高价为+6;CrO3 与 H2O2 的反应为CrO3 +2H2O2 =2H2O+CrO5(深蓝色)。② H2O2 溶
液呈弱酸性。
根据实验操作和现象,下列有关推论错误的是
A.实验 I 中溶液变深蓝色,该反应为非氧化还原反应
B.实验Ⅱ中前一段溶液迅速变黄,体现了H2O2 的氧化性
C.实验Ⅱ中稍后产生气体,体现了生成的Fe3+ 对 H2O2 分解起催化作用
D.实验Ⅲ中溶液逐渐褪色,体现了 H2O2 的弱酸性
11.反应 ( ) ( ) ( )
2SO g +O g 2SO g ΔH=-196.6kJml-1 。下列图示正确且与对应的叙述相符的
2 2 3
是
A.A B.B C.C D.D
4
司II
向 2mL0.1ml/L H2O2 溶液中滴加少量 FeSO4 溶液,溶液迅速变黄,稍后产生气体;再
加入几滴 KSCN 溶液,溶液变红
III
向 2mL0.01ml/L NaOH溶液中滴加少量酚酞,溶液变红,向其中滴加 3~5 滴
0.01ml/L H O 溶液,振荡,溶液逐渐褪色
2 2
A.实线、虚线分别表
示未使用催化剂和使
用催化剂时 v正 、v
逆 随
时间的变化
B.表示化学平衡常数
与温度和压强的关系
C.表示 t1 时刻改变的
条件是升高温度
D.表示SO 的平衡转
2
化率与温度和压强的
关系
12.已知琥珀酸 ( )
是一种常见的二元弱酸,以
CH COOH H A 代表其化学式,电离过程:
2 2 2
H A H+ + HA− , HA− H+ + A− 。常温时,向10mL0.1ml⋅L−1H A 水溶液中逐滴滴加同浓度
2
2
的 NaOH 溶液,混合溶液中H2A 、 HA− 和 A2− 的物质的量分数(δ )随 pH 变化的关系如图
所示。下列说法正确的是
A. H2A 的 Ka = −12
2 10
B.当溶液中c( )= c( 2− )时, pH = 2.7
H A A
2
C.滴加 NaOH 溶液过程中存在:
c(A − )+ c(HA− )+ c(H A)= 0.1ml⋅L−
2 1
2
D.当H2A 被完全中和时,
c(OH− )= c(HA− )+ c(H A)+ c(H )
+ 2
13.稀土是“工业味精”,邓小平同志曾说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要
存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见
的化合价为+3 和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.工业上可以电解 Ce(SO4)2 溶液制备铈单质
B.向 Ce(SO4)2 溶液中通入 SO2,其离子方程式为 2Ce4++SO2+2H2O=2Ce3++SO2− +4H+
4
C.常温下,已知 Ksp[Ce(OH)3]=1.0×10-20,则 Ce3+在 pH 为 5.0 时恰好完全沉淀
D.四种铈的核素 13658Ce、13858Ce、14058Ce、14258Ce 之间可以通过化学反应进行转化
14.W 可与Cu2+ 形成化合物 Q,Q 的结构如图所示,下列说法错误的是
A.C、N、O 均能与 H 形成既含极性键又含非极性键的分子
B.W 与Cu2+ 结合前后,N 原子的杂化方式发生了变化
C.与 Cu 原子未成对电子数相同的同周期元素有 4 种
D.Q 中的作用力有配位键、共价键、氢键
15.某立方晶系的锑钾(Sb − K) 合金可作为钾离子电池的电极材料,该合金的晶胞结构如图 1 所示。
下列说法不正确的是
A.K 均位于由 Sb 构成的八面体空隙
5
司B.与 Sb 最邻近的 Sb 原子数为 12
D.沿晶胞面对角线投影,所得的投影
如图 2
二、非选择题
16.(14 分)氧化钪(Sc O )在电光源、催化剂和陶瓷等领域有广泛应用。以含钪精矿(含Sc O 、
2 3 2 3
MnO 、SiO 、 Al O 、 FeTiO )为原料制备Sc O 的一种工艺流程如图所示。
2 2 2 3 3
2 3
已知: Fe3+ 、Ti4+ 、Sc3+ 都能与 P504(用 HR 表示)发生反应,机理为
M +nHR MR +nH 。
n+ +
n
回答下列问题:
(1)流程使用 0.2 ml·L-1 的盐酸,用 36.5%的浓盐酸(密度为 1.2 g·cm-3)配制稀盐酸 460 mL,
则需要用量筒量取浓盐酸的体积为 mL,使用的玻璃仪器除烧杯、量筒、玻璃棒外,
还需要的是 。
(2)“萃余液”中除 Mn2+ 、 Fe2+ 外还含有的金属阳离子主要有 ;“酸洗”操作的目的
为 。
(3)“反萃取”时,生成的沉淀主要为 Sc(OH)3 和 Ti(OH)4,生成 Sc(OH)3 的化学方程式为
,“滤渣”的主要成分为 。
(4)草酸钪晶体 ( )
⋅ ⋅
Sc C O 6H O ,M= 462g ml−1
2 2 4 3 2
如图所示。250℃时,固体的主要成分是
(填化学式)。
6
司C.K 和 Sb 之间的最短距离为
1
4
3apm
m(剩余固体)
m(原始固体)
在空气中煅烧,
随温度的变化情况
17.(14 分)甲醇是最为常见、应用场景最为广泛的基础化学品之一,甲醇与乙烯、丙烯和氨是
用于生产所有其他化学品的四种关键基础化学品。
(1)已知反应 I:H2 (g)+CO2 (g) CO(g)+ H2O(g) ∆H1 = +41kJ / ml ;
反应Ⅱ:3H2 (g)+CO2 (g) CH3OH(g)+ H2O(g) ∆H2 = −49kJ / ml ;
则反应Ⅲ:2H2 (g)+CO(g) CH3OH(g) ∆H3 = kJ / ml;
(2)常温常压下利用Cu / ZnO / ZrO 催化剂实现二氧化碳加氢制甲醇的反应历程和能量变化图
如下(其中吸附在催化剂表面上的粒子用*标注)
转化历程中决速步骤的反应方程式为 。
(3)在恒容密闭容器中充入1mlCO2 和3mlH2 。发生反应 I 和Ⅱ,测得平衡时CO2 的转化率、
CO和CH3OH 的选择性随温度变化如下图所
( ) n(CO)或n CH OH
示
+ 100%
选择性 = × 。
3
( )
n(CO) n CH OH
3
①表示CO选择性的曲线是 。(填字母)
② 250℃时,反应 I 的平衡常数为 (保
留 2 位有效数字)。
③ 210℃~250℃过程中,CO2 转化率变化的原因是 。
(4)工业上用甲醇燃料电池采用电解法处理含CN− 和Cl− 的碱性废水,将CN− 转化为无污染的
物质,其原理如下图所示。
7
司①电解废水时, Pt(b)电极与石墨电极 相连(填“M”或“N”)。
②甲醇燃料电池工作时, Pt(a) 电极的电极反应式为 。
③消耗标准状况下11.2LO2 ,理论上可处理含 mlCN− 的废水。
18.(15 分)实验表明,当乙醛加入到溴水中,溴水会褪色。针对此现象,某小组同学依据乙醛
结构进行探究。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与Br2 发生 (填反应类型)。
假设Ⅱ:乙醛具有 α-H,可与溴水发生取代反应。一元取代反应如下:
CH CHO + Br → BrCH CHO + HBr
3 2 2
无论是几元取代,参加反应的 Br2 与生成的 HBr 物质的量之比为 。
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化为乙酸,补全下面反应方程式。
【实验过程】针对以上假设,该小组同学设计了两组方案。
方案Ⅰ:通过对比反应现象判断反应类型。
序号 操作 现象
试管 1 1mL 溴水+1mL 乙醛,充分振荡后静置 褪色
试管 2 1mL 溴的CCl4 溶液+1mL 乙醛,充分振荡后静置 ________________
结论:假设Ⅰ不成立。
8
司CH CHO +
3
Br +
2
H O →
2
CH COOH +
3
(2)试管 2 中的实验现象为 。
方案Ⅱ:通过测定反应后混合液的 pH 判断反应类型。
序号 操作 pH
1.85
加入 20mL 溴水,再加入 10mL 苯酚溶液,待完全反应后
加入 20mL 相同浓度的溴水,再加入 10mL 20%的乙醛溶
试管 2 ____________
液(乙醛过量),3min 后完全褪色,测定混合液 pH
注:苯酚和乙酸的电离及温度变化对混合液 pH 的影响可忽略。
(3)写出苯酚与溴水反应的化学方程式: 。
(4)若试管 2 中反应后混合液的 pH=1.85,则证明乙醛与溴水的反应类型为 ;
若 pH 接近 ,则证明为氧化反应(lg2≈0.3);若 pH 介于两者之间,则证明两种反
应类型皆有。
【实验结论与反思】
(5)根据实验数据得出结论:乙醛与溴水发生氧化反应。查阅资料,乙醛并非直接与Br2 发
生反应,而是与次溴酸(HBrO)反应,从平衡移动的角度解释乙醛使溴水褪色的原
因: 。
(6)已知柠檬醛的结构如图,结合上述实验,检验柠檬醛分子中存在碳碳双键的合理方法为
(填字母序号)。
A.向酸性高锰酸钾溶液中加适量柠檬醛,观察其
是否褪色
B.向溴水中加适量柠檬醛,观察其是否褪色
C.向溴的CCl4 溶液中加适量柠檬醛,观察其是
否褪色
D.向新制氢氧化铜悬浊液中加适量柠檬醛,加热,冷却后取上层清液再加溴水,观察
其是否褪色
9
司试管 1
(苯酚过量),测定混合液 pH
[ ( )
c H+ =1×10− ml⋅L− ][ ( )
1.85 1
19.(12 分)有机物 G 可用于麦田除草,其合成路线如图所示:
回答下列问题:
(1)B→C 的反应类型为 。
(2)A 遇 FeCl3 溶液显紫色,且苯环上的一氯代物有 2 种,A 的名称是 。
(3)D 中官能团的名称为 ,写出 D 与银氨溶液反应的化学方程式:
。
(4)已知 E 与 F 反应除了生成 G 外,还有小分子 HCl 生成,F 的结构简式为 。
(5)满足下列条件的 E 的芳香族同分异构体有 种(不含立体异构)。
①苯环上含有二个取代基;
②能发生银镜反应和水解反应;
③与 FeCl3 溶液能发生显色反应。
∆
→ 。其中 X、Y 的结构简式分别为 、 。 O ,Ag /Cu
2
1
司(6)以苯乙烯为原料合成 的合成路线为
Br
→ X
2
∆
→
NaOH水溶液
Y
化学参考答案
1-5 ACDDC 6-10 BBCCD 11-15 CBBBA
16.(14 分,每空 2 分)
(1)8.3 500mL 容量瓶、胶头滴管
(2) Al3+ 除去Fe3+
(3)ScR +3NaOH=Sc(OH) ↓ +3Na ( )
3 3 R Ti OH
4
(4) ( )
Sc C O ⋅H O
2 2 4 3 2
17.(14 分,除标注外每空 2 分)
(1)-90 (1 分)
(2)HCOO* + 5H* =CH O* + H O + H* (或合理答案)(1 分)
3 2
(3)c 0.0015 升高温度对反应Ⅰ的影响大于反应Ⅱ(或合理答案)
18.(15 分,除标注外每空 2 分)
(1)加成反应(1 分) 1:1 (1 分) CH3CHO+Br2 +H2O=CH3COOH+2HBr (1 分)
(2)溴的 CCl4 溶液不褪色
(3)
(4)取代反应 1.55
(5)乙醛与 HBrO 反应,使得 Br2 +H2O HBr+HBrO 平衡正向移动,消耗 Br2 ,溶液褪色
(6)C
1
司(4)M
CH OH − 6e− + H O = CO + 6H+ 0.4
3 2 2
19.(12 分,除标注外,每空 2 分)
(1)取代反应(1 分)
(2)邻苯二酚或 1,2-苯二酚(1 分)
(3)醚键、醛基
(4)
(5)6
(6) (1 分) (1 分)
1
司+2[Ag(NH3)2]OH
Δ
→ +2Ag↓+3NH
3+H2O
湖北省荆州市沙市中学2023-2024学年高二下学期3月月考化学试题: 这是一份湖北省荆州市沙市中学2023-2024学年高二下学期3月月考化学试题,共10页。试卷主要包含了2L HF分子中F原子数为0,5NA,00等内容,欢迎下载使用。
湖北省荆州市沙市区高级中学校2023-2024学年高三下学期3月月考化学试题(含答案): 这是一份湖北省荆州市沙市区高级中学校2023-2024学年高三下学期3月月考化学试题(含答案),共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
湖北省荆州市沙市区沙市中学2022-2023学年高一下学期5月月考化学试卷(含答案): 这是一份湖北省荆州市沙市区沙市中学2022-2023学年高一下学期5月月考化学试卷(含答案),共16页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。












