





第八章 第37讲 化学平衡常数及转化率-2025年高考化学一轮总复习课件
展开1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,用符号_______表示。
2.表达式一定温度下,可逆反应mA(g)+nB(g)⥫⥬pC(g)+qD(g)达到平衡时,化学平衡常数为K=________________(固体和纯液体的浓度视为常数,通常不计入化学平衡常数表达式中)。
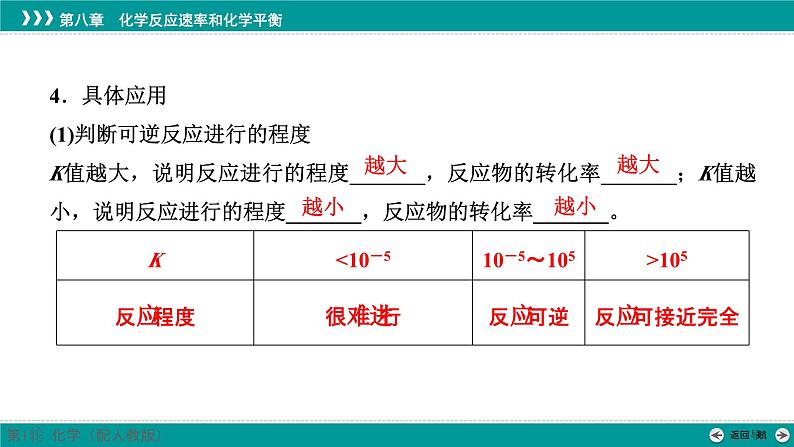
3.影响因素(1)化学平衡常数是表明_______________的一个特征值,通常情况下只受_______影响,与反应物和生成物的浓度变化无关。(2)通常K越大,说明平衡体系中生成物所占的比例_______,正反应进行的程度_______,即该反应进行得_______,平衡时反应物的转化率_______。反之,K越小,表示反应进行得___________,反应物的转化率_______。(3)一般来说,K>_______时,该反应就进行得基本完全了。
4.具体应用(1)判断可逆反应进行的程度K值越大,说明反应进行的程度_______,反应物的转化率_______;K值越小,说明反应进行的程度_______,反应物的转化率_______。
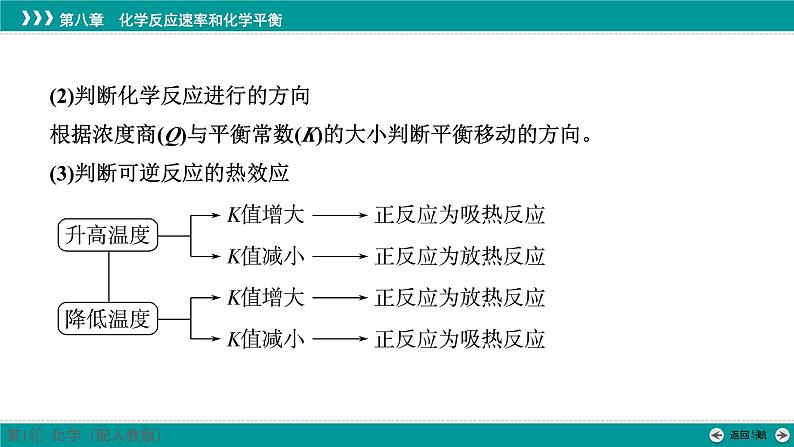
(2)判断化学反应进行的方向根据浓度商(Q)与平衡常数(K)的大小判断平衡移动的方向。(3)判断可逆反应的热效应
考向一 化学平衡常数与化学方程式的关系 [例1] (2023·全国甲卷,节选)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。已知下列反应的热化学方程式:①3O2(g)⥫⥬2O3(g) K1 ΔH1=+285 kJ/ml②2CH4(g)+O2(g)⥫⥬2CH3OH(l) K2 ΔH2=-329 kJ/ml反应③CH4(g)+O3(g)⥫⥬CH3OH(l)+O2(g)的平衡常数K3=________(用K1、K2表示)。
[练1] (2024·河北省衡水中学调研)T ℃时,三个反应及平衡常数如下:①CO(g)+CuO(s)⥫⥬CO2(g)+Cu(s) K1②H2(g)+CuO(s)⥫⥬Cu(s)+H2O(g) K2,③CO(g)+H2O(g)⥫⥬CO2(g)+H2(g) K。下列说法正确的是( )
考向二 化学平衡常数的应用[例2] (2024·北京丰台区统考)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是( )
[练2] 在体积为1 L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⥫⥬CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表所示:
回答下列问题:(1)升高温度,化学平衡向________(填“正反应”或“逆反应”)方向移动。
(2)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温度为________;该温度下,若该容器中含有1 ml CO2、1.2 ml H2、0.75 ml CO、1.5 ml H2O,则此时反应所处的状态为________________________________(填“向正反应方向进行中”“向逆反应方向进行中”或“平衡状态”)。答案:(1)正反应 (2)850 ℃ 向正反应方向进行中
[微点拨]三个换算量之间的关系 ①对于同一反应物,起始浓度-变化浓度=平衡浓度。②对于同一生成物,起始浓度+变化浓度=平衡浓度。③各物质的转化浓度(或物质的量)之比等于化学方程式中各物质的化学计量数之比。
2.利用“三段式法”计算平衡常数和转化率对于反应mA(g)+nB(g)⥫⥬pC(g)+qD(g),若A、B起始物质的量浓度分别为a ml/L、b ml/L,达到平衡后消耗A的物质的量浓度为mx ml/L,则有
3.压强平衡常数(Kp)和物质的量分数平衡常数(Kx)
考向一 化学平衡常数和转化率的计算 [例1] (1)(2023·全国甲卷,节选)电喷雾电离等方法得到的M+(Fe+、C+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4===M++CH3OH,结果如图所示。图中300 K的曲线是________(填“a”或“b”)。300 K、60 s时MO+的转化率为__________(列出算式)。
[练1] 加热N2O5(g)依次发生的分解反应为①N2O5(g)⥫⥬N2O3(g)+O2(g),②N2O3(g)⥫⥬N2O(g)+O2(g)。在容积为2 L的密闭容器中充入8 ml N2O5,加热到t ℃,达到平衡状态后O2为9 ml,N2O3为3.4 ml。则t ℃时反应①的平衡常数为( )A.10.7 B.8.5C.9.6 D.10.2
设N2O5的转化浓度为x ml/L,N2O3的转化浓度为y ml/L。
(2)(2023·新课标全国卷,节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为xH2=0.75、xN2=0.25,另一种为xH2=0.675、xN2=0.225、xAr=0.10。(物质i的摩尔分数:xi=ni/n总)
①图1中压强由小到大的顺序为__________,判断的依据是___________________________________________________________________________。 ②进料组成中含有惰性气体Ar的图是__________。
[例3] (2022·河北卷,节选)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应: Ⅰ .CH4(g)+H2O(g) ⥫⥬CO(g)+3H2(g) Ⅱ .CO(g)+H2O(g) ⥫⥬CO2(g)+H2(g)
(2)其他条件不变,H2O(g)起始量增加到5 ml,达平衡时,α=0.90,b=0.65,平衡体系中H2(g)的物质的量分数为________(结果保留两位有效数字)。
计算压强平衡常数(Kp)的思维模型
[练2] (2024·河南项城五校联考)我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]制备三甲胺[N(CH3)3]:(CH3)2NCHO(g)+2H2(g) ⥫⥬N(CH3)3(g)+H2O(g) ΔH=-144 kJ/ml。向体积相等的 Ⅰ 、 Ⅱ 两个恒容密闭容器中分别充入1 ml DMF(g)和2 ml H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
(1)容器 Ⅰ 中为________(填“绝热”或“恒温”)过程,判断的依据是_____________________________________________________________________。(2)若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是________。A.混合气体的密度不再发生改变B.反应容器中H2的质量分数不变C.2v正(H2)=v逆(H2O)D.平均相对分子质量不变
(3)n点时反应的平衡常数Kp=________(kPa)-1。(提示:用分压计算的平衡常数为Kp,分压=总压×物质的量分数)答案:(1)绝热 容器 Ⅰ 中的压强比容器 Ⅱ 中的压强大(2) BD (3)0.562 5
(1)该反应是放热反应,若容器绝热,则反应过程中温度升高,不利于平衡正向移动;又知该反应的正反应是气体体积减小的反应,绝热容器中的压强大于恒温容器中平衡时的压强,图中容器 Ⅰ 中的压强比容器 Ⅱ 中的压强大,则容器 Ⅰ 中为绝热过程。(2)该反应中气体总质量和总体积都不变,则混合气体的密度是定值,不能说明反应达到平衡,A错误;反应容器中H2的质量分数不变,其浓度不变,则该反应达到平衡,B正确;达到平衡时,v正(H2)=2v逆(H2O),C错误;该反应中气体平均相对分子质量增大,当混合气体平均相对分子质量不变时,则反应达到平衡,D正确。
(3)n点反应达到平衡,此时体系压强为36 kPa,起始压强是48 kPa,根据已知条件列出“三段式”:
2.(2024·重庆市第八中学月考)某温度下,在一个2 L的密闭容器中,加入4 ml A和2 ml B进行如下反应:3A(g)+2B(g) ⥫⥬4C(s)+2D(g) ΔH>0,10 min后反应达到平衡,测得生成1.6 ml C,则下列说法正确的是( )
2 L的密闭容器中,加入4 ml A和2 ml B进行如下反应:3A(g)+2B(g) ⥫⥬4C(s)+2D(g),10 min后达到平衡,测得生成1.6 ml C,则
3.(2024·天津河北区质检)在1 L密闭容器中进行如下反应:X(g)+3Y(g) ⥫⥬2Z(g),达到平衡时 X、Y、Z的物质的量分别为 0.1 ml、0.3 ml、0.2 ml,保持温度和容器体积不变时,再向容器中充入X、Y、Z的物质的量0.1 ml、0.3 ml、0.2 ml,则下列说法正确的是( )A.化学平衡常数不变,平衡不移动B.向正反应方向移动C.向逆反应方向移动D.容器内压强始终保持原来的2倍
平衡常数只和温度有关,温度不变,平衡常数不变,恒温恒容条件下,再向容器中充入X、Y、Z的物质的量0.1 ml、0.3 ml、0.2 ml,则相当于加压,平衡向正反应方向移动,B正确,A、C错误;平衡向正反应方向移动,气体的物质的量减小,压强小于原来的2倍,D错误。
4.在一定温度下,将气体X和气体Y各0.16 ml充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) ⥫⥬2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表所示:
下列说法正确的是( )A.反应前2 min的平均速率v(Z)=2.0×10-3 ml/(L·min)B.平衡时,X的转化率为67.5%C.该温度下,此反应的平衡常数K=1.44D.其他条件不变,再充入0.10 ml Y,平衡常数K减小
5.(2022·重庆卷)两种酸式碳酸盐的分解反应如下,某温度平衡时总压强分别为p1和p2。反应1:NH4HCO3(s) ⥫⥬NH3(g)+H2O(g)+CO2(g) p1=3.6×104Pa反应2:2NaHCO3(s) ⥫⥬Na2CO3(s)+H2O(g)+CO2(g) p2=4×103Pa该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )
A.反应2的平衡常数为4×106Pa2B.通入NH3,再次平衡后总压强增大C.平衡后总压强为4.36×105PaD.缩小体积,再次平衡后总压强不变
6.(2023·全国乙卷,节选)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:2FeSO4(s) ⥫⥬Fe2O3(s)+SO2(g)+SO3(g)( Ⅰ )。(1)平衡时pSO3-T的关系如下图所示。660 K时,该反应的平衡总压p总=________ kPa、平衡常数Kp( Ⅰ )=________(kPa)2。
(2)Kp( Ⅰ )随反应温度升高而____________(填“增大”“减小”或“不变”)。 (3)提高温度,上述容器中进一步发生反应2SO3(g)⥫⥬2SO2(g)+O2(g) ( Ⅱ ),平衡时pO2=______(用pSO3、pSO2表示)。在929 K时,p总=84.6 kPa、pSO3=35.7 kPa,则pSO2=________________ kPa,Kp( Ⅱ )=________________ kPa(列出计算式)。
(1)结合图像可知,当660 K时,pSO3=1.5 kPa,又因反应中只有二氧化硫与三氧化硫为气体,且物质的量之比为1∶1,因此pSO2=pSO3=1.5 kPa,因此平衡时p总=3.0 kPa。平衡常数Kp( Ⅰ )=1.5 kPa×1.5 kPa=2.25(kPa)2。(2)结合图像中pSO3随温度的升高而增加,可知温度升高平衡正向移动,该反应为吸热反应,平衡常数随温度升高而增大。(3)此体系为恒容体系,压强之比等于物质的量之比。开始时,SO2和SO3的压强相同,升高温度,三氧化硫进一步分解得到二氧化硫与氧气,设反应( Ⅰ )平衡时SO2的压强为a kPa,反应( Ⅱ )达到平衡时,SO3的转化压强为y kPa,根据化学方程式分析:
2025版高考化学一轮总复习第7章化学反应速率和化学平衡第25讲化学平衡常数及转化率的计算课件: 这是一份2025版高考化学一轮总复习第7章化学反应速率和化学平衡第25讲化学平衡常数及转化率的计算课件,共60页。PPT课件主要包含了化学平衡,浓度幂之积,正反应,逆反应,K1·K2,-45,图2反应机理,p1p2p3,33%等内容,欢迎下载使用。
备战2025届新高考化学一轮总复习第7章化学反应速率与化学平衡第36讲化学平衡常数及转化率课件: 这是一份备战2025届新高考化学一轮总复习第7章化学反应速率与化学平衡第36讲化学平衡常数及转化率课件,共51页。PPT课件主要包含了课标指引,目录索引,素养发展进阶,必备知识•梳理,浓度幂,正反应,化学平衡,逆反应,不处于,关键能力•提升等内容,欢迎下载使用。
新高考化学一轮复习课件 第7章 第42讲 化学平衡常数及转化率的计算: 这是一份新高考化学一轮复习课件 第7章 第42讲 化学平衡常数及转化率的计算,共60页。PPT课件主要包含了高考化学一轮复习策略,三段式计算模式,归纳整合,专项突破,压强平衡常数Kp,真题演练明确考向,课时精练等内容,欢迎下载使用。












