


重庆市南开中学高2024届高三第五次质量检测化学
展开考生注意:
1.本试卷满分100 分,考试时间75 分钟。
2.考生作答时,请将答案答在答题卡上。必须在题号所指示的答题区域作答,超出答题区域书写的答案无效,在试题卷、草稿纸上答题无效。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Ca—40 Ba—137
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列说法不正确的是
A. DNA分子中的双螺旋链通过共价键相互结合
B.用聚乳酸塑料代替聚氯乙烯塑料可以减少白色污染
C.乙炔在氧气中燃烧剧烈放热,可以用于焊接或切割金属
D.血液中存在 H2CO3/HCO3−的缓冲体系,为维持血液p H的 稳定发挥着重要作用
2.工业上制备 NaHSO₃的原理为: 2SO₂+Na₂CO₃+H₂O=CO₂+2NaHSO₃,反应涉及的微粒中空间构型为Ⅴ形且含有π键的是
A. SO₂ B.CO32− C. H₂O D.CO₂
3.若用NA表示阿伏加德罗常数的值,下列说法正确的是
A.用足量 NaOH 溶液吸收46 g NO₂,转移的电子数目为2NA
B.高温下12g石墨完全转化为金刚石,σ键的数目增加 NA
C.将 100mL0.1ml/LFeCl₃溶液蒸干所得的固体中 Cl⁻的数目为0.03NA
D.将1ml甲酸钠固体溶于甲酸溶液所得的中性溶液中 HCOO⁻0⁻的数目为 NA
4.钢中添加硅可提高其强度、硬度以及高温时的抗氧化性。下列相关化学术语的使用正确的是
A.工业制粗硅的化学方程式:
B. SiO₂的结构式:O=Si=O
C.钢铁发生吸氧腐蚀的负极方程式: Fe−2e⁻=Fe²⁺
D.Fe²⁺的价层电子排布式: 3d⁵4s¹
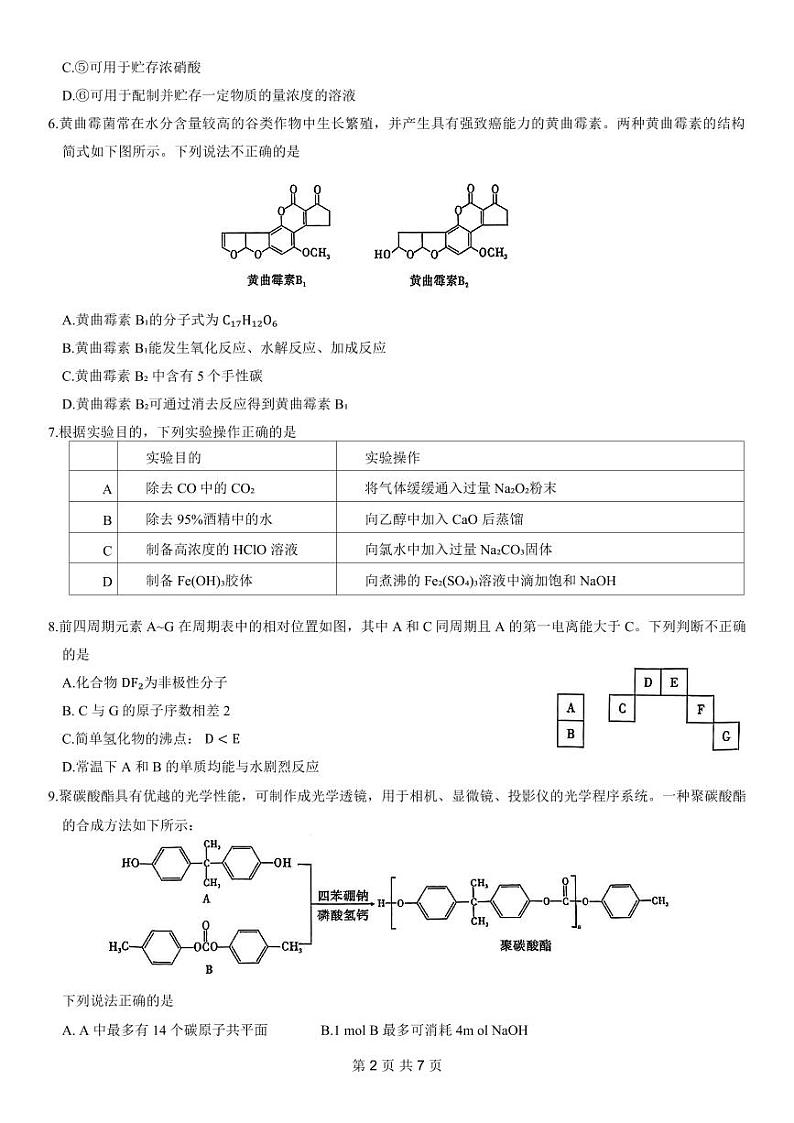
5.关于下列实验仪器使用的说法正确的是
A.①②均不能用酒精灯直接加热,可垫陶土网加热
B.④的冷凝效果比③更好,可用于蒸馏装置
C.⑤可用于贮存浓硝酸
D.⑥可用于配制并贮存一定物质的量浓度的溶液
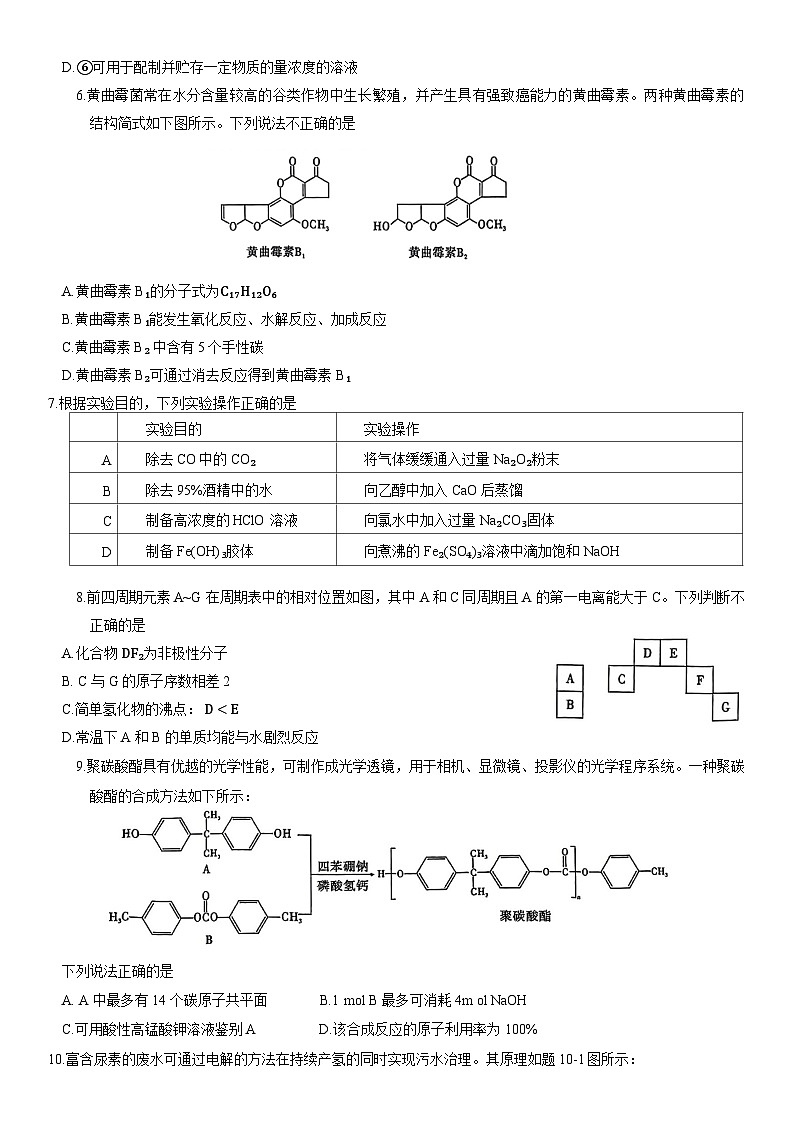
6.黄曲霉菌常在水分含量较高的谷类作物中生长繁殖,并产生具有强致癌能力的黄曲霉素。两种黄曲霉素的结构简式如下图所示。下列说法不正确的是
A.黄曲霉素 B₁的分子式为C₁₇H₁₂O₆
B.黄曲霉素 B₁能发生氧化反应、水解反应、加成反应
C.黄曲霉素 B₂ 中含有5个手性碳
D.黄曲霉素 B₂可通过消去反应得到黄曲霉素 B₁
7.根据实验目的,下列实验操作正确的是
8.前四周期元素A~G 在周期表中的相对位置如图,其中A和C同周期且 A 的第一电离能大于 C。下列判断不正确的是
A.化合物 DF₂为非极性分子
B. C 与G的原子序数相差2
C.简单氢化物的沸点: D
9.聚碳酸酯具有优越的光学性能,可制作成光学透镜,用于相机、显微镜、投影仪的光学程序系统。一种聚碳酸酯的合成方法如下所示:
下列说法正确的是
A. A 中最多有14 个碳原子共平面 B.1 ml B 最多可消耗4m l NaOH
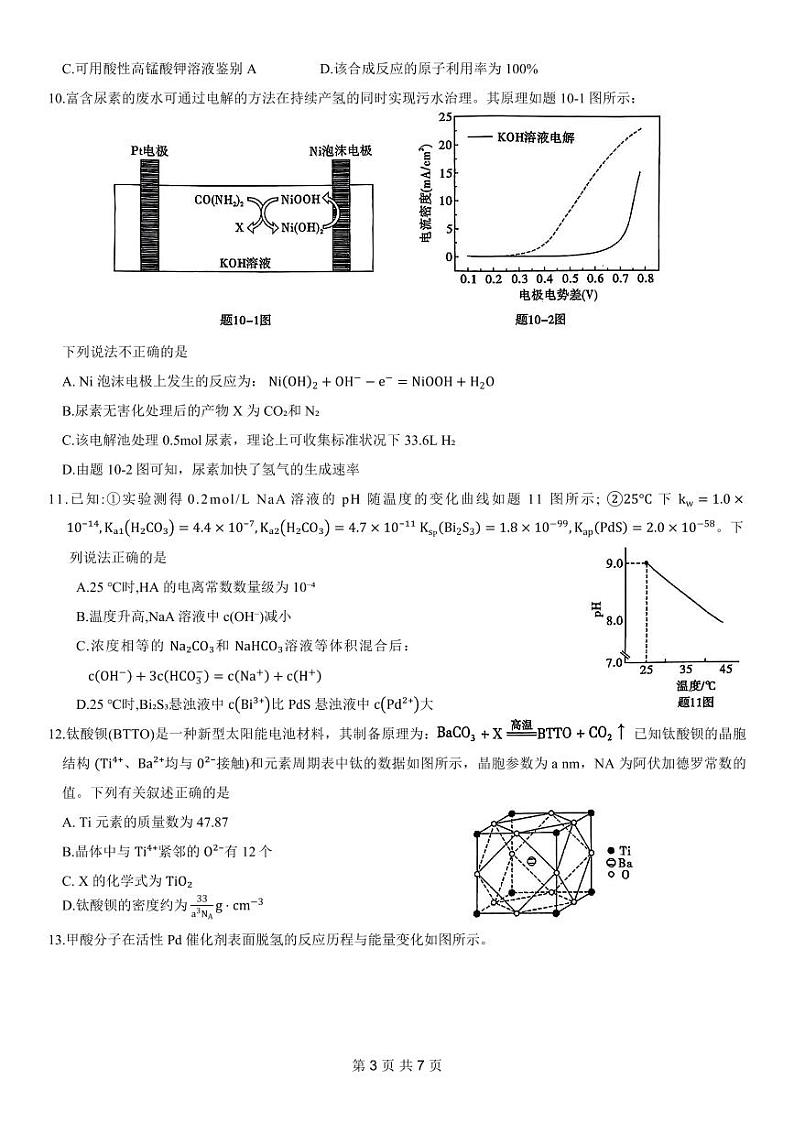
C.可用酸性高锰酸钾溶液鉴别A D.该合成反应的原子利用率为 100%
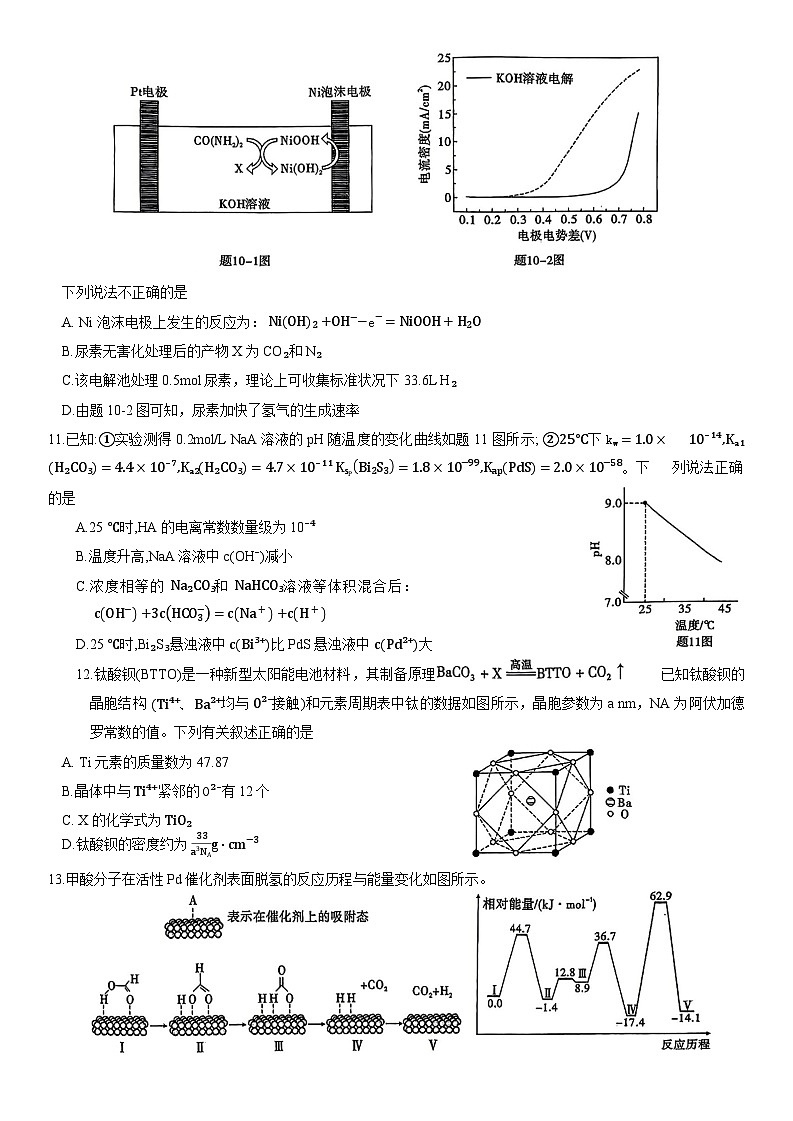
10.富含尿素的废水可通过电解的方法在持续产氢的同时实现污水治理。其原理如题10-1图所示:
下列说法不正确的是
A. Ni 泡沫电极上发生的反应为: NiOH2+OH−−e−=NiOOH+H2O
B.尿素无害化处理后的产物 X 为 CO₂和 N₂
C.该电解池处理0.5ml尿素,理论上可收集标准状况下33.6L H₂
D.由题10-2图可知,尿素加快了氢气的生成速率
11.已知:①实验测得0.2ml/L NaA溶液的 pH 随温度的变化曲线如题 11 图所示; ②25°C下 kw=1.0× 10⁻¹⁴,Kₐ₁H₂CO₃=4.4×10⁻⁷,Kₐ₂H₂CO₃=4.7×10⁻¹¹ KsPBi2S3=1.8×10−99,KapPdS=2.0×10−58。下 列说法正确的是
A.25 ℃时,HA 的电离常数数量级为10⁻⁴
B.温度升高,NaA溶液中c(OH⁻)减小
C.浓度相等的 Na₂CO₃和 NaHCO₃溶液等体积混合后: cOH−+3cHCO3−=cNa++cH+
D.25 ℃时,Bi₂S₃悬浊液中 cBi³⁺比PdS 悬浊液中 cPd²⁺大
12.钛酸钡(BTTO)是一种新型太阳能电池材料,其制备原理为: 已知钛酸钡的晶胞结构 (Ti⁴⁺、Ba²⁺均与 0²⁻接触)和元素周期表中钛的数据如图所示,晶胞参数为a nm,NA 为阿伏加德罗常数的值。下列有关叙述正确的是
A. Ti 元素的质量数为47.87
B.晶体中与 Ti⁴⁺紧邻的 O²⁻有 12个
C. X 的化学式为 TiO₂
D.钛酸钡的密度约为 33a3NAg⋅cm−3
13.甲酸分子在活性Pd 催化剂表面脱氢的反应历程与能量变化如图所示。
下列说法正确的是
A.升高温度,甲酸的平衡转化率增大
B.在 Pd 催化剂表面O—H键的解离速率比 C—H键的解离速率快
C. H—H 键的键能约为3.3 kJ/ml
D.若用 DCOOH 代替 HCOOH,可得到 HD
14.甲醇可通过CO 氢化法合成: COg+2H2g⇌CH3OHg ∆H=−280kJ/ml。 恒定温度为 T°C时,将6ml CO 和 12mlH₂充入1 L 密闭容器中,测得 cH₂按Ⅰ变化。下列说法不正确的是
A.T°C时,I中反应进行到B点时释放的热量为 1260 kJ
B.T°C时,该反应平衡常数为 1.25L²⋅ml⁻²
C.若其他条件不变,增大起始 nH₂,所得 cH₂)可能按Ⅱ变化
D.若其他条件不变,缩小容器体积,所得cH₂可能按Ⅲ变化
二、非选择题:共58分。
15.(15 分)粗铜精炼的副产品铜阳极泥中含有Au、Ag、Ag₂Se、Cu₂Se等物质,其含量远高于常规开采的矿石,是提取稀贵金属和硒的重要原料,其中一种分离提取的Ⅰ艺流程如下:
已知:①常温下,AgCl 的溶度积常数 Ksp=10−9.7
②常温下, Ag++2SO32−⇌AgSO323−的平衡常数 K=107,9
(1) Se 与O同族,其基态原子价层电子的运动状态有 种。
(2)“蒸硒”时将铜阳极泥与浓硫酸混合于 450∼500°C下焙烧,浓硫酸将硒元素氧化为 SeO₂并蒸出,写出 Cu₂Se与浓硫酸反应的化学方程式 。将炉气通入水中可得硒单质和 (写化学式)。
(3)“分金”时应控制 NaClO₃的用量以减少 (写化学式)的产生。
(4)“分银”原理为 AgCls+2SO32−aq⇌AgSO323−aq+Cl−aq;常温下该反应的平衡常数为 ,若加入 1LNa₂SO₃溶液溶解a ml AgCl,理论上l Na₂SO₃溶液的浓度须达到 ml/L(忽略溶解前后溶液的体积变化)。
(5)HCHO的作用为 ;将滤液2返回“分银”工序循环使用,发现循环多次后银的浸出率降低,可能的原因是 。
(6)粗银电解精炼时需控制电解液的pH为1.5~2,其原因是 。
16.(14分)过氧化钙为白色固体,常温下微溶于水、难溶于乙醇,在碱性条件下稳定。在潮湿的空气或水中发生水解反应并缓慢释放氧气,是一种用途广泛的优良供氧剂和消毒剂。一种过氧化钙的制备方法如题16-1图所示(略去夹持装置):
(1)步骤Ⅰ中首先向碳酸钙固体中加入稀盐酸至溶液中仅剩余极少量固体,反应的离子方程式为 。 将溶液煮沸、趁热过滤、冷却备用,其中煮沸的目的是 。另取6%的双氧水和浓氨水以体积比2:1混合备用。
(2)步骤Ⅱ制备过氧化钙晶体CaO₂⋅8H₂O。将两种备用溶液分别加到烧瓶和分液漏斗中,打开分液漏斗活塞向烧瓶中缓慢滴加溶液,开启磁力搅拌器使液体充分混合反应,滴加完毕后,继续在冰水浴中放置30 min,可观察到大量白色晶体生成。
①分液漏斗中盛装的液体为 (填字母)。
a.CaCl₂溶液 b.双氧水和浓氨水的混合溶液
②制备过氧化钙晶体的化学方程式为 。
③抽滤,依次用冰水、乙醇洗涤,检验沉淀是否洗净的操作是 。
(3)步骤Ⅲ控制温度为 105°C使 CaO₂⋅8H₂O脱水为 CaO₂,,过程中需持续通入氧气,其作用是 。
(4)已知CaO₂在350 ℃时迅速分解生成 CaO 和 O₂。采用量气法测定产品中 CaO₂含量的装置如题16-2图所示(略去加热装置),其中量气管由碱式滴定管装配而成。
①已知样品质量为mg,量气管的初始读数为 V₁mL(已换算为标准状况,下同),终点读数为 V₂mL,,则产品中过氧化钙的质量分数为 (用化简后的式子表示)。
②下列操作中会导致过氧化钙的质量分数偏高的是 。
a.实验前装置内残留有空气
b.初始读数时俯视量气管
c.停止加热后立即读数
d.最终读数时量气管液面高于水准管
17.(14分)CO广泛应用于冶金工业,是合成羰基类有机产品的重要原料。工业上常利用水蒸气和炽热焦炭制备 CO:
i.Cs+H₂Og⇌COg+H₂g
体系中还存在水煤气变换反应:
ii.COg+H2Og⇌CO2g+H2g
(1)已知 Cs+2H₂Og⇌CO₂g+2H₂gΔH=+90.1kJ⋅ml⁻1,则. △H₁= 。
(2)在一定温度下,向某恒容密闭容器中加入 2 ml C(s)和 1mlH₂Og,发生反应 i 和和。已知起始时体系的压强为100 kPa,在不同条件下测定体系的总压强(p)如下表所示。
①下列说法正确的是 。
a.混合气体的平均摩尔质量保持不变,说明反应体系已达到平衡
b.平衡时 CO₂的体积分数可能为13
c.采用对反应i选择性高的催化剂有利于提高 CO的平衡产率
②条件Ⅰ中,700~800℃范围内体系总压变化的原因可能为 。
③条件Ⅱ中, 740°C时测得体系中的 CO₂分压 pCO₂=15kPa,该条件下 H₂O的消耗速率为 kPa⋅h⁻¹∘780°C时,测得体系中 H₂的平衡分压 pH₂=90kPa,,则反应i在该温度下用平衡分压表示的平衡常数Kₚ= 。
(3)电解还原( CO₂也是合成CO的重要途径,同时可实现( CO₂的资源化利用。以A u为 电极材料、 KHCO₃溶液为电解质,往M 极持续通入 CO₂。其他条件不变,恒定通过电解池的电量,测得M 极 含碳产物的法拉第效率 FE%FE%=Qx(生成还原产物X所需要的电量)Q总电解过程中通过的总电量×100%随电解电压的变化如题17 图所示。
①电解时M极与电源的 极相连。
②a点时, CO₂发生电解反应的电极方程式为 。
18.(15 分)Ⅰ.丙二酸二乙酯是一种重要的化工原料,实验室可通过以下方法制备丙二酸二乙酯.
已知:—OH 连在C=N和 C=C上均不稳定,易发生异构化
(1)B的名称为 ,C中的官能团名称为 。
(2)D→E 的反应条件是 。
(3)C水解生成D的反应分三步进行,异构化过程中,仅发生H原子和不饱和键的转移。
M的结构简式为 ,N→D的离子方程式为 。
Ⅱ.丙二酸二乙酯可用于合成各种氨基酸。以缬氨酸 为例,合成路线如下所示。
已知: R₁NH₂+R₂X→R₁NHR₂+HX
(4)F→G 的反应类型为 。
(5)缬氨酸的同分异构体中,只含有一种官能团的物质有 。
(6)脯氨酸是一种环状氨基酸,结构为 若以丙二酸二乙酯为原料合成脯氨酸,应将 BrCHCH₃₂替换为 。
①
②
③
④
⑤
⑥
实验目的
实验操作
A
除去 CO中的 CO₂
将气体缓缓通入过量 Na₂O₂粉末
B
除去95%酒精中的水
向乙醇中加入CaO 后蒸馏
C
制备高浓度的 HClO 溶液
向氯水中加入过量 Na₂CO₃固体
D
制备Fe(OH)₃胶体
向煮沸的 Fe₂(SO₄)₃溶液中滴加饱和 NaOH
条件
P/kPa
p
T/℃
T/℃
700
720
740
760
780
800
I
催化剂1,2 h
140
110
108
112
117
125
Ⅱ
催化剂2,2h
125
132
140
150
163
170
Ⅲ
催化剂2,∞h
140
150
163
172
180
185
重庆市南开中学高2024届高三年级第九次质量检测化学试题: 这是一份重庆市南开中学高2024届高三年级第九次质量检测化学试题,文件包含化学试卷pdf、化学试卷答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
重庆市南开中学高2024届高三第六次质量检测化学: 这是一份重庆市南开中学高2024届高三第六次质量检测化学,文件包含重庆市南开中学2023-2024学年高三下2月月考化学试题pdf、1_南开第六次联考-化学答案pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
2024届重庆市南开中学校高三上学期1月第五次质量检测化学试题: 这是一份2024届重庆市南开中学校高三上学期1月第五次质量检测化学试题,共9页。












