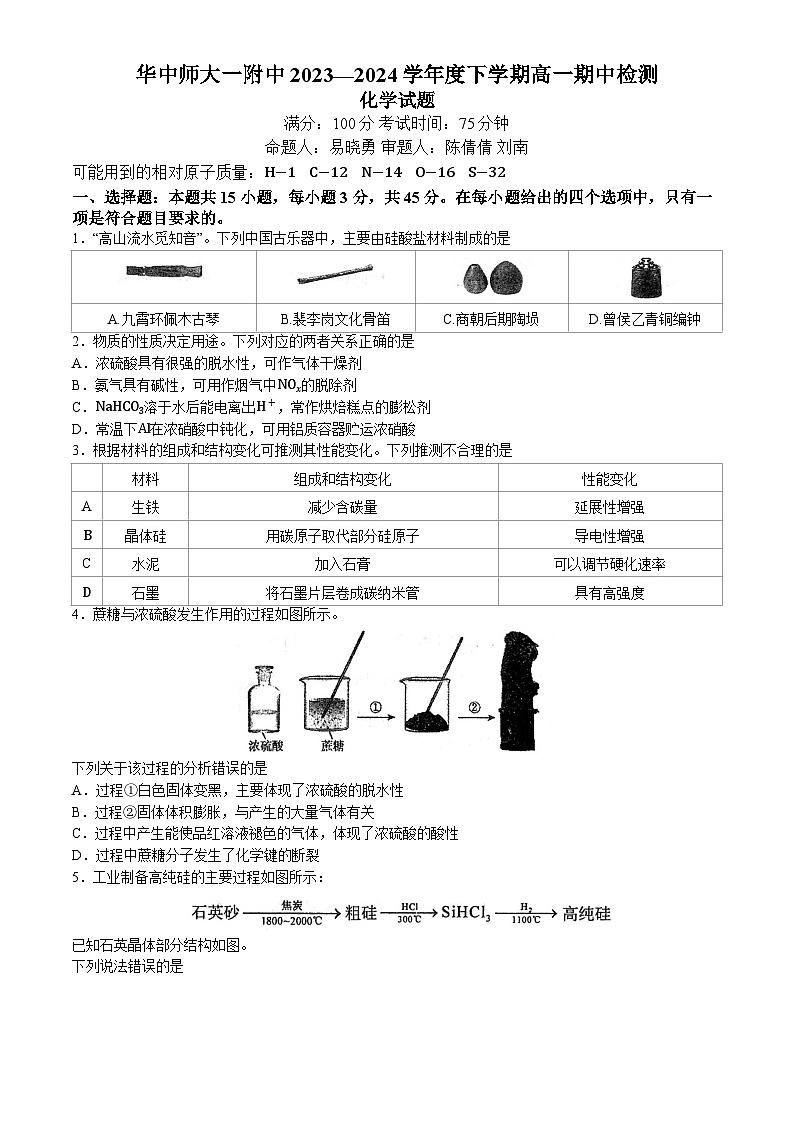

2024武汉华中师范大学第一附中高一下学期期中化学试题含答案
展开满分:100分 考试时间:75分钟
命题人:易晓勇 审题人:陈倩倩 刘南
可能用到的相对原子质量:H−1C−12N−14O−16S−32
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.“高山流水觅知音”。下列中国古乐器中,主要由硅酸盐材料制成的是
2.物质的性质决定用途。下列对应的两者关系正确的是
A.浓硫酸具有很强的脱水性,可作气体干燥剂
B.氨气具有碱性,可用作烟气中NOx的脱除剂
C.NaHCO3溶于水后能电离出H+,常作烘焙糕点的膨松剂
D.常温下Al在浓硝酸中钝化,可用铝质容器贮运浓硝酸
3.根据材料的组成和结构变化可推测其性能变化。下列推测不合理的是
4.蔗糖与浓硫酸发生作用的过程如图所示。
下列关于该过程的分析错误的是
A.过程①白色固体变黑,主要体现了浓硫酸的脱水性
B.过程②固体体积膨胀,与产生的大量气体有关
C.过程中产生能使品红溶液褪色的气体,体现了浓硫酸的酸性
D.过程中蔗糖分子发生了化学键的断裂
5.工业制备高纯硅的主要过程如图所示:
已知石英晶体部分结构如图。
下列说法错误的是
A.制备粗硅的反应体现了C元素的非金属性比Si强B.石英晶体中不存在SiO2分子
C.原料气HCl和H2应充分去除水和氧气D.流程中HCl、H2可以循环使用
6.根据实验操作及现象,下列结论中正确的是
7.化合物X3Y7WR和X3Z7WR所含元素相同,相对分子质量相差7,1mlX3Y7WR含40ml质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半。下列说法正确的是
A.原子半径:W>RB.非金属性:X>R
C.Y和Z互为同素异形体D.常温常压下X和W的单质均为固体
8.下列化学用语或图示表达正确的是
A.NaCl的电子式为Na:Cl⋅⋅⋅⋅:
B.NH3分子的结构模型为(平面三角形)
C.2pz电子云轮廓图为
D.基态24Cr原子的价层电子轨道表示式为
9.下列有关说法正确的是
A.电子云通常用小点的疏密来表示,小点密表示在该空间的电子数多
B.已知Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为4f5
C.Cu的核外电子排布为1s22s22p63s23p63d104s1,所以Cu处于s区
D.原子光谱的特征谱线用于鉴定元素,从1s22s22p33s1→1s22s22p4形成的是吸收光谱
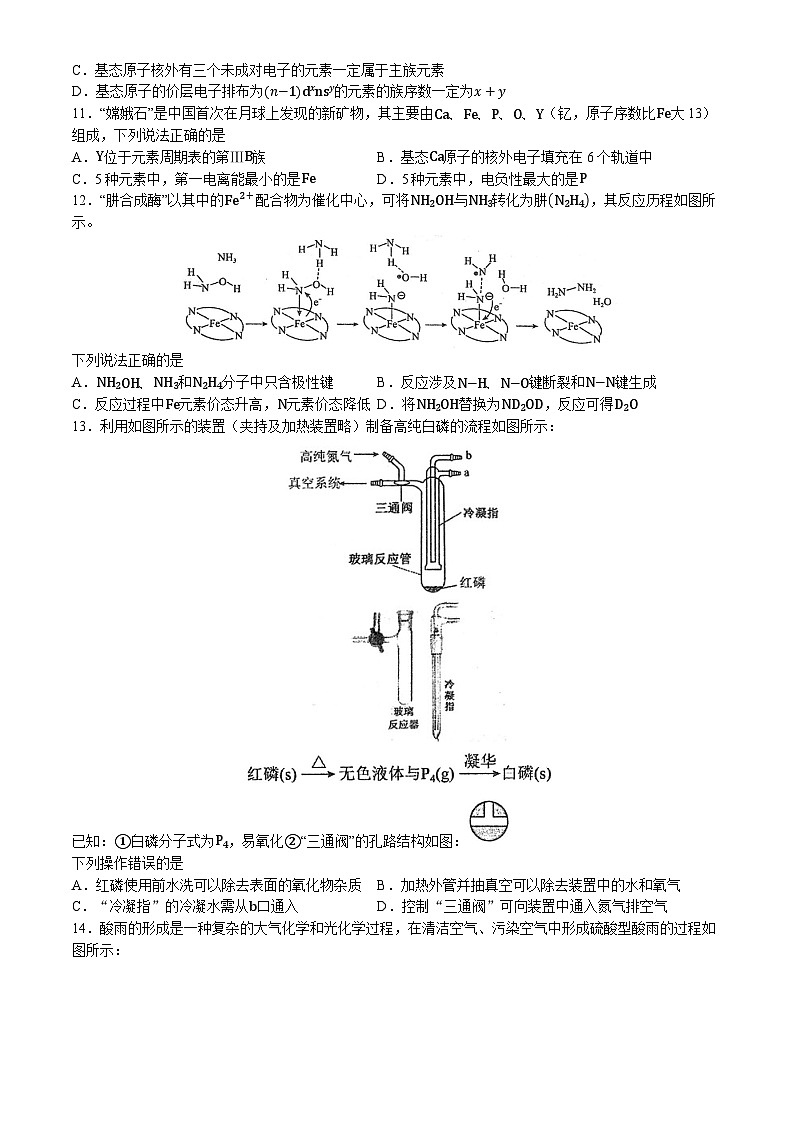
10.下列关于原子核外电子排布与元素在周期表中位置关系的表述中,正确的是
A.基态原子的N层上只有一个电子的元素,一定是ⅠA族元素
B.基态原子的价层电子排布式为n−1d6∼8ns2的元素一定是副族元素
C.基态原子核外有三个未成对电子的元素一定属于主族元素
D.基态原子的价层电子排布为n−1dxnsy的元素的族序数一定为x+y
11.“嫦娥石”是中国首次在月球上发现的新矿物,其主要由Ca、Fe、P、O、Y(钇,原子序数比Fe大13)组成,下列说法正确的是
A.Y位于元素周期表的第ⅢB族B.基态Ca原子的核外电子填充在6个轨道中
C.5种元素中,第一电离能最小的是FeD.5种元素中,电负性最大的是P
12.“肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼N2H4,其反应历程如图所示。
下列说法正确的是
A.NH2OH、NH3和N2H4分子中只含极性键B.反应涉及N−H、N−O键断裂和N−N键生成
C.反应过程中Fe元素价态升高,N元素价态降低D.将NH2OH替换为ND2OD,反应可得D2O
13.利用如图所示的装置(夹持及加热装置略)制备高纯白磷的流程如图所示:
已知:①白磷分子式为P4,易氧化②“三通阀”的孔路结构如图:
下列操作错误的是
A.红磷使用前水洗可以除去表面的氧化物杂质B.加热外管并抽真空可以除去装置中的水和氧气
C.“冷凝指”的冷凝水需从b口通入D.控制“三通阀”可向装置中通入氮气排空气
14.酸雨的形成是一种复杂的大气化学和光化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如图所示:
注:ℎv表示光照;⋅OH是羟基自由基,有强氧化性。
下列有关说法错误的是
A.所涉及的变化均为氧化还原反应B.上述气相氧化形成酸雨的必要条件是光照
C.⋅OH的生成加快了形成酸雨的速率D.SO2难以直接被O2氧化
15.硝酸工业常用碱溶液吸收废气中的NO、NO2气体。某实验小组将相同体积不同组成的废气分别通入到相同的足量NaOH溶液中充分吸收,测得生成的NO3−、NO2−两种离子的物质的量nml与废气中NO2的物质的量分数x[x=nNO2nNO+nNO2]变化关系如图所示(图中仅画出部分关系)。下列说法正确的是
A.参与反应的NaOH物质的量为2mlB.随x值增大,溶液中nNO3−+nNO2−增大
C.当0
16.(14分)已知A、B、C、D、E、F、G为元素周期表中前四周期元素,其原子序数依次增大。请根据下列信息,回答问题。
(1)请写出A元素与其他六种元素形成的18电子的分子的电子式 (写一种即可)。
(2)基态B原子中能量最高的电子,其电子云在空间有 个伸展方向,原子轨道呈 形。
(3)某同学根据上述信息,推断基态C原子的轨道表示式为,该同学所画的轨道表示式违背了 。
(4)请比较基态D、E原子的第一电离能大小I1D I1E(填“>”或“<”)。
(5)检验F元素的实验方法是 ,请用原子结构的知识解释该方法的原理: 。
(6)G位于元素周期表 族 区,基态原子价层电子轨道表示式为 。
17.(14分)某实验小组利用如图装置模拟古法制硫酸并进行SO2性质探究。
已知:①“绿矾”高温受热可完全分解得红棕色固体和气体混合物;
②SO2熔点−75.5∘C,沸点−10∘C;熔点16.8∘C,沸点44.8∘C。
请回答下列问题:
Ⅰ.制取硫酸:实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,用酒精喷灯高温加热绿矾。
(1)绿矾的化学式为 。
(2)使用石英玻璃管而不使用普通玻璃管的原因是 。
(3)B装置的作用是 和分离出 (填化学式)。
Ⅱ.探究SO2的性质:在装置C中先后加入同浓度同体积不同的钡盐溶液,控制食用油油层厚度一致、通入SO2流速一致。四次实验分别得到如表pH−t图:
(4)pH−t图中,用化学用语解释曲线①缓慢下降的原因 ;对比四组实验分析,④中发生反应 (写反应的离子方程式)使溶液酸性增强,NO3−化性增强,氧化SO2的速率加快。
(5)上述四次实验中有白色沉淀生成的是 (填编号)。
18.(13分)六氟锑酸锂Li[SbF6]可用作锂离子电池的电解质锂盐,一种以锑白Sb2O3为原料,制备LiSbF6工艺流程如图所示:
回答下列问题:
(1)请写出基态Sb原子价层电子排布式 。
(2)试剂a的化学式为 ;根据流程和元素周期律推断Sb2O3是 氧化物。
(3)“氧化”时,将溶液升至85∘C反应,温度不宜过高的原因是 ;写出“氧化”步骤反应的离子方程式 。
(4)“酸溶”步骤一般使用聚四氟乙烯设备,不能使用金属或陶瓷设备,其原因是 。
(5)“操作Ⅴ"步骤为 ;“过滤Ⅱ”所得的“母液”返回到 工序。
19.(14分)液相催化还原法可去除水体中的NO3−,其分步催化还原机理如图1所示。其他条件相同,不同pH时,反应1小时后NO3−化率和不同产物在总还原产物中所占的物质的量的百分比如图2所示。
(1)该液相催化还原法中所用的催化剂是 ,还原剂是 。
(2)反应ⅰ的离子方程式是 。
(3)研究表明,OH−在Pd表面与NO2−竞争吸附,会降低Pd吸附NO2−的能力,但对Pd吸附H的能力影响不大。
①随pH增大,N2和氨态氮在还原产物中的百分比均减小,原因是 ,导致反应ⅱ的化学反应速率降低。
②随pH减小,还原产物中nN2n氨态氮的变化趋势是 ,说明Pd表面吸附的NO2−和H的个数比变大,对反应 (用离子方程式表示)更有利。
(4)分析图2,使用该催化剂,通过调节溶液pH,可将NO3−可能多地转化为N2。其具体方法是 。
【参考答案】
华中师大一附中2023—2024学年度下学期高一期中检测
化学试题
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.C 2.D 3.B 4.C 5.A 6.C 7.A 8.C 9.B 10.B 11.A 12.B 13.D 14.A 15.D
二、非选择题:本题共4小题,共55分。
16.(1) 或或H:S⋅⋅⋅⋅:H(2分)
(2) 3(1分); 哑铃(1分)
(3) 泡利(不相容)原理(2分)
(4) >(1分)
(5) 焰色试验(1分); 基态原子的电子吸收能量后,会跃迁到较高的能级,电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将以光的形式释放能量(2分)
(6) ⅦB(1分); d(1分); (2分)
17.(1) FeSO4⋅7H2O(2分)
(2) 普通玻璃管受热易软化(2分)
(3) 将SO3与水蒸气冷凝制得硫酸(2分); SO2(2分)
(4) SO2+H2O⇌H2SO3⇌HSO3−+H+(2分); 2Ba2++2SO2+O2+2H2O=2BaSO4↓+4H+(2分)或2SO2+O2+2H2O=2SO42−+4H+
(5) ②③④(2分)
18.(1) 5s25p3(1分)
(2) LiOH(1分); 两性(1分)
(3) 温度过高,H2O2分解过多,原料利用率降低(2分); Li++SbOH4−+H2O285∘CLiSbOH6↓(2分)
(4) HF能腐蚀金属和陶瓷(2分)
(5) 蒸发浓缩、冷却结晶(2分); 操作Ⅴ(2分)
19.(1) Cu、Pd(2分); H2(2分)
(2) Cu+NO3−=NO2−+CuO(2分)
(3) ① Pd表面单位面积吸附的NO2−数目减小(2分)
② 增大(2分); 2NO2−+6Pd−H=Pd+N2↑+2H2O+2OH−(2分)(2NO2−+6H=N2↑+2H2O+2OH− 2NO2−+6Pd−H+2H+=Pd+N2↑+4H2O也给分)
(4) 先调节溶液的pH到12,待NO3−几乎完全转化为NO2−后,调节pH到4(2分)A.九霄环佩木古琴
B.裴李岗文化骨笛
C.商朝后期陶埙
D.曾侯乙青铜编钟
材料
组成和结构变化
性能变化
A
生铁
减少含碳量
延展性增强
B
晶体硅
用碳原子取代部分硅原子
导电性增强
C
水泥
加入石膏
可以调节硬化速率
D
石墨
将石墨片层卷成碳纳米管
具有高强度
实验操作及现象
结论
A
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象
稀硝酸的氧化性比浓硝酸强
B
取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓HNO3,仍有沉淀
此样品中含有SO42−
C
向盛有FeOH3和NiOOH的试管中分别滴加浓盐酸,盛NiOOH的试管中产生黄绿色气体
氧化性:NiOOH>FeOH3
D
向CuSO4溶液中通入H2S气体,出现黑色沉淀
酸性:H2S
相关信息
A
基态原子核外电子数和电子层数相等
B
基态原子的p电子数比s电子数少1
C
基态原子的第一至第四电离能分别是I1=738kJ⋅ml−1;I2=1451kJ⋅ml−1;I3=7733kJ⋅ml−1;I4=10540kJ⋅ml−1
D
基态原子在同周期元素中未成对电子最多
E
基态原子有2个未成对电子
F
是前四周期中电负性最小的元素
G
位于元素周期表的第七列
①已煮沸的BaCl2aq
②未煮沸的BaCl2aq
③已煮沸的BaNO32aq
④未煮沸的BaNO32aq
2024武汉华中师范大学第一附中高三上学期期中化学试题扫描版无答案: 这是一份2024武汉华中师范大学第一附中高三上学期期中化学试题扫描版无答案,共8页。
2024武汉华中师范大学第一附中高三上学期期中化学试题扫描版无答案: 这是一份2024武汉华中师范大学第一附中高三上学期期中化学试题扫描版无答案,共8页。
2023武汉华中师范大学第一附中高一上学期期末考试化学无答案: 这是一份2023武汉华中师范大学第一附中高一上学期期末考试化学无答案,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












