

所属成套资源:2024年高考押题预测卷:全国卷
2024年高考押题预测卷—化学(全国卷旧教材)(全解全析)
展开
这是一份2024年高考押题预测卷—化学(全国卷旧教材)(全解全析),共15页。试卷主要包含了设为阿伏加德罗常数的值,[化学——选修3等内容,欢迎下载使用。
(考试时间:50分钟 试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 Cl 35.5
7.生活中处处有化学,下列叙述正确的是
A.碳酸氢钠可做食品膨松剂
B.食用盐的碘元素来自于添加剂碘化钾
C.为防止薯片被挤碎,在其包装袋中充氧气
D.苯甲酸钠可作食品防腐剂是由于其具有酸性
【答案】A
【解析】A.碳酸氢钠受热能产生二氧化碳气体,故可做食品膨松剂,A正确;
B.食用盐的碘元素来自于添加剂碘酸钾,B错误;
C.充入氧气可能氧化食品而使食品变质,为防止薯片被挤碎,应在其包装袋中充入氮气,C错误;
D.苯甲酸钠可作食品防腐剂是由于其有杀菌、抑菌作用,D错误;
故选A。
8.设为阿伏加德罗常数的值。下列说法正确的是
A.1ml含有的共价键数为
B.1L溶液中含有总数为
C.标准状况下,11.2L含有的电子数大于
D.向盐酸溶液中通氨气至中性,的数目大于
【答案】C
【解析】A.根据N2H4的结构可知,1ml的N2H4中含有共价键的数目为, A选项错误;
B.氢硫酸是弱酸,电离程度小,1L溶液中含有总数远小于,B选项错误;
C.1个水分子含10个电子,标准状况下,11.2L不是气体、其物质的量远大于0.5ml,则含有的电子数大于,C选项正确;
D.溶液体积不知道,不能计算铵离子数目,D选项错误;
答案选C。
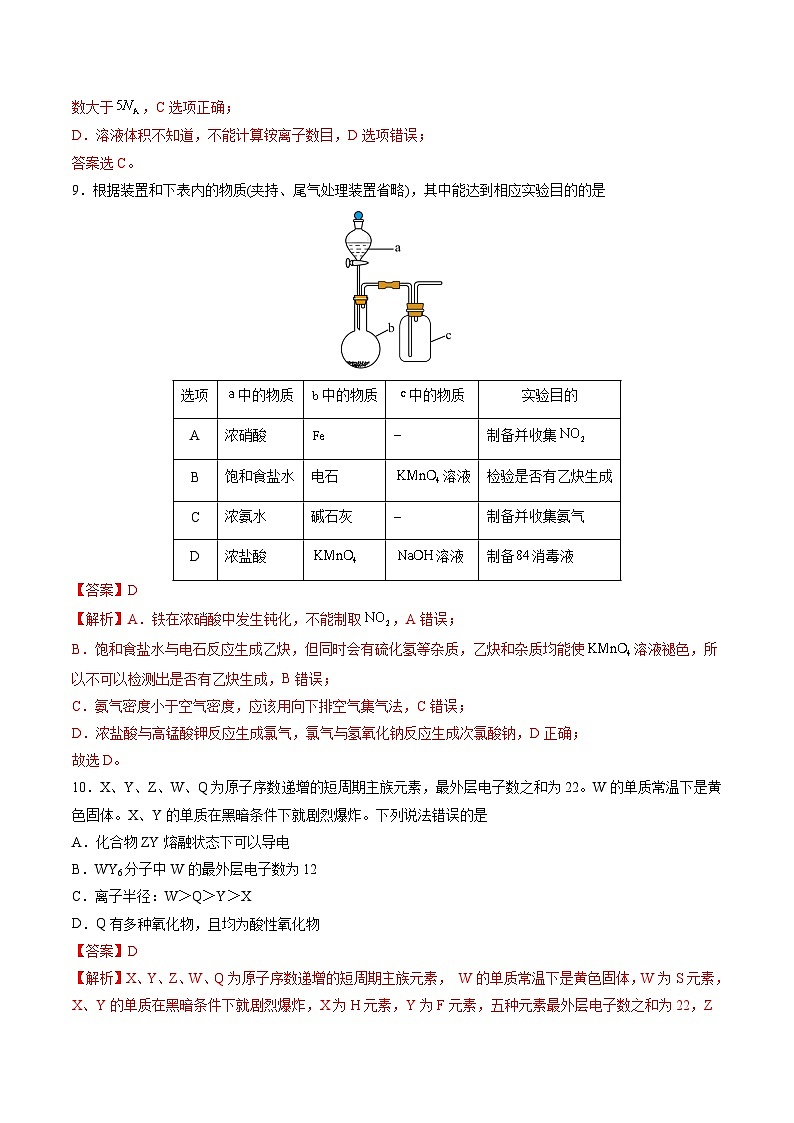
9.根据装置和下表内的物质(夹持、尾气处理装置省略),其中能达到相应实验目的的是
【答案】D
【解析】A.铁在浓硝酸中发生钝化,不能制取,A错误;
B.饱和食盐水与电石反应生成乙炔,但同时会有硫化氢等杂质,乙炔和杂质均能使溶液褪色,所以不可以检测出是否有乙炔生成,B错误;
C.氨气密度小于空气密度,应该用向下排空气集气法,C错误;
D.浓盐酸与高锰酸钾反应生成氯气,氯气与氢氧化钠反应生成次氯酸钠,D正确;
故选D。
10.X、Y、Z、W、Q为原子序数递增的短周期主族元素,最外层电子数之和为22。W的单质常温下是黄色固体。X、Y的单质在黑暗条件下就剧烈爆炸。下列说法错误的是
A.化合物ZY熔融状态下可以导电
B.WY6分子中W的最外层电子数为12
C.离子半径:W>Q>Y>X
D.Q有多种氧化物,且均为酸性氧化物
【答案】D
【解析】X、Y、Z、W、Q为原子序数递增的短周期主族元素, W的单质常温下是黄色固体,W为S元素,X、Y的单质在黑暗条件下就剧烈爆炸,X为H元素,Y为F元素,五种元素最外层电子数之和为22,Z和Q的最外层电子数之和为8,则Q为Cl,Z为Na,以此解答。
A.NaF是离子化合物,熔融状态下可以导电,A正确;
B.SF6分子中S形成6个共价键,最外层电子数为12,B正确;
C.离子电子层数越多,半径越大,电子层数相等时,核电荷数越大,半径越小,则离子半径:S2->Cl->F->H+,C正确;
D.ClO2中氯元素的化合价为+4价,不可能通过非氧化还原反应生成酸,故ClO2不属于酸性氧化物,D错误;
故选D。
11.下列实验方法或操作能达到实验目的的是
【答案】A
【解析】A.向1mL I2的CCl4溶液中加入1mL浓KI溶液,振荡试管,发现虽然I2在四氯化碳中溶解度更大,但是四氯化碳液体颜色变浅至无色,说明存在I2+I−⇌,使I2离开四氯化碳体系,A正确;
B.酸性高锰酸钾溶液可以与碳碳双键反应也可以和醛基反应,故加入适量酸性高锰酸钾溶液无法检验CH2=CHCHO中的碳碳双键,B错误;
C.比较Ka(CH3COOH)与Ka1(H2CO3)即比较CH3COOH与H2CO3酸性强弱,故应比较和CH3COONa溶液的pH,C错误;
D.向浓度均为0.1ml/LMgCl2和AlCl3溶液中滴加浓氨水至过量都得到白色沉淀,无法对比Mg和Al的金属性,D错误;
本题选A。
12.为了保护环境、充分利用铅资源,科学家设计了如下的-铅化合物燃料电池实现铅单质的回收。
下列有关说法错误的是
A.正极区溶液pH升高,负极区溶液pH降低
B.电子流向:电极b→负载→电极a
C.阴极区电极反应式为
D.为了提高的回收率,离子交换膜为阴离子交换膜
【答案】D
【解析】该装置为-铅化合物燃料电池,通入燃料氢气的电极b为负极,发生失电子的氧化反应,则电极a为正极,发生得电子的还原反应。
A.根据分析,负极氢气失电子、产生氢离子消耗氢氧根,pH降低,正极产生氢氧根离子,pH升高,A正确;
B.根据分析电极b为负极,电极a为正极,电子流向:电极b→负载→电极a,B正确;
C.根据题干信息,通过电化学装置实现铅单质的回收,阴极区电极反应式为,C正确;
D.离子交换膜应使用阳离子交换膜,防止移动至电极b,D错误;
答案选D。
13.已知室温时: 。化合物L与形成配合物(),的浓度随的投料百分比的变化如图所示(,表示初始浓度).
下列说法错误的是
A.
B.25℃时,的L溶液pH≈9
C.降低pH有利于的生成
D.的溶液中,
【答案】C
【解析】A.当,,,当投料比与方程式中系数一致时,产物浓度最大,即a=3,故A正确;
B.的,当c(L)=时,,即,,故B正确;
C.降低pH,平衡正向移动,c(L)减小,使得平衡逆向移动,不利于的生成,故C错误;
D.由A可知,a=3,的溶液中,由物料守恒可得:,即,故D正确;
故选C。
(一)必考题:共43分。
26.(14分)我国主要以型锂辉石(主要成分、、,含有、等杂质)为原料,通过硫酸锂苛化法生产氢氧化锂并制备锂离子电池的正极材料。流程如下:
已知:①不溶于水,能溶于强酸。
②部分金属氢氧化物的如下表。
③和的溶解度随温度变化的曲线如图所示,二者结晶时均以水合物形式析出。
回答如下问题:
(1)“球磨”操作的目的是 。
(2)加入石灰石中和残酸,调节pH使铁、铝等杂质完全沉淀,则pH至少为 。(保留一位小数。通常认为溶液中离子浓度小于为沉淀完全)
(3)滤渣2的成分是 。
(4)获得时,通常“冷冻至0℃”,原因是 。
(5)溶液与和混合溶液制备的化学方程式为 ;两种溶液相互滴加的方式不同会影响产率和纯度,有同学认为应该将和混合液滴加到溶液中,你认为是否合理
(填“是”或“否”),说明理由: 。
(6)需要在高温下成型后才能作为电极,高温成型时要加入少量石墨,则石墨的作用是 (任写一点)。
【答案】(除标明外,每空2分)
(1)增大反应接触面积,加快反应速率,使焙烧更充分(1分)
(2)4.7
(3)、
(4)此温度下的溶解度与的相差较大
(5) 否(1分) 碱性环境下会产生,继而氧化为从而影响产品产率和纯度
(6)改善成型后(或电极)的导电作用(或者与空气中的氧气反应,防止中的被氧化)
【解析】该工业流程原料为型锂辉石(主要成分、、,含有、等杂质),产品为锂离子电池的正极材料,流程主线中元素为锂元素,铝、硅、铁、镁等元素作为杂质元素在工业流程中被除去,型锂辉石通过“球磨”被粉碎,加入浓硫酸“酸化焙烧”转化为、、、、,“调浆浸出”使铝、铁等杂质元素转化为、等被除去,通过“净化除杂”使镁元素及引入的钙元素转化为、而除去,“蒸发结晶、离心分离”得到的硫酸锂溶液中加入,利用和在不同温度下的溶解度的差异,采用“冷冻至0℃”析出,从而得到溶液,经过一系列操作得到,最后与和混合溶液制备。
(1)型锂辉石通过“球磨”被粉碎,从而增大与浓硫酸反应的接触面积,加快反应速率,使焙烧更充分;
故答案为:增大反应的接触面积,加快反应速率,使焙烧更充分;
(2)调节pH使铁、铝等杂质完全沉淀,的大于的,说明更难溶于水,加入石灰石与水调节pH时,先生成,故完全沉淀时也已完全沉淀,利用的计算完全沉淀时,,则,故;
故答案为:4.7;
(3)“净化除杂”工艺中得到滤渣2,该过程加入调节pH为11,使完全转化为沉淀除去,加入使前一工艺中引入的转化为沉淀而除去故滤渣2的成分是、;
故答案为:、;
(4)“冷冻析钠”过程是利用和在不同温度下的溶解度的差异,采用“冷冻至0℃”析出,从而得到溶液,在该温度下,溶解度较小,与的溶解度相差较大;
故答案为:在该温度下,溶解度较小,与的溶解度相差较大;
(5)根据流程转化可知,与和混合溶液制备,反应中元素化合价未发生变化,为非氧化还原反应,根据元素守恒,可推知其余生成物为、,故化学反应方程式为;
溶液为碱性溶液,将和混合液滴加到溶液中,由于开始时溶液过量,会生成沉淀,进一步被氧化为,从而影响产品的纯度和产率,故这种操作不合理;
故答案为:;否;碱性环境下会产生,继而氧化为从而影响产品产率和纯度;
(6)作正极电极材料,石墨本身可以导电,故少量石墨可以改善成型后的导电作用,中铁元素为+2价,具有还原性,可以被氧气氧化,加入少量石墨可以与空气中的氧气反应,防止中的被氧化;
故答案为:改善成型后(或电极)的导电作用(或者与空气中的氧气反应,防止中的被氧化)。
27.(14分)硫脲[CS(NH2)2]是一种白色晶体,熔点180℃,易溶于水和乙醇,受热时部分发生异构化反应而生成硫氰化铵。回答下列问题:
Ⅰ.硫脲的制备:
将石灰氮(CaCN2)溶液加热至80℃时,通入气体反应可生成溶液和石灰乳。某小组同学连接装置进行模拟实验。
(1)检查装置气密性的操作为① ,在装置F中加水至浸没导管末端;②微热装置A处三颈烧瓶,观察到装置F处导管末端有气泡冒出,移走酒精灯;③一段时间后,装置F处导管末端形成一段水柱,且高度不变。
(2)装置A中的试剂最佳组合是 (填字母)。
A.固体浓硫酸 B.固体稀硝酸 C.固体稀盐酸
(3)装置B中的试剂名称为 。装置E的作用为 。
(4)装置D中反应温度控制在80℃,温度不宜过高或过低的原因是 ,装置D中反应的化学方程式为 。
Ⅱ.硫脲的分离及产品含量的测定:
(5)反应后将装置D中的液体过滤,将滤液减压蒸发浓缩,当有 现象时停止加热,冷却结晶,离心分离,烘干即可得到产品。
(6)称取mg产品,加水溶解配成溶液,量取于锥形瓶中,滴加一定量的酸化,用标准溶液滴定,初始读数为,当滴入最后半滴溶液时,溶液颜色 ,且半分钟无变化时达到滴定终点,标准溶液读数为。已知:。(硫脲的相对分子质量为76),样品中硫脲的质量分数为 %(用含m、c、、的式子表示)。
【答案】(除标明外,每空2分)
(1)关闭、、
(2)C
(3)饱和硫氢化钠溶液(1分) 防倒吸(1分)
(4)温度过高,硫脲会部分发生异构化反应而生成硫氰化铵;温度过低,反应速率缓慢
(5)出现一层晶膜或有晶膜出现(1分)
(6)由无色变为浅紫色或浅红色或(紫)红色(1分)
【解析】固体与盐酸在装置A中反应生成H2S,生成的H2S中混有盐酸挥发出的HCl气体,经饱和NaHS溶液除杂后,通入装置D中与石灰氮(CaCN2)溶液加热至80℃,反应生成溶液;为避免有多余的H2S气体逸出污染空气,装置末端需连接尾气处理装置;
(1)检查装置气密性的操作:①关闭、、,在装置F中加水至浸没导管末端;②微热装置A处三颈烧瓶,观察到装置F处导管末端有气泡冒出,移走酒精灯;③一段时间后,装置F处导管末端形成一段水柱,且高度不变;
(2)浓硫酸和稀硝酸均具有氧化性,会将S元素氧化,无法生成H2S气体,所以应选固体稀盐酸药品组合;
(3)根据分析可知,装置B中的试剂名称:饱和硫氢化钠溶液;装置E的作用:防倒吸;
(4)装置D中反应温度不宜过高或过低的原因温度过高,硫脲会部分发生异构化反应而生成硫氰化铵;温度过低,反应速率缓慢;
(5)反应后将装置D中的液体过滤,将滤液减压蒸发浓缩,当有出现一层晶膜现象时停止加热,冷却结晶,离心分离,烘干即可得到产品;
(6)可被酸性高锰酸钾氧化,到达滴定终点,滴入最后半滴溶液时,溶液颜色由无色变为浅紫色或浅红色或(紫)红色;滴定过程消耗酸性高锰酸钾物质的量:,根据反应计量数,物质的量:,样品中硫脲的质量分数:。
28.(15分)人类利用二氧化碳合成淀粉对社会的发展起着重要作用,合成过程首先是利用二氧化碳制备甲醇,合成甲醇的反应为 。回答下列问题:
(1)已知:
① ;
② ;
③a、b均为大于零的数,且a>b。
(用含a、b的式子表示)。某研究小组设计合成的路线及的部分应用如图所示,图中熔融碳酸盐燃料电池的正极电极反应式为 。
(2)研究合成甲醇的催化剂时,在其他条件不变仅改变催化剂种类的情况下,对反应器出口产品进行成分分析,结果如图所示。在以上催化剂中,该反应应选择的最佳催化剂为 。
(3)在研究该反应历程时发现:反应气中水蒸气含量会影响的产率。为了研究水分子对该反应机制的内在影响,我国学者利用计算机模拟,研究添加适量水蒸气前后对能垒较大的反应历程能量变化的影响(如图所示,吸附在催化剂表面的物种用*标注)。
①依反应历程图所示,写出有水参与时反应的化学方程式: 。
②结合图3及学过的知识推测,有水参与的历程,反应速率加快的原因是 。
(4)在T℃时,将6ml (g)和12ml (g)充入容积为10L的恒容容器中,只发生,初始压强为 kPa,测得体系中剩余(g)的物质的量随时间变化如图中状态Ⅰ所示。
①T℃时,0~1min内甲醇的反应速率 ,该反应的平衡常数 。(用平衡分压代替平衡浓度计算,列出计算式)
②保持投料量不变,仅改变某一个条件后,测得随时间变化如图中状态Ⅲ所示,与状态Ⅰ相比,状态Ⅲ改变的条件可能是 。
【答案】(除标明外,每空2分)
(1)
(2)
(3) 有水参与的历程,活化能较小,反应速率加快
(4)0.2 升高温度(1分)
【解析】(1)根据方程式可知其等于已知反应①加上反应②,由盖斯定律可求得;图中燃料电池以熔融碳酸盐为电解质,氧气进入正极,正极电极反应式为;
(2)根据据分析,催化剂为得到的甲醇最多且CO少,该反应应选择的最佳催化剂为;
(3)依反应历程图所示,有水参与时反应的化学方程式为:有水参与的历程,反应速率加快的原因是有水参与的历程,活化能较小,反应速率加快;
(4)从图中可知,1min时H2的物质的量为6ml,起始的H2的物质的量为12ml,变化的H2的物质的量为6ml,故变化的甲醇的物质的量为2ml,0~1min内甲醇的反应速率v(CH3OH)=根据图示,8min后H2的物质的量保持不变,体系达到平衡状态,H2的物质的量为2ml,根据题意有,平衡时候总的物质的量,,,该反应的平衡常数Kp==;状态Ⅲ与状态Ⅰ相比,H2的物质的量增加,参与反应的氢气的物质的量减少,平衡逆向移动,同时从图中可知达到平衡的时间变短,该反应是一个放热反应,综合可知改变的条件可能是升高温度。
(二)选考题:共15分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
Si、S、Se在自然界中形成多种多样的物质结构。回答下列问题:
(1)Se与O同族,电负性较大的是 ;基态Se原子的价电子运动状态有 种。
(2)已知液态的二氧化硫可以发生类似水的自电离:。中各原子满足8电子结构,则其键和键数目之比为 ,的空间结构为 。
(3)有一种观点认为:由于硅的价层有可以利用的空d轨道,而碳没有,因此两者化合物结构和性质存在较大差异。化合物和的结构如图所示,为平面形,二者中N的杂化方式分别为 ,二者中更易与形成配位键的是 。
(4)Se与Si均为非金属元素,熔点(>1700℃)明显高于(315℃),原因是 。
(5)-硒为六方晶胞结构,原子排列为相互平行的螺旋长链(如图1),沿着螺旋链方向的晶胞投影图如图2。-硒六方晶胞参数为、、(其中),a轴与b轴间夹角为120°,c轴垂直于a轴与b轴,阿伏加德罗常数的值为。
相邻链间的作用力为 。晶胞中含有Se原子的数目为 ;则-硒晶胞的摩尔体积为 (列出算式)。
【答案】(除标明外,每空2分)
(1)O(1分) 6(1分)
(2)1:2(1分) 三角锥形(1分)
(3)sp3 、sp2 N(CH3)3
(4)为共价晶体,为分子晶体,共价晶体的熔点高于分子晶体的熔点
(5)范德华力(1分) 3(1分) (3分)
【解析】(1)Se与O同族,也是第ⅥA族,同主族从上往下电负性在减小,因此电负性较大的是O;Se的最外层为6个电子,基态Se原子价层电子的运动状态有6种,故答案为:O;6。
(2)与互为等电子体,结构与相似,化学键为三键,σ键和π键数目之比为1:2;中心原子S原子的价层电子对数为:,采用杂化,有一对孤电子对,因此为三角锥形,故答案为:1:2;三角锥形。
(3)由图像可知,为三角锥形,中心原子N原子为杂化,为平面形三角形,中心原子N原子为杂化;因为有孤电子对,所以更易形成配合物,故答案为:sp3 、sp2;N(CH3)3。
(4)由于为共价晶体,为分子晶体,共价晶体的熔点高于分子晶体的熔点,故答案为:为共价晶体,为分子晶体,共价晶体的熔点高于分子晶体的熔点。
(5)同一条链内原子作用很强,相邻链之间原子作用较弱,所以相邻链之间原子作用为范德华力;由晶胞的俯视图可知,把俯视图中三个硒原子看成是一个整体,则一个晶胞中硒原子的个数为:;晶胞的摩尔体积为,故答案为:范德华力;3;。
36.[化学——选修5:有机化学基础](15分)
W是一种抗肿瘤药物,其合成路线如下图所示,回答下列问题(部分反应条件已略去)。
已知:“”代表乙基;“”代表N,N—二甲基甲酰胺。
(1)化合物A的分子式为 。
(2)由D转化为E的反应类型为 ,化合物G中含氧官能团的名称为 。
(3)化合物B中手性碳原子有 个。
(4)写出由F生成G的化学方程式 。
(5)A的同分异构体有多种,其中满足下列条件的同分异构体有 种(考虑立体异构)。
①与A含有相同的官能团,“”与苯环直接相连 ②苯环上有2个取代基
写出核磁共振氢谱有4组峰,且峰的面积之比为的结构简式 。
(6)写出和合成的路线(无机试剂任选)。
已知:能与酯基反应;在催化下,能将硝基转化为氨基。
【答案】(除标明外,每空2分)
(1)
(2)还原反应(1分) 醚键、酰胺基(1分)
(3)2
(4)
(5)8
(6)(3分)
【解析】观察A和B的结构可以看出A与溴单质在CHCl3的条件下发生加成反应得到了B,B经过在DMF条件下与Et3N反应生成C,对比C和D的结构,C的支链断了碳溴键和碳氢键,支链由碳碳双键转变成碳碳三键,对比D与E的结构,发生变化的是苯环上的硝基转化成氨基,生成既去氧又加氢,发生了还原反应;F与HCONH2在催化剂作用下发生反应生成G,对比G和H的结构可以看出发生反应的部分是G中的酮羰基;最后E和H取代反应生成了W。
(1)由的结构简式可以得出分子式是。
(2)对比和的结构简式可知,生成既去氧又加氢,在有机反应中有机物加氢或去氧发生的是还原反应,故该反应属于还原反应;观察的结构简式可知,中的含氧官能团有醚键和酰胺基。
(3)如图所示(),“*”处的碳原子为手性碳原子,有2个手性碳原子。
(4)对比和的结构简式可知,1分子在反应过程中脱去了1个“”和2个“”,1分子脱去1个“”和1个“”,这些脱下的基或原子可组成1个和1个,据此写出化学方程式为:;
(5)根据题意可知符合条件的同分异构体中,除了苯环外,还可能含有如下3组结构。①“”和“”;②“”和“”;③“”和“”,每组结构在苯环上有邻、间、对三种位置,共组合出9种物质,去掉本身,则符合条件的的同分异构体有8种。
核磁共振氢谱有4组峰,且峰的面积之比为的结构简式为。
(6)对比反应物和所合成产物的结构,需要在的苯环上与酯基相连碳原子的邻位增加含有氮原子的侧链,再与然后成环,再结合生成物的环状结构与F到G的反应成环流程,推断出合成的前一步中间产物应该是,再结合在催化下,能将硝基转化为氨基,推断可以得到前一步的中间产物是,由发生硝化反应可以得到,所以可以得出和合成路线为:
评卷人
得分
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
选项
中的物质
中的物质
中的物质
实验目的
A
浓硝酸
−
制备并收集
B
饱和食盐水
电石
溶液
检验是否有乙炔生成
C
浓氨水
碱石灰
−
制备并收集氨气
D
浓盐酸
溶液
制备消毒液
实验目的
实验方法或操作
A
在水溶液中存在
向的溶液中加入浓溶液,振荡试管,观察颜色变化
B
检验中的碳碳双键
取样,加入适量酸性高锰酸钾溶液后观察是否褪色
C
比较与
常温,测浓度均为的和溶液的
D
比较Mg和Al的金属性强弱
向浓度均为和溶液中滴加浓氨水至过量
评卷人
得分
二、非选择题:共58分,第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,考生根据要求作答。
物质
相关试卷
这是一份2024年高考押题预测卷—化学(全国卷新教材01)(全解全析),共13页。
这是一份2024年高考押题预测卷—化学(辽宁卷03)(全解全析),共19页。试卷主要包含了考试结束后,将答题卡交回等内容,欢迎下载使用。
这是一份2024年高考押题预测卷—化学(辽宁卷02)(全解全析),共19页。试卷主要包含了考试结束后,将答题卡交回,下列实验方案能达到实验目的的是等内容,欢迎下载使用。









