
第39练 电解原理应用新拓展 同步练习(含答案)-2025年高考化学一轮复习
展开A.电极b为阴极,发生还原反应
B.电解总反应方程式:Ce2O3+8H+eq \(=====,\s\up7(通电))2Ce4++3H2O+H2↑
C.离子交换膜为阴离子交换膜
D.X可以是H2SO4溶液
2.(2021·海南,9)液氨中存在平衡:2NH3NHeq \\al(+,4)+NHeq \\al(-,2)。如图所示为电解池装置,以KNH2的液氨溶液为电解液,电解过程中a、b两个惰性电极上都有气泡产生。下列有关说法正确的是( )
A.b电极连接的是电源的负极
B.a电极的电极反应式为2NH3+2e-===H2↑+2NHeq \\al(-,2)
C.电解过程中,阴极附近K+浓度减小
D.理论上两极产生的气体物质的量之比为1∶1
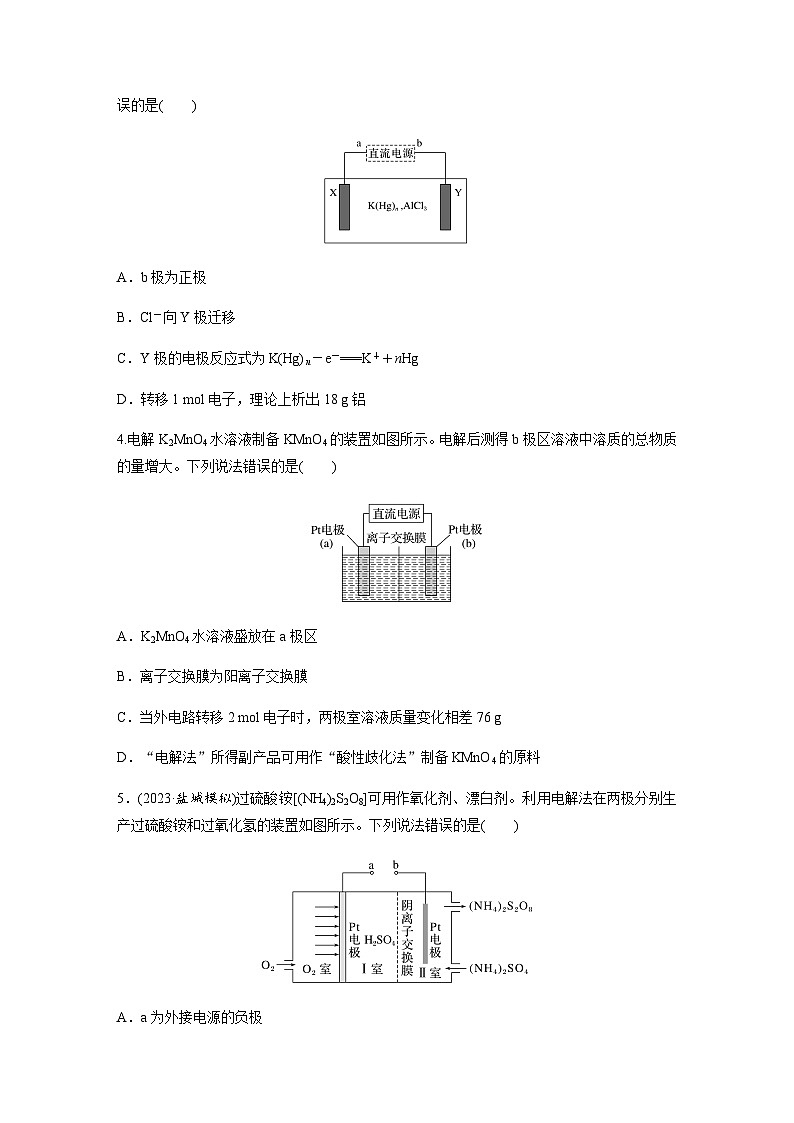
3.(2023·南通模拟)1825年丹麦化学家奥斯特用电解法以钾汞齐还原无水氯化铝得到铝,从而发现了铝。模拟装置如图所示(电极为惰性材料)。已知:电子由a极流向X极。下列说法错误的是( )
A.b极为正极
B.Cl-向Y极迁移
C.Y极的电极反应式为K(Hg)n-e-===K++nHg
D.转移1 ml电子,理论上析出18 g铝
4.电解K2MnO4水溶液制备KMnO4的装置如图所示。电解后测得b极区溶液中溶质的总物质的量增大。下列说法错误的是( )
A.K2MnO4水溶液盛放在a极区
B.离子交换膜为阳离子交换膜
C.当外电路转移2 ml电子时,两极室溶液质量变化相差76 g
D.“电解法”所得副产品可用作“酸性歧化法”制备KMnO4的原料
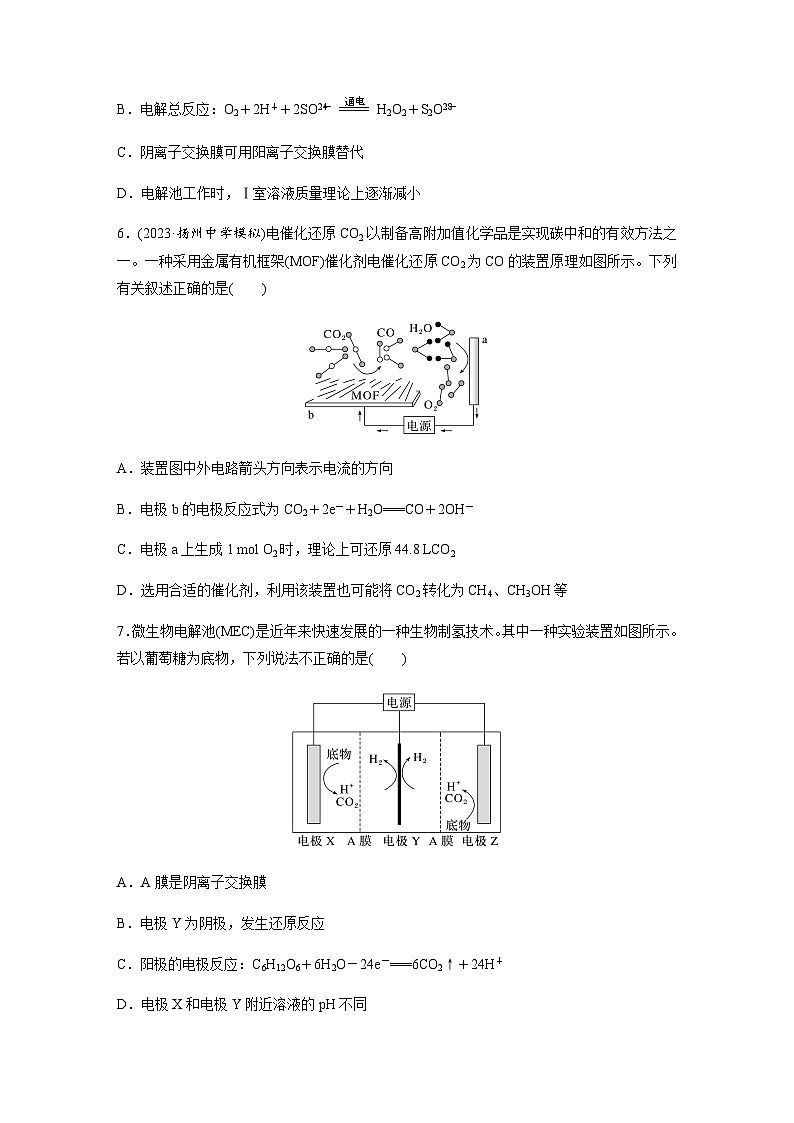
5.(2023·盐城模拟)过硫酸铵[(NH4)2S2O8]可用作氧化剂、漂白剂。利用电解法在两极分别生产过硫酸铵和过氧化氢的装置如图所示。下列说法错误的是( )
A.a为外接电源的负极
B.电解总反应:O2+2H++2SOeq \\al(2- ,4)eq \(=====,\s\up7(通电))H2O2+S2Oeq \\al(2-,8)
C.阴离子交换膜可用阳离子交换膜替代
D.电解池工作时,Ⅰ室溶液质量理论上逐渐减小
6.(2023·扬州中学模拟)电催化还原CO2以制备高附加值化学品是实现碳中和的有效方法之一。一种采用金属有机框架(MOF)催化剂电催化还原CO2为CO的装置原理如图所示。下列有关叙述正确的是( )
A.装置图中外电路箭头方向表示电流的方向
B.电极b的电极反应式为CO2+2e-+H2O===CO+2OH-
C.电极a上生成1 ml O2时,理论上可还原44.8 LCO2
D.选用合适的催化剂,利用该装置也可能将CO2转化为CH4、CH3OH等
7.微生物电解池(MEC)是近年来快速发展的一种生物制氢技术。其中一种实验装置如图所示。若以葡萄糖为底物,下列说法不正确的是( )
A.A膜是阴离子交换膜
B.电极Y为阴极,发生还原反应
C.阳极的电极反应:C6H12O6+6H2O-24e-===6CO2↑+24H+
D.电极X和电极Y附近溶液的pH不同
8.氯气是一种重要的工业原料,在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新工艺方案,如图所示。下列说法正确的是( )
A.电极A发生还原反应:O2+4e-+4H+===2H2O
B.电极B与外接电源的负极相连
C.电解时,电流经电极B、电解质溶液流向电极A
D.当有2 ml电子转移时,两室溶液中H+数目理论上相差4NA
9.(2023·宿迁模拟)利用电解池原理可将CO2转化为燃料或者化学品。如图通过将CO2与辛胺反应耦合,实现了两电极体系中产物的高选择性合成。下列说法正确的是( )
A.装置中b电极为阴极,发生还原反应
B.电极a的电极反应可能为CO2+H2O+2e- ===HCOO-+OHeq \\al(-, )
C.中间的离子交换膜一定是质子交换膜
D.电解过程中,a、b两极反应物物质的量之比为2∶1
10.科学家采用电渗析法提纯乳清(富含NaCl的蛋白质),有价值的蛋白质回收率达到98%,工作原理如图所示:
下列说法错误的是( )
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.膜1、膜2孔径不大于半透膜孔径
C.a极的电极反应式为2H2O+2e-===2OH-+H2↑
D.每转移2 ml电子,理论上乳清质量减少58.5 g
11.羟基自由基(·OH)具有极强的氧化能力,它能有效地氧化降解废水中的有机污染物。在直流电源作用下,利用双极膜电解池产生羟基自由基(·OH)处理含苯酚废水和含甲醛废水,原理如图所示。已知:双极膜中间层中的H2O解离为H+和OH-。下列说法错误的是( )
A.M极为阴极,电极反应式:O2+2e-+2H+===2·OH
B.双极膜中H2O解离出的OH-透过膜a向N极移动
C.每处理6.0 g甲醛,理论上有0.4 ml H+透过膜b
D.通电一段时间后,理论上苯酚和甲醛转化生成CO2物质的量之比为6∶7
12.工业上用电解法治理亚硝酸盐对水体的污染,模拟工艺如图所示,写出电解时铁电极发生的电极反应:__________________________________________________________。
随后,铁电极附近有无色气体产生,写出有关反应的离子方程式:________________________________________________________________________
________________________________________________________________________。
13.工业上用PbSiF6、H2SiF6混合溶液作电解液,用电解法实现粗铅(主要杂质为Cu、Ag、Fe、Zn,杂质总质量分数约为4%)提纯,装置示意图如图1所示。
(1)电解产生的阳极泥的主要成分为________,工作一段时间后,溶液中c(Pb2+)__________(填“增大”“减小”或“不变”)。
(2)铅的电解精炼需要调控好电解液中的c(H2SiF6)。其他条件相同时,测得槽电压(槽电压越小,对应铅产率越高)随起始时溶液中c(H2SiF6)的变化趋势如图2所示。由图可推知,随c(H2SiF6)增大,铅产率先增大后减小,减小的原因可能是____________________________________________________________________________
____________________________________________________________________________。
14.电催化还原CO2是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原CO2的装置示意图如图1所示。控制其他条件相同,将一定量的CO2通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图2所示。
(1)电解前需向电解质溶液中持续通入过量CO2的原因是________________________。
(2)控制电压为0.8 V,电解时转移电子的物质的量为__________ml。
(3)科研小组利用13CO2代替原有的CO2进行研究,其目的是________________________________________________________________________
________________________________________________________________________。
第39练 电解原理应用新拓展
1.C [由图可知,与直流电源正极相连的电极a为阳极,酸性条件下三氧化二铈在阳极失去电子发生氧化反应生成铈离子和水,电极b为阴极,氢离子在阴极得到电子发生还原反应生成氢气,则X为硫酸溶液,铈离子通过阳离子交换膜由阳极室移向阴极室,电解的总反应方程式为Ce2O3+8H+eq \(=====,\s\up7(通电))2Ce4++3H2O+H2↑。]
2.B [根据图示可知,在b电极上产生N2,N元素失去电子化合价升高,所以b电极为阳极,连接电源的正极,A错误;a电极上产生H2,a电极为阴极,电极反应式为2NH3+2e-===H2↑+2NHeq \\al(-,2),B正确;电解过程中,K+会向阴极区定向移动,最终导致阴极附近K+浓度增大,C错误;每产生1 ml H2,转移2 ml电子,每产生1 ml N2,转移6 ml电子,故阴极产生的H2与阳极产生的N2的物质的量之比是3∶1,D错误。]
3.D [在电解装置中,电子由电源的负极流入阴极,所以a极为负极,X极为阴极,Y极为阳极,b极为正极,A正确;在电解池中,阴离子向阳极(Y极)迁移,B正确;Y极上钾汞齐发生氧化反应,C正确;析出1 ml铝时转移3 ml电子,即转移1 ml电子理论上析出9 g Al,D错误。]
4.C [电解K2MnO4水溶液制备KMnO4,阳极反应为MnOeq \\al(2-,4)-e-===MnOeq \\al(-,4),阴极反应为2H2O+2e-===H2↑+2OH-,K+向阴极移动,使KOH物质的量增大,所以b极为阴极,a极为阳极;当外电路转移2 ml电子时,有2 ml K+移向阴极,生成1 ml H2,阴极质量增大(39×2-2)g=76 g,阳极质量减少2×39 g=78 g,两极室溶液质量变化相差154 g,C错误。]
5.C [由(NH4)2SO4→(NH4)2S2O8,氧元素化合价升高被氧化,故右侧Pt电极为阳极,b为外接电源正极,a为外接电源负极,左侧Pt电极为阴极。阴极氧气被还原,阳极硫酸根离子被氧化,电解总反应正确,B正确;根据阳极产物可知,反应需要消耗硫酸根离子,阴离子交换膜不可用阳离子交换膜替代,C错误;电解池工作时,Ⅰ室发生反应:O2+2e-+2H+===H2O2,同时SOeq \\al(2-,4)移向阳极,故Ⅰ室溶液质量理论上逐渐减小,D正确。]
6.D [分析图像可知,电极a上发生的是H2O的氧化反应:2H2O-4e-===O2↑+4H+,电极a为阳极,接电源的正极,电极b接电源的负极,则电流方向为电源正极→电极a→电极b→电源负极,故A错误;电极b为阴极,发生的是CO2的还原反应:CO2+2e-+2H+===CO+H2O,故B错误;根据得失电子守恒可得关系式:O2~4e-~2CO2,若生成1 ml O2,则可还原2 ml CO2,其体积在标准状况下为44.8 L,但题中未注明气体所处状况,故C错误;不同的催化剂具有不同的选择性,使用合适的催化剂,利用该装置也可能将CO2还原为CH4、CH3OH等,故D正确。]
7.A [A膜允许氢离子通过,是阳离子交换膜,故A错误;电极Y上是氢离子得电子生成氢气,是阴极,发生还原反应,故B正确;阳极底物失去电子生成二氧化碳和氢离子,电极反应:C6H12O6+6H2O-24e-===6CO2↑+24H+,故C正确。]
8.C [由图分析,B极反应为2Cl--2e-===Cl2↑,发生氧化反应,为电解池的阳极,与电源正极相连。A为电解池的阴极,发生还原反应,Fe3+变为Fe2+,Fe2+再经O2氧化变回Fe3+。A极电极反应为Fe3++e-===Fe2+,A项错误;电极B为电解池的阳极,与电源正极相连,B项错误;电流从正极流出经电极B、再由电解质溶液流经电极A,再到负极,C项正确;A极区发生的反应为4Fe2++O2+4H+===2H2O+4Fe3+,该反应中每转移2 ml电子需要消耗
2 ml H+,同时,电解池工作时,每转移2 ml电子,有2 ml H+从B极经质子交换膜流向A极,即A极H+没有发生变化,而B极由于H+移走而减少了2 ml,所以两极H+数目相差2NA,D项错误。]
9.B [a极为阴极,CO2转化为燃料或者化学品,b极为阳极,辛胺转化为辛腈。装置中b电极为阳极,失去电子,发生氧化反应,故A错误;电极a为阴极,电极反应可能为CO2+H2O+2e- ===HCOO-+OH-,故B正确;若电解液为中性时,中间的离子交换膜是质子交换膜,若电解液为碱性时,中间的离子交换膜是阴离子交换膜,故C错误;电解过程中,a极CO2转化为燃料或者化学品,b极辛胺转化为辛腈,由于电极a的产物不确定,则两极反应物物质的量之比不确定,故D错误。]
10.D [a极区的稀氢氧化钠溶液变为浓氢氧化钠溶液,说明a极区生成了氢氧化钠,即钠离子通过膜1向a极区迁移,膜1为阳离子交换膜;同理,氯离子通过膜2向b极区迁移,膜2为阴离子交换膜,A项正确;提纯蛋白质,不能让蛋白质(胶体粒子)通过膜1、膜2,所以膜1、膜2的孔径应不大于半透膜的孔径,B项正确;a极为阴极,发生还原反应:2H2O+2e-===2OH-+H2↑,C项正确;每转移2 ml电子,结合电极反应和电荷守恒可知,理论上乳清减少的质量为2 ml NaCl的质量,即质量减少117 g,D项错误。]
11.C [M电极通入O2,发生反应生成自由基·OH,反应式为O2+2e-+2H+===2·OH,M作阴极,A正确;N为阳极,电解时阴离子向阳极移动,所以OH-透过膜a向N极移动,B正确;1 ml甲醛生成1 ml CO2转移4 ml电子,1 ml 苯酚生成6 ml CO2转移28 ml电子,理论上苯酚和甲醛转化生成CO2物质的量之比为6∶7,D正确。]
12.Fe-2e-===Fe2+ 2NOeq \\al(-,2)+8H++6Fe2+===N2↑+6Fe3++4H2O
解析 根据电解原理,阳离子向阴极移动,由装置图可知,A为电源的正极,B为电源的负极,铁作阳极,电极反应式为Fe-2e-===Fe2+;NOeq \\al(-,2)在酸性条件下具有强氧化性,能将
Fe2+氧化,本身被还原成N2,其反应的离子方程式为2NOeq \\al(-,2)+8H++6Fe2+===N2↑+6Fe3++4H2O。
13.(1)Cu、Ag 减小 (2)c(H2SiF6)增大,电解液中c(H+)增大,阴极发生副反应:2H++
2e-===H2↑,影响Pb2+放电,使铅产率减小
解析 (1)粗铅中的Cu、Ag活泼性比Pb差,故电解产生的阳极泥的主要成分为Cu和Ag;阳极上溶解的金属有Pb、Fe、Zn,阴极上析出的金属只有Pb,两极上得失电子守恒,故工作一段时间后,溶液中Pb2+浓度有所下降。
14.(1)使阴极表面尽可能被CO2附着,减少析氢反应的发生(减少氢离子在阴极上放电的几率),提高含碳化合物的产率
(2)2.8 (3)为确定阴极上生成的含碳化合物源自CO2而非有机多孔电极材料
解析 (2)控制电压为0.8 V,产生0.2 ml氢气和0.2 ml乙醇,根据电极反应2H++2e-===H2↑,2CO2+12e-+12H+===C2H5OH+3H2O,故电解时转移电子的物质的量为0.4 ml+2.4 ml=2.8 ml。
高考化学二轮复习小题提速练13电解原理及应用含答案: 这是一份高考化学二轮复习小题提速练13电解原理及应用含答案,共8页。试卷主要包含了1,5-戊二胺等内容,欢迎下载使用。
高考化学二轮复习小题提速练13电解原理及应用含答案: 这是一份高考化学二轮复习小题提速练13电解原理及应用含答案,共8页。试卷主要包含了1,5-戊二胺等内容,欢迎下载使用。
高考化学二轮复习小题提速练13电解原理及应用含答案: 这是一份高考化学二轮复习小题提速练13电解原理及应用含答案,共8页。试卷主要包含了44MnO2-xe-Na0等内容,欢迎下载使用。












