

还剩4页未读,
继续阅读
广东省广州市2023年中考化学押题卷
展开这是一份广东省广州市2023年中考化学押题卷,共7页。试卷主要包含了5 Fe 56,9g等内容,欢迎下载使用。
满分90分 测试时间:75分钟
相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 S 32
Cl 35.5 Fe 56
一、选择题(本大题共14题,每小题3分,满分42分,在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列广州美食中富含蛋白质的是( )
A.清蒸鲫鱼B.白灼菜心C.拔丝红薯D.陈村河粉
2.人类生存离不开空气,下列关于空气的说法正确的是( )
A.空气中形成酸雨的气体是二氧化碳
B.空气能分离出用作燃料的氢气
C.空气中的氮气是制造氮肥的重要原料
D.空气中的稀有气体可用于急救病人
3.2019年12月以来,湖北省武汉市发现多起病毒性肺炎病例,2020年1月2日,世界卫生组织正式将造成武汉肺炎疫情的新型冠状病毒命名为“2019 新型 冠状病毒(2019﹣nCV)”。该病可防可控,下列防控方法属于化学变化的是( )
A.外出佩戴N95口罩
B.活性炭净化饮用水
C.开窗通风保持室内空气流通
D.75%浓度酒精杀灭细菌繁殖
4.下列材料不属于有机合成材料的是( )
A.用于制造医用脱脂棉的棉花
B.用于制成服装的涤纶
C.用于制造炊具手柄的酚醛塑料
D.用作不粘锅内衬的四氟乙烯
5.2019年3月22日是第26届“世界水日”主题为“Nature fr water”。下列关于水的说法正确的是( )
A.将肥皂水加入氯化钙溶液中振荡,产生大量浮渣
B.珠江水经过沉淀、过滤、吸附、杀菌消毒等物理净化方法可得到自来水
C.为了保护水资源,禁止使用化肥和农药
D.电解水得到氢气与氧气的质量比为2:1
6.下列对实验现象的描述正确的是( )
A.将打磨过的镁条放入盛有氧气的集气瓶中,剧烈燃烧,发出耀眼白光,生成白色固体
B.铁锈在稀盐酸里浸泡一段时间后,铁锈消失,溶液变为浅绿色
C.氯化钡溶液滴加到氢氧化钠溶液中,出现白色沉淀
D.将用来制作鞋子的羊皮灼烧,有烧焦羽毛的气味
7.下列关于化学与生活说法正确的是( )
A.AB.BC.CD.D
8.根据下列实验方案进行实验,能达到相应实验目的的是( )
A.实验室制取氢气
B.称量NaOH固体
C.除去二氧化碳中的水蒸气
D.测定空气中氧气含量
9.我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是( )
A.反应前后分子的总数不变
B.反应每消耗28g甲,可生成44g丙
C.反应前后各元素的化合价没有发生改变
D.反应过程中,每消耗1个甲分子,同时消耗1个乙分子
10.氢氧化钙在生产和生活中有广泛的用途,下列关于氢氧化钙的认识错误的是( )
A.组成:氢氧化钙溶液中含有Ca2+和OH﹣
B.性质:氢氧化钙溶液能与CO2、SO3 等非金属氧化物反应
C.用途:氢氧化钙可用来配制波尔多液
D.生产:含氢氧化钙的废水用适量的Na2CO3溶液处理后直接排放
11.除去下列物质中混有的少量杂质所选用的操作方法,正确的是( )
A.AB.BC.CD.D
12.硝酸钾的溶解度曲线如图所示,从图中获取的信息正确的是( )
A.10℃时,100g硝酸钾的饱和溶液含有溶质约20.9g
B.硝酸钾的溶解度随温度的升高而减小
C.降低温度一定能使不饱和的硝酸钾溶液变成饱和溶液
D.60℃时,将40g KNO3固体溶解在100g水中,降温到20℃时有晶体析出
13.下列图象能正确表示对应叙述的有( )
A.向一定量硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
B.向一定量的饱和氢氧化钙溶液中加入氧化钙
C.等质量、等质量分数的稀盐酸中分别加入锌和铁
D.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液
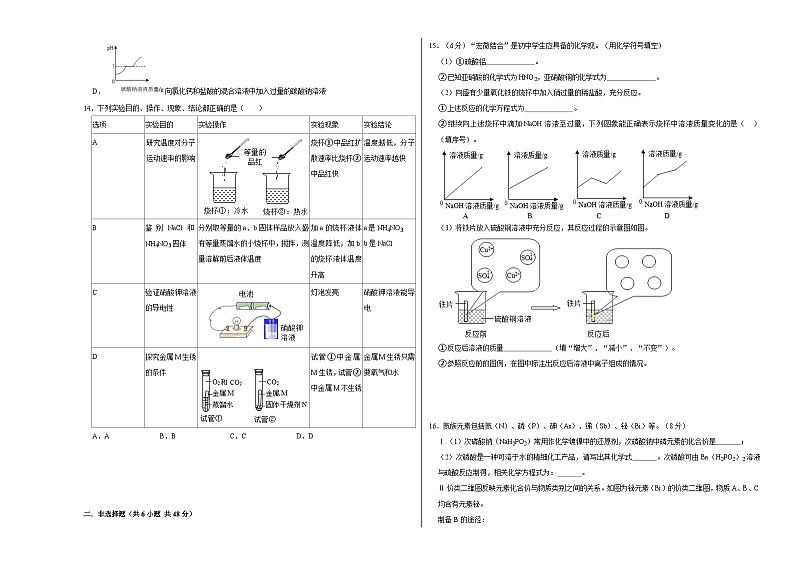
14.下列实验目的、操作、现象、结论都正确的是( )
A.AB.BC.CD.D
二.非选择题(共6小题 共48分)
15.(6分)“宏微结合”是初中学生应具备的化学观。(用化学符号填空)
(1)①硫酸铝 。
②已知亚硝酸的化学式为HNO2,亚硝酸铜的化学式为 。
(2)向盛有少量氧化铁的烧杯中加入稍过量的稀盐酸,充分反应。
①上述反应的化学方程式为 。
②继续向上述烧杯中滴加NaOH溶液至过量,下列图象能正确表示烧杯中溶液质量变化的是( ) (填序号)。
(3)将铁片放入硫酸铜溶液中充分反应,其反应过程的示意图如图。
①反应后溶液的质量 (填“增大”、“减小”、“不变”)。
②参照反应前的图例,在图中标注出反应后溶液中离子组成的情况。
16.氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi)等。(8分)
Ⅰ.(1)次磷酸钠(NaH2PO2)常用作化学镀镍中的还原剂,次磷酸钠中磷元素的化合价是 ;
(2)次磷酸是一种可溶于水的精细化工产品,请写出其化学式 。次磷酸可由Ba(H2PO2)2溶液与硫酸反应制得,相关化学方程式为: 。
Ⅱ.价类二维图反映元素化合价与物质类别之间的关系。如图为铋元素(Bi)的价类二维图,物质A、B、C均含有元素铋。
制备B的途径:
途径一:向硝酸铋溶液中滴加某溶液,充分混合,一定条件下可生成白色沉淀C,将C加热,脱水可得物质B。
途径二:物质A在氧气流中,加热可制得物质B。
请结合铋元素的价类二维图及制备B的两种途径回答相关问题:
(1)途径一,为得到沉淀C,应向硝酸铋溶液加入 (填物质类别)溶液;由C生成B化学方程式为 。
(2)途径二,写出由A生成B的化学方程式为 。
17.(8分)某固体物质可能含有CuO、FeCl3、BaCl2、Na2SO4、CuSO4、Na2CO3、NaOH中的一种或多种,为了确定其组成,进行如下实验:
(1)步骤③中溶液的红色褪去,发生反应的化学方程式是: 。
(2)分析上述实验过程,关于样品的组成,可以得到的结论是: 。
(3)若要进步确定样品的组成,需进行的实验操作是: 。
①取少量 (从A﹣D中挑选)。
②加入的试剂是 。
18.(8分)硫酸是重要的化工原料,也是实验室中常用的化学原料。
(1)实验室要配制420g质量分数为7%的稀硫酸溶液。
①配制上述溶液需要质量分数为98%浓硫酸(密度1.84g/cm3)的质量为 g。
②量取上述所需浓硫酸要用到的仪器是 (填标号)。
A.10mL量筒
B.20mL量筒
C.试管
D.胶头滴管
③稀释浓硫酸时一定要 ,并用玻璃棒不断搅拌。
实验室常用稀硫酸与锌粒反应制取氢气。
①反应的化学方程式为 。
②要制取并收集干燥的氢气,需要选择的装置组合顺序是 (填字母)。
(3)用上述配好的稀硫酸再稀释10倍后与某浓度的氢氧化钠溶液进行中和滴定反应。
①实验开始时,向氢氧化钠溶液滴入几滴酚酞溶液,其作用是 。
②如图2是稀硫酸与氢氧化钠溶液进行中和反应时,测得烧杯中溶液pH的变化曲线,下列说法正确的是 。
A.由a点到b点的pH变化证明酸和碱发生了中和反应
B.a点对应溶液的溶质是Na2SO4
C.c点对应溶液呈碱性
D.该实验是将氢氧化钠溶液滴入稀硫酸中
19.(10分)以菱锌矿[主要成分是ZnCO3(质量分数67%)、杂质为Fe2O3(质量分数15%)、FeO(质量分数8%)、CuO(质量分数10%)]为原料制备七水硫酸锌(ZnSO4•7H2O),同时得到铁红副产品,其工艺流程如图,回答下列问题:
(1)“堆浸”前将菱锌矿粉粹成细颗粒,其目的是 。
(2)若实验室用质量分数为98%的浓硫酸配制490g质量分数为50%的稀硫酸,需要加入蒸馏水的质量为 g,需要用到的玻璃仪器有胶头滴管、玻璃棒、烧杯和 ,此处玻璃棒的作用是 。
(3)检验物质X已过量的方法是 (写明操作现象结论)。
(4)“氧化”中加入H2O2的目的是在硫酸的作用下将溶液中的FeSO4转化成Fe2(SO4)3,反应的化学方程式: 。
(5)流程中获得七水硫酸锌(ZnSO4•7H2O)前省略的操作是 、过滤、洗涤和低温烘干。
(6)已知菱锌矿质量为m,理论上可生产ZnSO4•7H2O的质量为 。
(7)除铁过程中,反应温度、溶液pH对除铁效果均有影响,为探究除铁的最佳效果,某同学做了以下的实验并记录了相关数据,请回答问题:
①对比实验b和实验c,得到的结论为 。
②表中Y的值可能为 (填编号)。
A.93.4
B.94.1
C.97.8
D.99.6
③根据以上数据,最佳的除铁条件为 。
20.(8分)高纯颗粒状无水硫酸钠(Na2SO4)俗称为元明粉,十水合硫酸钠晶体(Na2SO4•10H2O)又名芒硝,广泛应用于玻璃、瓷釉、纸浆、洗涤剂和医药等领域。
(1)根据你所学的知识,Na2SO4能与 (填物质类别)反应,验证的实验操作与预期现象是:取少量Na2SO4溶液于试管中, 。
(2)工业上制备硫酸钠的方法有:
①滩田法:夏季将含有氯化钠、硫酸钠、硫酸镁、氯化镁等成分的咸水灌入滩田,经日晒蒸发,冬季析出粗芒硝。此法是从天然资源中提出芒硝的主要方法,工艺简单,能耗低,但作业条件差,产品中易混入泥砂等杂质。
②机械冷冻法:利用机械设备将原料液加热蒸发后冷冻至﹣5~﹣10℃时析出芒硝。与滩田法比较,此法不受季节和自然条件的影响,产品质量好,但能耗高。
根据上述事实和所学过的知识,请你推测可以使用上述方法制备硫酸钠的原因是 。
(3)依据各类物质之间的反应规律,另设计两种可以在实验室中制备Na2SO4的方案(要求依据两种不同的反应规律),完成如表:
A.化肥
用熟石灰可以鉴别氮肥硝酸铵和钾肥硫酸钾;
通过外观不能区分磷肥和钾肥
B.安全
烧炭取暖时,房间放一盆水可防CO中毒;
用明火检查液化气罐是否漏气
C.生活
儿童需补钙是因为缺乏微量元素钙;
糖类、油脂、蛋白质和水都是营养素
D.环保
垃圾要分类投放;
废弃塑料带来“白色污染”
选项
物质
操作方法
A
CO2混有HCl气体
将气体通过足量NaOH溶液
B
Cu(NO3)2溶液混有NaCl
加入过量氢氧化钠,过滤,洗涤滤渣后向滤渣中加入适量稀硝酸
C
NaCl溶液混有CaCl2
加入过量Na2CO3溶液、过滤
D
CuO混有碳粉
加入适量稀HCl,过滤,洗涤,干燥
选项
实验目的
实验操作
实验现象
实验结论
A
研究温度对分子运动速率的影响
烧杯①中品红扩散速率比烧杯②中品红快
温度越低,分子运动速率越快
B
鉴别NaCl和NH4NO3固体
分别取等量的a、b固体样品放入盛有等量蒸馏水的小烧杯中,搅拌,测量溶解前后液体温度
加a的烧杯液体温度降低,加b的烧杯液体温度升高
a是NH4NO3
b是NaCl
C
验证硝酸钾溶液的导电性
灯泡发亮
硝酸钾溶液能导电
D
探究金属M生锈的条件
试管①中金属M生锈,试管②中金属M不生锈
金属M生锈只需要氧气和水
编号
反应温度/℃
溶液pH
除铁率/%
a
30
2
91.5
b
30
2.5
93.3
c
40
2.5
95.1
d
40
3.1
Y
e
50
3.1
99.5
方案
原料1
原料2
预期反应的化学方程式
依据的反应规律
①
CuSO4溶液
盐与碱反应生成新盐和新碱,生成物中有沉淀
②
相关试卷
2024年广东省深圳市中考化学押题卷:
这是一份2024年广东省深圳市中考化学押题卷,共8页。
2020-2021学年广东省中考化学押题卷及答案解析(一):
这是一份2020-2021学年广东省中考化学押题卷及答案解析(一),共22页。
2020-2021学年广东省中考化学押题卷及答案解析(三):
这是一份2020-2021学年广东省中考化学押题卷及答案解析(三),共15页。












