
专题八 构成物质的微粒 认识化学元素——初中化学复习检测
展开这是一份专题八 构成物质的微粒 认识化学元素——初中化学复习检测,共12页。试卷主要包含了下列物质中含有氧分子的是,下列说法正确的个数是,下列物质是由原子直接构成的是等内容,欢迎下载使用。
A.端午时节,粽叶飘香——分子总是在不断运动着
B.蔗糖放入水中溶解——蔗糖分子分解了
C.氧气和液氧都能支持燃烧——构成物质的分子相同,其化学性质相同
D.水壶中的水烧开沸腾后,壶盖被顶起——水分子间的间隔增大
2.构成下列物质的微粒与构成的微粒种类相同的是( )
A.HeB.CuC.D.NaCl
3.下列物质中含有氧分子的是( )
①空气
②二氧化碳
③高锰酸钾
④辽河水
⑤液氧
⑥稀有气体
A.①②⑤B.②③④C.①④⑤D.①④⑥
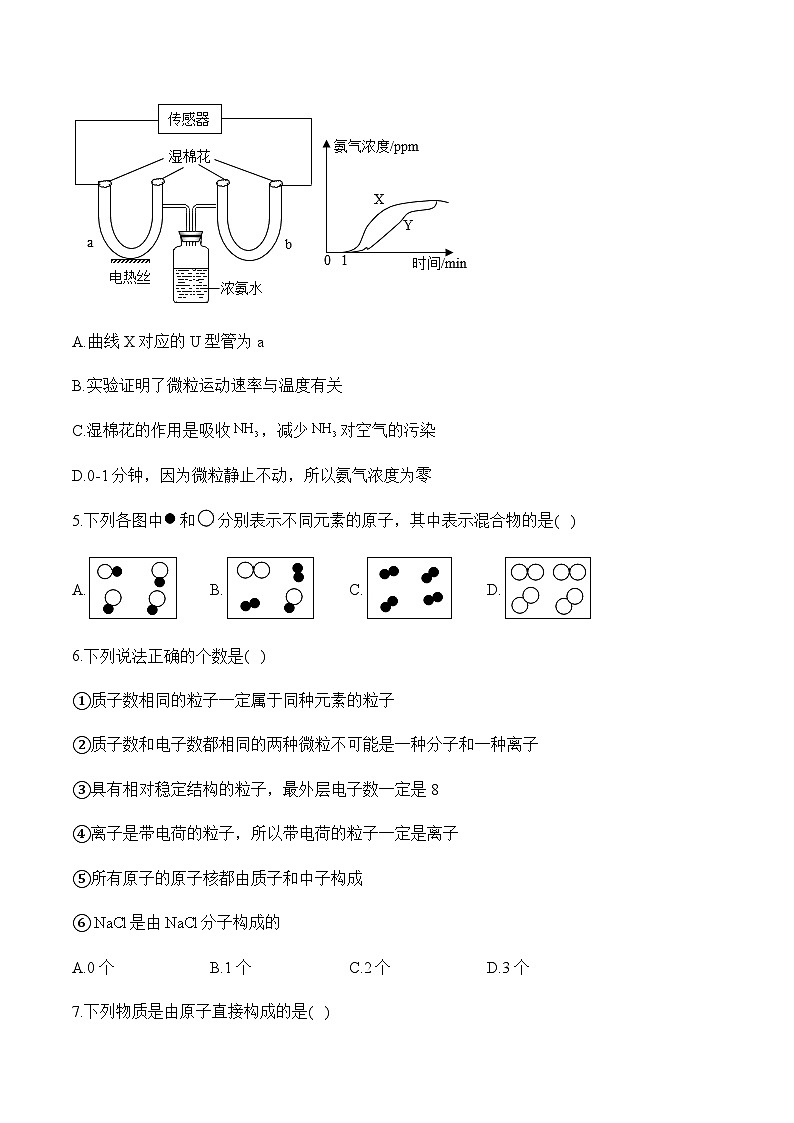
4.某同学为了探究微粒性质,按图示进行实验,并借助传感器测得U型管a、b中氨气浓度随时间变化的曲线。下列关于该实验的说法错误的是( )
A.曲线X对应的U型管为a
B.实验证明了微粒运动速率与温度有关
C.湿棉花的作用是吸收,减少对空气的污染
D.0-1分钟,因为微粒静止不动,所以氨气浓度为零
5.下列各图中和分别表示不同元素的原子,其中表示混合物的是( )
A.B.C.D.
6.下列说法正确的个数是( )
①质子数相同的粒子一定属于同种元素的粒子
②质子数和电子数都相同的两种微粒不可能是一种分子和一种离子
③具有相对稳定结构的粒子,最外层电子数一定是8
④离子是带电荷的粒子,所以带电荷的粒子一定是离子
⑤所有原子的原子核都由质子和中子构成
⑥是由分子构成的
A.0个B.1个C.2个D.3个
7.下列物质是由原子直接构成的是( )
A.氯气B.氯化氢C.氯化钠D.金刚石
8.元素X的核电荷数为a,它的阳离子与元素Y的阴离子的电子层结构相同,则元素Y的核电荷数是( )
A.a+m+nB.a-m-nC.m+n-aD.m-n-a
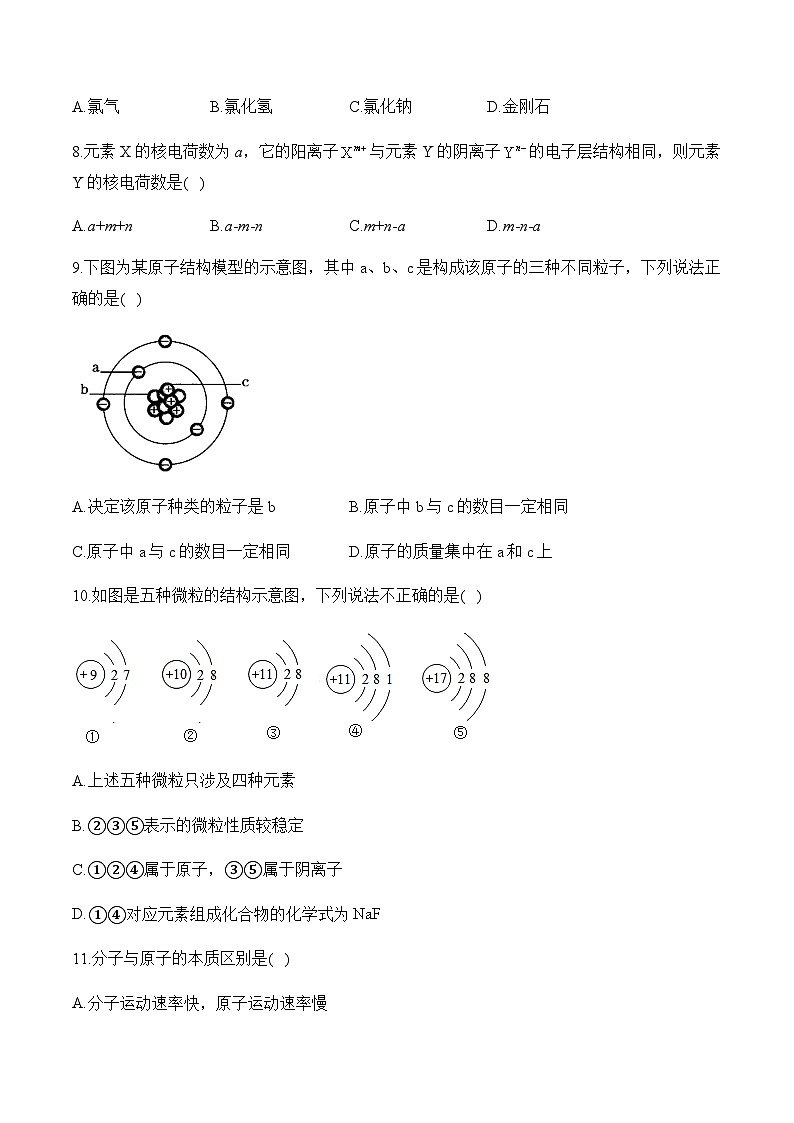
9.下图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是bB.原子中b与c的数目一定相同
C.原子中a与c的数目一定相同D.原子的质量集中在a和c上
10.如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为
11.分子与原子的本质区别是( )
A.分子运动速率快,原子运动速率慢
B.分子可以构成物质而原子不可以直接构成物质
C.分子大,原子小
D.在化学变化中,分子可以再分而原子不可再分
12.下列物质中,由离子构成的是( )
A.铜B.氦气C.氯化钠晶体D.金刚石
13.下列关于分子、原子、离子的说法中不正确的是( )
A.离子是带电的粒子,所以带电的粒子一定是离子
B.在化学反应中,分子可分成原子,而原子却不能再分
C.分子、原子、离子都是构成物质的基本粒子
D.分子、原子不显电性,而离子显电性
14.磷灰石陶瓷性质优良,可制造人造骨和人造假牙。这里的“磷”指的是( )
A.原子B.分子C.元素D.单质
15.地壳中含量最多的元素是( )
A.硅B.氧C.铁D.铝
16.元素符号“Fe”不能表示的意义是( )
A.铁元素B.一个铁原子C.铁这种物质D.铁分子
17.元素观是化学的重要观念之一,下列有关元素的说法中正确的是( )
A."含氟牙膏"中的"氟"指的不是元素,而是物质
B.Ne原子和NH3中所含的质子数相同,所以属于同种元素
C.物质发生化学变化时,原子的种类不变,元素的种类也不会改变
D.同种元素的原子核内质子数与中子数一定相等
18.发光二极管(简称LED)技术,已广泛用于照明、显像等多个领域,氮化镓()是LED中的重要原料。氮和镓的原子结构示意图及镓在元素周期表中的信息如图所示,下列说法不正确的是( )
A.氮元素位于第二周期,属于非金属元素
B.镓的质子数和核电荷数均为31
C.镓原子与镓离子的相对原子质量几乎相等
D.一个有34个电子
19.如果一个碳12原子的相对原子质量从12变为24,则下列选项会改变的是( )
A.氧原子的相对原子质量
B.一个碳-12原子的质量
C.一个硫酸分子的质量
D.10克二氧化碳所含的分子个数
20.关于、、三种粒子的判断,正确的是( )
①核电荷数相同
②核外电子数相同
③质量几乎相等
④化学性质相同
⑤等质量的三种粒子所含的质子数相等
⑥属于同种元素
A.①②④⑤ B.①③⑤⑥ C.①③④⑥ D.①④⑤
21.元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
1.请从上表中查出地壳中含量最多的金属元素的相对原子质量为__________。
2.表中不同种元素最本质的区别是_______。
A.相对原子质量不同
B.质子数不同
C.中子数不同
3.元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如: 。
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
4.元素周期表中,原子序数为12的镁元素的原子结构示意图如图所示,该原子在化学反应中易__________(填“得到”或“失去”)电子。说明元素的化学性质与原子的__________关系密切。
答案以及解析
1.答案:B
解析:A、端午时节,粽叶飘香,是因为粽子中含有的分子是在不断运动的,向四周扩散,使人们闻到粽香,故选项解释正确。B、蔗糖放入水中溶解,是因为蔗糖分子是在不断运动的,运动到水分子中间去了,故选项解释错误。C、氧气和液氧都能支持燃烧,是因为它们是由氧分子构成的,同种的分子化学性质相同,故选项解释正确。D、水壶中的水烧开沸腾后,壶盖被顶起,是因为温度升高,水分子间的间隔变大,故选项解释正确。故选:B。
2.答案:C
解析:A、He代表氮气,是由氦原子构成的,不符合题意;B、Cu代表铜,属于金属,由铜原子构成,不符合题意;C、代表二氧化碳,由二氧化碳分子构成,符合题意;D、NaCl代表氯化钠,由离子构成,不符合题意。故选:C。
3.答案:C
解析:①空气含有氧气,故含有氧分子;②二氧化碳是由二氧化碳分子构成,不含氧分子;③高锰酸钾是纯净物,含氧元素不含氧分子;④辽河水中溶解了一部分氧气,故含有氧分子;⑤液氧即氧气的液态故含有氧分子;⑥稀有气体不含氧分子;故①④⑥含氧分子,故选:C。
4.答案:D
解析:A、浓氨水具有挥发性,挥发出的氨分子不断运动,且温度越高,氨分子运动的越快,相同时间内,a中氨气浓度高,故曲线X对应的U型管为a,不符合题意;
B、该实验的变量是温度,且相同时间内,a中氨气浓度高,说明微粒运动速率与温度有关,温度越高,微粒的运动速率越快,不符合题意;
C、氨气散逸到空气中,会污染空气,氨气极易溶于水,故湿棉花的作用是吸收,减少对空气的污染,不符合题意;
D、微粒总是在不断运动,0-1分钟,氨气浓度为零,可能是此时氨分子没有运动到传感器处,符合题意。
故选D。
5.答案:B
解析:A.该图示中含有一种分子,是纯净物,故A错误;B.该图示中含有三种分子,是混合物,故B正确;C.该图示中含有一种分子,是纯净物,故C错误;D.该图示中含有一种分子,是纯净物,故D错误。故选:B。
6.答案:B
解析:①元素是质子数(核电荷数)相同的一类原子的总称,但质子数相同的粒子不一定属于同种元素的粒子,如例如水分子和氖原子,错误;
②分子不显电性,离子带正电荷或负电荷,故质子数和电子数都相同两种微粒不可能是一种分子和一种离子,正确;
③具有稳定结构的粒子,最外层电子数不一定是8,例如氦原子最外层电子数为2,错误;
④离子是带电荷的粒子,带电荷的粒子不一定是离子,例如质子带正电荷,错误;
⑤不是所有原子的原子核都是由质子和中子构成,例如有些氢原子中不含中子,错误;
⑥是由钠离子和氯离子构成的,错误。
故选B。
7.答案:D
解析:A、氯气由氯气分子构成;
B、氯化氢由氯化氢分子构成;
C、氯化钠由钠离子和氯离子构成;
D、金刚石是碳单质,由碳原子构成;
故选D。
8.答案:B
解析:设元素Y的核电荷数是b,因为X的核电荷数为a,它的阳离子,所以它的离子中带有(a-m)个电子,因为阳离子与元素Y的阴离子电子层结构相同,即核外电子数相同,所以b=a-m-n,即b=a-m-n。
故选:B。
9.答案:C
解析:本题采用图示分析法解答。首先分析原子结构模型图可知,a带负电荷,为核外电子,b不带电,为中子,c带正电荷,为质子。质子数决定原子的种类,故决定原子种类的是c而不是b,A错误;原子中质子数一定等于核外电子数,但质子数不一定等于中子数,故B错误,C正确;原子的质量主要集中在原子核上,核外电子的质量可忽略不计,即原子的质量主要集中在b和c上,D错误。
10.答案:C
解析:A、不同种元素最本质的区别是质子数不同,③和④核内质子数相同,属于同一种元素,图中共表示4种元素,故选项说法正确;
B、②③⑤的最外层为电子数均为8,均属于相对稳定结构,故选项说法正确;
C、①②④,质子数=核外电子数,为原子;③质子数>核外电子数,为阳离子,⑤质子数<核外电子数,为阴离子;故选项说法错误;
D、④核内质子数为11,为钠元素,原子的最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为+1价;①的核内质子数为9,为氟元素,原子的最外层电子数为7,在化学反应中易得到1个电子而形成1个单位负电荷的阴离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为-1价;组成化合物的化学式为,故选项说法正确。
故选:C。
11.答案:D
解析:A、分子和原子都在不断的运动,运动快慢主要与温度有关。A不符合题意;
B、分子、原子都能构成物质。B不符合题意;
C、分子和原子不管是质量还是体积都不能比较大小,因为有的原子很小,有的原子很大,有的分子很小,有的分子很大。C不符合题意;
D、分子和原子的本质区别是在化学变化中分子可再分,原子不能再分。D符合题意。
故选:D。
12.答案:C
解析:氯化钠晶体是由钠离子和氯离子构成的。
13.答案:A
解析:A.离子是带电的原子或原子团,带电的粒子除了离子还有质子、电子等,故A错误;
B.化学反应的微观本质是分子分裂成原子,原子重新组合成新分子的过程,所以在化学反应中,分子可分成原子,而原子却不能再分,故B正确;
C.分子、原子、离子都是构成物质的基本粒子,故C正确;
D.原子不显电性,分子由原子构成,所以分子也不显电性,而离子是原子得失电子形成的带电微粒,显电性,故D正确;
故选:A。
14.答案:C
解析:这里的“磷”是强调物质的宏观组成,指的是组成元素,与具体形态(单质、分子、原子等)无关。故选:C。
15.答案:B
解析:地壳中含量由高到低居前四位的元素依次是氧、硅、铝、铁。
16.答案:D
解析:Fe可表示铁元素,表示一个铁原子,表示铁这种物质,不能表示铁分子。
故选:D。
17.答案:C
解析:元素是指具有相同核电荷数(即核内质子数)的一类原子的总称,“含氟牙膏”中的“氟”指的是元素,不是物质,A错误;氨气由分子构成,不属于元素,B错误;物质发生化学变化时,元素的种类不会改变,C正确;同种元素的原子核内质子数不一定等于中子数,如碳12、碳13、碳14,质子数相同,中子数不相同,D错误。
18.答案:D
解析:A.氮原子核外有两个电子层,位于第二周期,氮为“气”字头,氮元素非金属元素,正确;
B.原子的质子数=核电荷数,均为31,正确;
C.原子质量主要集中在原子核上,镓原子变成镓离子只是失去了核外3个电子,原子核没变,故质量几乎相等,正确;
D.镓原子核内有31个质子,质子数=电子数,镓原子失去最外层3个电子成为镓离子,故镓离子有28个电子,错误。
故选:D。
19.答案:A
解析:相对原子质量等于某一个原子的实际质量与一个碳原子质量的1/12的比值,若如果一个碳12原子的相对原子质量从12变为24,那么A、氧原子的相对原子质量则会变为32,而一个碳-12原子的质量、一个硫酸分子的质量以及10克二氧化碳所含的分子个数都不会发生变化,故选A。
考点:相对原子质量
20.答案:B
解析:表示铁原子, 表示铁原子失去两个电子后形成的离子, 表示铁原子失去3个电子后形成的离子,对、、三种粒子来说,尽管核外电子数不同,但是核内质子数是相同的,所以核电荷数相同,属于同种元素。由于电子质量极小,可以忽略不计,所以三种粒子质量几乎相等,由此还可推知,等质量的三种粒子个数相同,所含质子数相同。由于三种粒子核外最外层电子数不同,所以化学性质不同。
21.答案:; 2.B; 3.AB; 4.失去; 最外层电子数
解析:1.地壳中含量最多的金属元素为铝元素,再根据元素周期表的内容,查知其相对原子质量为26.98;
2.根据元素的概念可知,表中不同种元素最本质的区别是质子数不同;
3.总结归纳是学习化学的一种重要方法:元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律;
4.镁原子在化学反应中易失去电子,元素的化学性质与原子的最外层电子数关系密切。
相关试卷
这是一份人教版初中化学二轮复习专题练习-构成物质的微粒,共11页。试卷主要包含了 分子, 原子, 离子,38g等内容,欢迎下载使用。
这是一份人教版初中化学二轮复习专题练习-化学元素,共12页。试卷主要包含了 元素的概念, 元素的分类, 元素的周期规律, 元素的化合价, 元素的电负性,96g,9g等内容,欢迎下载使用。
这是一份北京课改版九年级上册第一节 初步认识化学元素课时练习,共9页。试卷主要包含了选择题,判断题,综合应用题等内容,欢迎下载使用。












