
贵州省金太阳2024届高三化学下学期联考开学考
展开注意事项:
1. 答题前,考生务必将自己的姓名、考生号、考场号、座位号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将本试卷和答题卡一并交回。
4. 本试卷主要考试内容:高考全部内容。
5. 可能用到的相对原子质量:H1C12N14O16S32Ca40Cr52Fe56
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.苗画、凤凰纸扎、踏虎凿花、土家族打溜子都是著名的非物质文化遗产,下列说法中错误的是
A.苗画制作时,常用到赭石(主要成分为Fe2O3),Fe2O3属于碱性氧化物
B.纸扎工艺中用到的材料有竹篾和木棍等,竹篾的主要成分为纤维素
C.踏虎凿花是用刻刀凿制完成的,碳钢刀是常用的一种刻刀,碳钢属于合金
D.土家族打溜子需要使用鼓,牛皮鼓面的主要成分为蛋白质,牛皮鼓面能耐酸碱腐蚀
2.下列化学用语或图示表达错误的是
A.ClO4-的空间结构模型:
B.p-pπ键电子云轮廓图:
C.氮原子2py电子云图:
D.CH3CH2OH中,碳原子与氧原子之间形成的共价键类型为sp3-sp3σ键
3.化学与生活息息相关。下列项目与所述化学原理没有关联的是
4.下列表述错误的是
A.1s22s22px1→1s22s22py1过程中形成的是发射光谱
B.CO32-空间结构为平面正三角形
C.NH4+不能作为配合物的配位体
D.NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
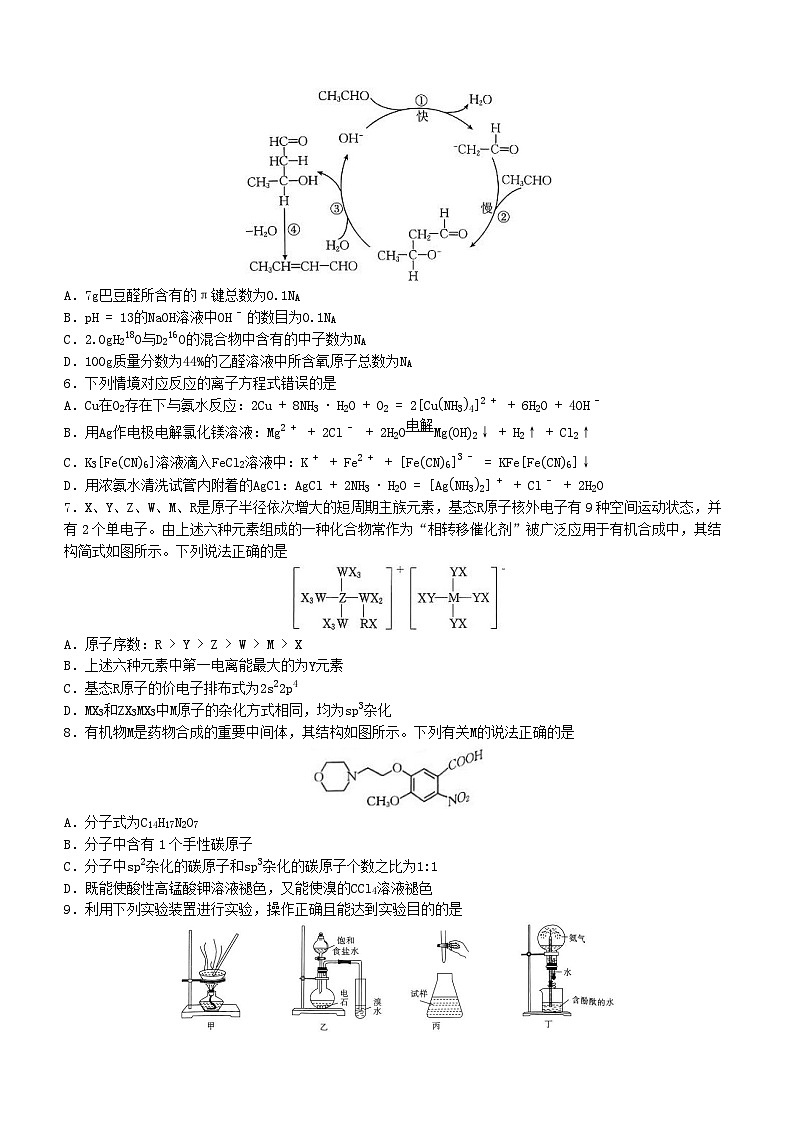
5.稀碱条件下,由乙醛合成巴豆醛CH3CH=CHCHO的反应历程示意图如图。设NA为阿伏加德罗常数的值,下列说法正确的是
A.7g巴豆醛所含有的π键总数为0.1NA
B.pH=13的NaOH溶液中OH-的数目为0.1NA
C.2.0gH218O与D216O的混合物中含有的中子数为NA
D.100g质量分数为44%的乙醛溶液中所含氧原子总数为NA
6.下列情境对应反应的离子方程式错误的是
A.Cu在O2存在下与氨水反应:2Cu+8NH3⋅H2O+O2=2[CuNH34]2++6H2O+4OH-
B.用Ag作电极电解氯化镁溶液:Mg2++2Cl-+2H2O电解MgOH2↓+H2↑+Cl2↑
C.K3[FeCN6]溶液滴入FeCl2溶液中:K++Fe2++[FeCN6]3-=KFe[FeCN6]↓
D.用浓氨水清洗试管内附着的AgCl:AgCl+2NH3⋅H2O=[AgNH32]++Cl-+2H2O
7.X、Y、Z、W、M、R是原子半径依次增大的短周期主族元素,基态R原子核外电子有9种空间运动状态,并有2个单电子。由上述六种元素组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图所示。下列说法正确的是
A.原子序数:R>Y>Z>W>M>X
B.上述六种元素中第一电离能最大的为Y元素
C.基态R原子的价电子排布式为2s22p4
D.MX3和ZX3MX3中M原子的杂化方式相同,均为sp3杂化
8.有机物M是药物合成的重要中间体,其结构如图所示。下列有关M的说法正确的是
A.分子式为C14H17N2O7
B.分子中含有1个手性碳原子
C.分子中sp2杂化的碳原子和sp3杂化的碳原子个数之比为1:1
D.既能使酸性高锰酸钾溶液褪色,又能使溴的CCl4溶液褪色
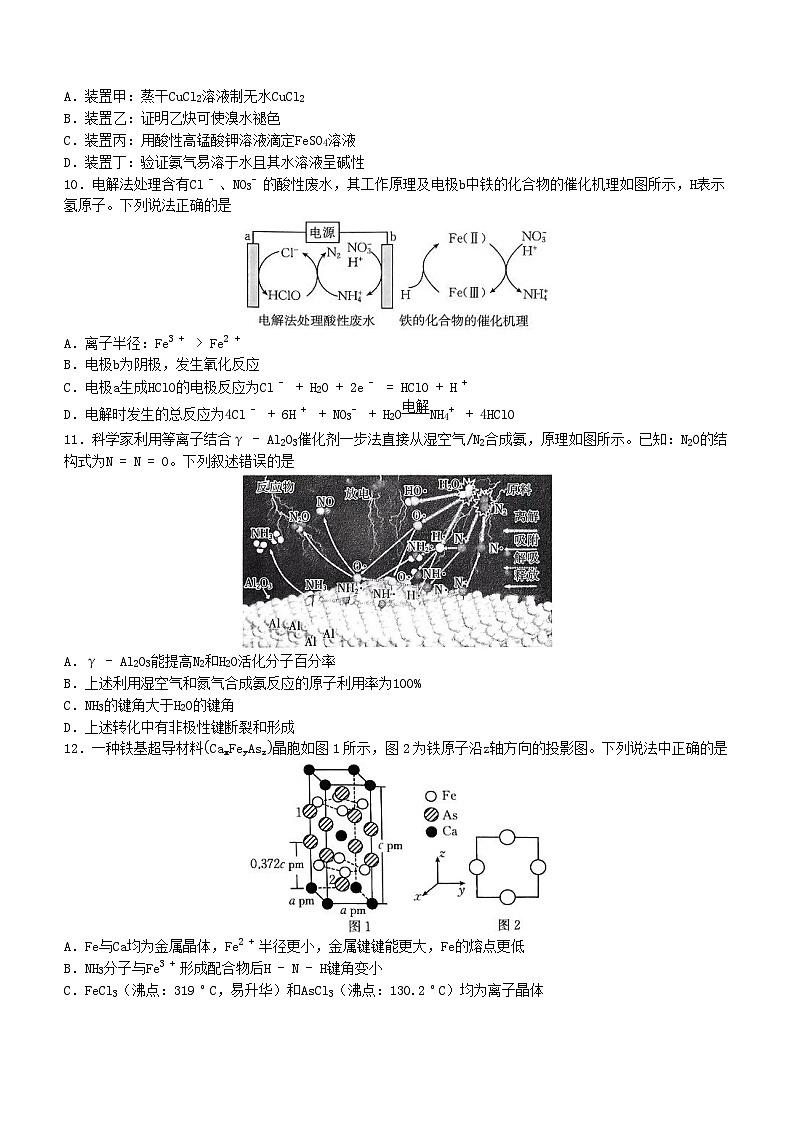
9.利用下列实验装置进行实验,操作正确且能达到实验目的的是
A.装置甲:蒸干CuCl2溶液制无水CuCl2
B.装置乙:证明乙炔可使溴水褪色
C.装置丙:用酸性高锰酸钾溶液滴定FeSO4溶液
D.装置丁:验证氨气易溶于水且其水溶液呈碱性
10.电解法处理含有Cl-、NO3-的酸性废水,其工作原理及电极b中铁的化合物的催化机理如图所示,H表示氢原子。下列说法正确的是
A.离子半径:Fe3+>Fe2+
B.电极b为阴极,发生氧化反应
C.电极a生成HClO的电极反应为Cl-+H2O+2e-=HClO+H+
D.电解时发生的总反应为4Cl-+6H++NO3-+H2O电解NH4++4HClO
11.科学家利用等离子结合γ-Al2O3催化剂一步法直接从湿空气/N2合成氨,原理如图所示。已知:N2O的结构式为N=N=O。下列叙述错误的是
A.γ-Al2O3能提高N2和H2O活化分子百分率
B.上述利用湿空气和氮气合成氨反应的原子利用率为100%
C.NH3的键角大于H2O的键角
D.上述转化中有非极性键断裂和形成
12.一种铁基超导材料CaxFeyAsz晶胞如图1所示,图2为铁原子沿z轴方向的投影图。下列说法中正确的是
A.Fe与Ca均为金属晶体,Fe2+半径更小,金属键键能更大,Fe的熔点更低
B.NH3分子与Fe3+形成配合物后H-N-H键角变小
C.FeCl3(沸点:319∘C,易升华)和AsCl3(沸点:130.2∘C)均为离子晶体
D.已知处于体心与顶点的Ca原子有着相同的化学环境,晶胞中As原子1的原子坐标为0,0,0.628c,则As原子2的原子坐标为0.5a,0.5a,0.128c
13.碳酸锂是制备高纯锂化合物和锂合金的主要原料,在玻璃和陶瓷制造、医药、有色金属冶炼、锂电池电极材料等领域具有广阔的应用前景。某化学小组在实验室用含锂废渣(主要含Li2O,还含有少量其他能溶于盐酸的金属氧化物及少量碳单质)制备碳酸锂的流程如图所示:
下列说法错误的是
A.“浸渣”的主要成分是碳单质B.“萃取”和“反萃取”均应在烧杯中进行
C.“蒸发浓缩”的目的之一是除去过量的HClD.“沉锂”后所得母液中含有NaCl
14.GaCl3溶液中存在平衡:Ga3+⇌K1GaOH2+⇌K2GaOH2+⇌K3GaOH3⇌K4GaOH4-。常温下,向GaCl3溶液中加入NaOH溶液,Ga3+、GaOH2+、GaOH2+、GaOH3、GaOH4-的浓度分数α随溶液pH变化如图所示。下列说法错误的是
A.曲线c表示GaOH2+的浓度分数随溶液pH的变化
B.x点对应的溶液中,cCl->cNa+>cH+>cOH-
C.y点对应的溶液中,pH=lgK3+lgK42
D.常温下,GaOH2++H2O⇌GaOH2++H+的平衡常数K=10-3.6
二、非选择题:本题共4小题,共58分。
15.(15分)利用莫尔盐制备草酸亚铁晶体FeC2O4⋅2H2O的实验及样品纯度的检验实验设计如下,回答下列问题:
已知:pH>4时,Fe2+易被氧气氧化。
Ⅰ. 莫尔盐[NH42FeSO42⋅6H2O]的制备
实验步骤:将绿矾与适量的硫酸铵固体混合溶于水中,加入适量的稀硫酸调节pH至1∼2,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
(1)用稀硫酸调溶液pH至1∼2的目的是 。
Ⅱ. 草酸亚铁晶体的制备
实验步骤:将莫尔盐溶于适量稀硫酸并装入三颈烧瓶中,通过仪器X滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。
(2)仪器X的名称是 ,导管A的作用是 。
Ⅲ. 草酸亚铁晶体样品纯度的检验
草酸亚铁晶体样品中可能含有的杂质为FeSO4,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
①准确称取mg草酸亚铁晶体样品,溶于稀硫酸中,配成100mL溶液。
②取20.00mL①中所得的溶液,用cml⋅L-1KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液V1mL。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
④继续用cml⋅L-1KMnO4标准溶液滴定步骤③中所得滤液至终点,消耗KMnO4标准溶液V2mL。
已知:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O。
(3)步骤②中cml⋅L-1的KMnO4溶液装在 (填“酸式滴定管”或“碱式滴定管”)中;步骤④中若滴定开始和结束时,滴定管中的液面如图所示,则V2= 。
(4)步骤②滴定终点的现象为 ;步骤③中加入锌粉的目的是 。
(5)草酸亚铁晶体样品的纯度为 (用含m、c、V1、V2的式子表示)。
16.(14分)钒和铬都是重要的战略金属,利用钒、铬废渣(主要成分为NaVO3和Na2CrO4,还含有其他难溶物)分离回收钒、铬的工艺流程如图所示。
已知:常温下,KspBaCO3=5.1×10-9,KspBaCrO4=1.2×10-10,KspCuCrO4=3.6×10-6。
回答下列问题:
(1)基态铬原子价电子轨道表示式为 。
(2)钒、铬废渣“水浸”前,先要进行粉碎处理,为提高浸取效率,还可采取的措施有 (任写一点)。
(3)“沉钒”的含钒产物为钒酸钙CaO⋅V2O5,该过程中发生反应的化学方程式是 。
(4)“沉铬”时,铬转化为CuCrO4沉淀,“转化”过程中发生反应的离子方程式为 。
(5)向“沉钒后液”中加入足量BaCO3,可将其中的铬转化为BaCrO4沉淀,铬的理论转化率为 (保留三位有效数字)%。
(6)复合材料氧铬酸钙的立方晶胞如图所示。
①该晶体的化学式为 。
②已知该晶体的密度为ρg⋅cm-3,NA为阿伏加德罗常数的值,则相邻Ca2+与Cr3+之间的最短距离为 pm(列出计算式即可)。
17.(14分)有机物G是一种用于治疗肺动脉高压的药物,其一种合成路线如下:
回答下列问题:
(1)有机物D分子中含有的官能团的名称为 。
(2)F分子中N原子的杂化方式为 。
(3)C的分子式为C13H10O,其结构简式为 。
(4)有机物H是D的同分异构体,同时满足下列条件的H的结构有 种,写出其中核磁共振氢谱峰面积之比为1:2:2:2:2:2:2:1的结构简式: 。
①除苯环外,不含其他环状结构;
②能发生银镜反应,不能与FeCl3发生显色反应;
③在碱性条件下水解生成碳原子数相等的两种有机物,所得产物经酸化后,一种产物既能发生银镜反应,又能与FeCl3发生显色反应,另一种产物分子的苯环上仅有一个侧链。
(5)设计以CH3CH=CH2、CH3OH和为原料制备化合物的合成路线。(无机试剂和有机溶剂任用,合成路线示例见本题题干)
18.(15分)2023年7月全球首枚液氧甲烷火箭——朱雀二号在酒泉卫星发射中心发射成功。根据所学知识,回答下列问题:
Ⅰ. 通过CO2加氢制CH4回收利用CO2是实现“双碳”经济的有效途径之一,某催化剂作用下的CO2加氢制CH4的反应历程如图所示(吸附在催化剂表面的物种用*标注)。
主要涉及如下反应:
主反应:CO2g+4H2g⇌CH4g+2H2OgΔH1
副反应:CO2g+H2g⇌COg+H2OgΔH2=+41.2kJ⋅ml-1已知:H2g、CH4g的燃烧热分别为-285.8kJ⋅ml-1、-890.3kJ⋅ml-1。
(1)H2Og=H2OlΔH=-44kJ⋅ml-1。则ΔH1= kJ⋅ml-1,若主反应的正反应的活化能为3350kJ⋅ml-1,则主反应的逆反应的活化能为 kJ⋅ml-1。
(2)T∘C时,向1L恒容密闭容器中充入4mlCO2和12mlH2,发生反应,初始压强为p:
①能说明主反应达到平衡状态的是 (填标号)。
A.vCO2=vCH4
B.容器内压强不再变化
C.气体平均相对分子质量不再变化
D.气体密度不再变化
E.CH4的体积分数不再变化
②20min时,主、副反应都已达到平衡状态,此时测得cH2O=5ml⋅L-1,体系压强为34p,则0∼20min内,vCH4= ml⋅L-1⋅min-1,平衡时CH4选择性= (保留3位有效数字,CH4选择性=CH4平衡浓度CO2转化浓度×100%),该温度下,主反应的平衡常数Kp= (列出计算式即可)。
(3)某科研小组用甲烷燃料电池(电解质溶液为KOH溶液)提供能量制备CH2PO22,并获得副产品NaOH,其工作原理如图所示(已知:电解装置的电极材料分别为金属钴和不锈钢,H3PO2是一元弱酸)。
①膜b为 (填“阳”或“阴”)离子交换膜。
②电解过程中,原料室溶液的pH (填“增大”“减小”或“不变”)。
③燃料电池m极的电极反应为 。选项
项目
化学原理
A
用明矾溶液清除铜镜表面的铜锈
明矾溶液显酸性
B
福尔马林用于浸制标本
福尔马林具有氧化性
C
用铝粉和氢氧化钠溶液疏通厨卫管道
铝粉与NaOH溶液反应放热并产生H2
D
医疗上进行胃部造影前,BaSO4作患者服用的“钡餐”
BaSO4不溶于水,不与胃酸反应
江西省金太阳联考2023-2024学年高三下学期3月联考化学试卷: 这是一份江西省金太阳联考2023-2024学年高三下学期3月联考化学试卷,文件包含江西2024届高三3月29日金太阳联考试化学卷pdf、化学381C答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
贵州省黔东南州九校联考2023-2024学年高三下学期开学考试化学答案: 这是一份贵州省黔东南州九校联考2023-2024学年高三下学期开学考试化学答案,共5页。
贵州省黔东南州九校联考2023-2024学年高三下学期开学考试化学试卷: 这是一份贵州省黔东南州九校联考2023-2024学年高三下学期开学考试化学试卷,共8页。












