

江西省重点中学盟校2024届高三下学期第一次联考化学试卷(Word版附答案)
展开考生注意:
1.本试卷分选择题和非选择题两部分。满分 100 分,考试时间 75 分钟。
2.答题前,考生务必用直径 0.5 毫米黑色墨水签字笔将密封线内项目填写清楚。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径 0.5 毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
4.本试卷主要命题范围:高考范围。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 S-32 Cl-35.5 Ag-108
一、选择题(本题包括 14 小题,每小题 3 分,共 42 分。每小题只有 1 个选项符合题意)
1. 化学与生活、科技、社会发展有着密切的联系。下列描述正确的是( )
A. 苯酚和甲醛可以发生加聚反应用于合成酚醛树脂
B. 维生素 C 用于抗衰老保健品的辅料,因为其有较强的氧化性能清除体内自由基
C. 硅胶、氧化钙以及铁粉都是食品包装袋中常见的干燥剂
D. 光导纤维可以实现对光的全反射,属于新型无机非金属材料
2.近年我国科技创新成果丰硕,下列有关材料属于有机高分子的是( )
A.超算“天河一号”的芯片 B.“深海一号”船体海水浸泡区的白块
C.坦克表面用于防弹装甲的芳纶 D.C919 民航客机燃烧的航空煤油
3. 下列化学用语的表达错误的是( )
A. H3PO2(一元酸)的结构式: B. 聚苯乙烯的链节:C6H5-CH=CH2
C. COCl2中所有原子都达到 8 电子稳定结构 D. I4O9(碘酸碘)中碘的化合价为+3、+5
4. 设 NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.0L 0.01ml/L 的 K2Cr2O7酸性溶液加水稀释时溶液中Cr2 O72- 始终为 0.01NA
B. 1ml [C (NH3)5Cl ]Cl 2含有σ键的数目是 21NA
C. 将 4.6g 钠用铝箔包裹并刺小孔,与足量水充分反应生成 H2分子数为 0.1NA
D. 室温下 pH=11 的 Na2CO3溶液,由水电离出的 OH-数目为 0.001NA
5. 下列所用仪器或试剂,在涉及操作中的作用或性质前后相同的是( )
A. 玻璃棒的作用:过滤;溶解
B. 温度计的位置:乙醇浓硫酸共热制乙烯;分离乙醇和水的混合液
C. 水体现的性质:分别与 Na 和 Na2O2反应生成气体
D. SO2的性质:分别使溴水和高锰酸钾溶液褪色
6. 某短周期元素的价类二维图如下图所示,下列说法正确的是( )
A. a 可以用 g 的浓溶液干燥 B. c 可以使石蕊溶液先变红后褪色
C. b 易溶于 CS2 D. e、h 一定均能促进水的电离
7. 下列各组离子中,在给定的环境中一定能大量共存的是( )
A. 能使甲基橙变红的溶液:S2-、SO42-、NO3-、Na+
B. 常温下,由水电离的 c(H+)=10-12的溶液中:Be2+、 NO3- 、K+、Cl-
C. 在水溶液中: AlO2-、HCO3-、Ba2+、F-
D. 在漂白液中:OH- 、Rb+、CO32-、SO42-
8. 已知在有机化合物中,吸电子基团(吸引电子云密度靠近)能力:,推电子基团(排斥电子云密度偏离)能力:,一般来说,体系越缺电子,酸性越强;体系越富电子,碱性越强。下列说法错误的是( )
A. 与 Na 反应的容易程度: B. 羟基的活性:C6H5OH > H2O
C. 酸性: D. 碱性:
9. 某离子液体的阴离子的结构如图所示,其中 W、X、Y、Z、M 为原子序数依次增大的短周期元素,W、X、Y、Z 原子半径依次减小,且 M 的原子序数是 Y 的 2 倍。下列说法正确的是( )
A. WZ4 、XZ3 、YZ2 中心原子孤电子对数依次增多
B. 同周期第一电离能大于 Y 的元素有 1 种
C. 氢化物的熔沸点大小顺序一定为 W
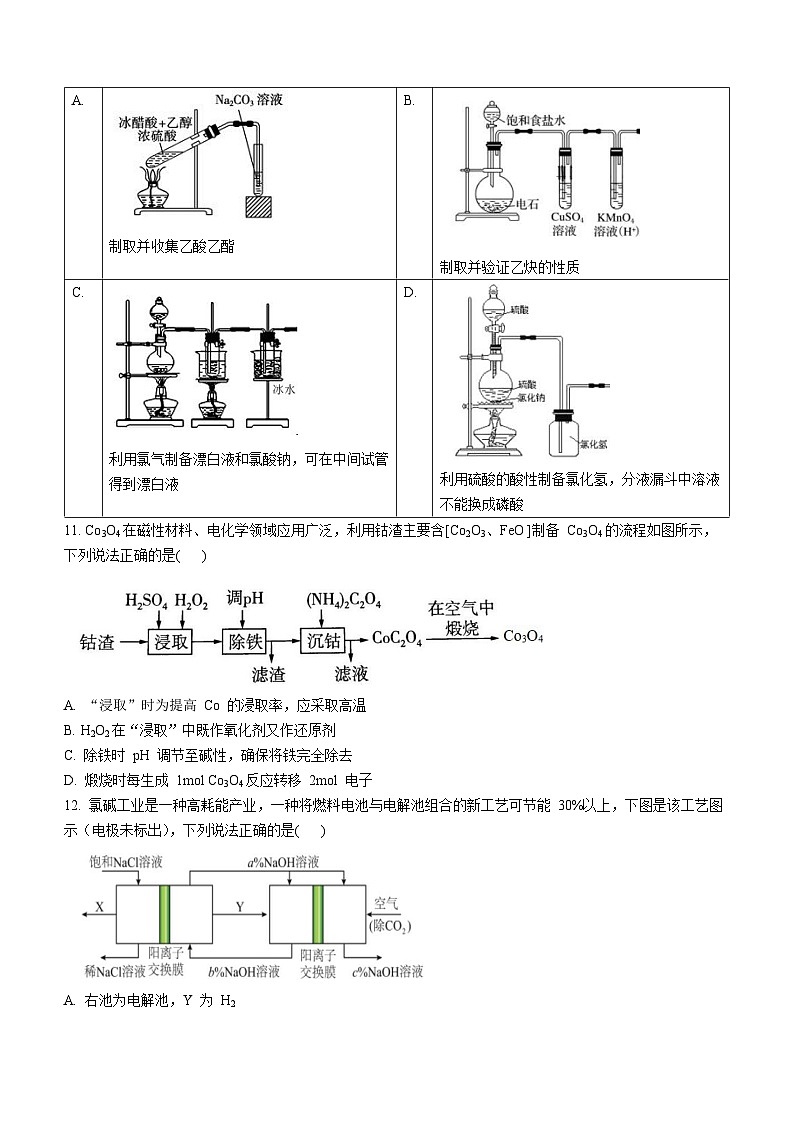
10. 下列实验方案合理的是( )
11. C3O4在磁性材料、电化学领域应用广泛,利用钴渣主要含[C2O3、FeO ]制备 C3O4的流程如图所示,下列说法正确的是( )
A. “浸取”时为提高 C 的浸取率,应采取高温
B. H2O2在“浸取”中既作氧化剂又作还原剂
C. 除铁时 pH 调节至碱性,确保将铁完全除去
D. 煅烧时每生成 1ml C3O4反应转移 2ml 电子
12. 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能 30%以上,下图是该工艺图示(电极未标出),下列说法正确的是( )
A. 右池为电解池,Y 为 H2
B. 通入空气的电极反应式为:
C. a>b>c D. 两池的钠离子均从左往右侧移动
13. Ce 的某种氧化物具有良好的储氧放氧能力,可作为氧载体参与有机物氧化反应,其中 Ce 为面心立方堆积,O 填充在 Ce 立方晶格所有的正四面体空隙中(如右图,未标注全部的 O),下列说法错误的是( )
A. 该氧化物化学式为 CeO2
B. O 原子周围等距且最近 O 原子个数为 6
C. 若反应后,晶胞中 O 脱离形成一个 O 的空位,则该物质中 Ce3+与 Ce4+的个数比为 1:3
D. 若顶点位置原子位于体心时,则面心原子位于棱心
14. 已知常温下 H2S 饱和溶液为 0.1ml/L,维持 H2S 浓度不变,调节 pH 溶解 FeS,溶液 pH 与-lgc(S2-)或-lgc(Fe2+)关系如图所示,则下列说法错误的是( )
A. ①代表 pH 与-lgc(S2-)的关系
B. 该溶液中 c2(H+)·c(S2-)为常数,数量级为 10-20
C. 欲使 c(Fe2+)溶液中达到 1ml/L,应调节溶液的 pH 在 1.6
D. 已知常温下 CuS 的,则用上述溶液溶解 CuS 难以发生Ce 原子氧原子
二、非选择题(本题包括 4 小题,共 58 分。)
15.(14 分)2—噻吩乙醇( Mr = 128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
Ⅰ.制钠砂。向烧瓶中加入300mL液体 A 和4.60g 金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25mL(ρ=1.07g/cm3)噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min 。
Ⅳ.水解。恢复室温,加入70mL水,搅拌30min ;加盐酸调pH 至 4~6,继续反应2h ,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4 ,静置,过滤,对滤液进行操作 X,得到四氢呋喃、噻吩、液体 A和 15.36g 产品。
回答下列问题:
(1)步骤Ⅰ中液体 A 可以选择_______________ 。
a.苯 b.水 c.乙醇 d.CCl4
(2)步骤Ⅱ的反应类型为_______________ 。
(3)步骤Ⅲ中反应,加入的环氧乙烷稍过量的目的是_______________ ;环氧乙烷溶于四氢呋喃的原理是 _______________。
(4)步骤Ⅳ中加入70mL水,搅拌30min 此时水解的化学方程式是_______________ 。
(5)在步骤Ⅴ中操作 X 是 _______________;需要用到的玻璃仪器有蒸馏烧瓶、_______________ 、_______________ 牛角管和锥形瓶
(6)产品的产率为_______________ 。
16.(15 分)以银锰精矿(主要含Ag2S 、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
已知:①酸性条件下,MnO2的氧化性强于Fe3+ 。 ②Fe3+ 可以把部分Ag 氧化为Ag+ 。
(1) “浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除 FeS2 ,有利于后续银的浸出:矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应,为提高浸取速率,可采取的措施 __________、 __________ (举两例)。
②在H2SO4溶液中,银锰精矿中的FeS2 和氧化锰矿中的MnO2发生反应且产物均在浸锰液中,则该反应的离子方程式为 __________。
(2) 室温下调节 pH 不低于__________ 可完全除去杂质离子,(离子浓度小于 10-5ml·L-1 认为完全去除,已知:,,。)
(3)“浸银”时,有两种方式,①第一种可以使用过量的 、 (填化学式)和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2 ]- 形式浸出,此时的离子方程是
②第二种使用 NaCN 溶液同时通入 O2作浸出剂,将Ag2S中的银以[Ag(CN)2]—形式浸出,此时离子的方程式为______________ 。
从节约环保的角度考虑,你认为方式 ______________更好,(填“第一种”或“第二种”)理由是______________、______________ 。
(4) “沉银”过程中可以用过量的铁粉作为还原剂,铁粉可将[AgCl2 ]- 还原为单质银,过量的铁粉还可以与铁离子发生反应;但也可以采用 Zn 粉作还原剂,那么采用 Zn 粉作还原剂有什么优势?______________、 ______________。
17.(14 分)回答下列问题
(1) 工业合成氨是人类科学技术的一项重大突破。迄今为止,人类仍然在追求低成本、高产率的合成氨技术。
,,那么常温下,合成氨反应_______(填“能”或“不能”)自发进行
(2) 若将 1.0ml N2 (g) 和 3.0ml H2 (g) 通入体积为 2L 的密闭容器中,分别在T1和T2温度下进行反应。曲线A 表示T2温度下 n (H2)的变化,曲线 B 表示T1温度下 n (NH3)的变化,T2温度下反应到 a 点恰好达到平衡。
①温度T1_____________(填“>”、“<”或“=”,下同)T2。T1温度下恰好平衡时,曲线 B 上的点为b(m,n),则m______________ 14,n ______________1。
②T2温度下,若某时刻容器内气体的压强为起始时的 70%,则此时v(正)______________(填“>”、“<”或“=”) v(逆)。计算T2温度下,Kc=______________ 。
(3) 常温下, Hg2+与Cl- 的配合物存在如下平衡:,含 Hg 微粒的分布系数δ与 lgc(Cl-)的关系如下图所示:
已知:
图中能代表 HgCl3-和 HgCl+曲线分别是 __________和__________ (填字母),曲线 A 和曲线 C 交点的横坐标为 __________。
(4)羟基自由基(·OH)是自然界中氧化性仅次于氟的氧化剂。我国科学家设计了一种将苯酚氧化为 CO2和H2O 的原电池-电解池组合装置,以实现发电、环保二位一体。
请写出 b 极的电极反应方程式__________ 。
18.(15 分)伊马替尼(Imatinib)是首个用于治疗慢性粒细胞白血病的分子靶向抗肿瘤药物,被列入世界卫生组织的基本药物标准清单,被认为是医疗系统中“最为有效、最为安全,满足最重大需求”的基本药物之一。以下是该物质的合成路线。
(1)A→B 的反应类型为 __________,化合物 H 的含氧官能团名称为__________ ;
(2)根据化合物 G 的分子式(C8H6OCl2),请写出 过程的化学方程式__________;在该反应过程中化合物 H 的稳定性较差,原因可能为__________ ;
(3)化合物 C 中吡啶环上 N 原子的杂化方式为__________ ,其孤电子对占据__________ 轨道;
(4)化合物 D 的同分异构体中,符合下列条件的有 __________种,其中核磁共振氢谱峰面积之比为 1:1:1:1:2:2:4 的结构为__________ (写一种)
①芳香族化合物且能发生银镜反应
②苯环上连有三个取代基,其中两个为氨基
③结构中含有一个手性碳原子
(5)参照合成路线,请设计以 和甲醇为原料合成 的路线。
参考答案
1-5:DCBBD 6-10CDDAB 11-14BDCC
15.答案:(1)ad ( 2 分)
(2)置换反应 ( 2 分)
(3)提高 2-噻吩钠的转化率;( 2 分) 相似相溶 (1 分)
(4) + H2O + NaOH ( 2 分)
(5)蒸馏(1 分); 温度计、直形冷凝管(回答“酒精灯”也给分)( 2 分)
(6) 60%( 2 分)
16.答案:(1) 将银锰精矿和氧化锰矿粉粹、 适当升高温度(其他合理答案均可) (2分)
(2 分)
(2) 3 (2 分)
(3)FeCl3、HCl(2 分)
(2 分)
第一种;(1 分)
理由是第一种方式中浸锰液中生成的Fe3+还可以用于浸银,节约氧化剂;而第二种方式中CN—会水解生成 HCN,HCN 有剧毒。 (2 分)
(4) 置换速度更快,银回收率更高。(2 分)
17.答案:(1)能(1 分)
(2) ① < > > (各 1 分)② <或 2.37(各 2 分)
(3) D B(各 1 分) -6.63(2 分)
(4)(2 分)
18.答案:(1)加成反应(1 分) 酰胺基(1 分)
(2) (2 分)
H 在碱性条件下不稳定,容易水解成相应的胺(2 分)
(3)sp2 sp2杂化(各 1 分)
( 4 ) 6 种 (各 2 分)
(5)
(前两步步骤互换也得分)(3 分)
A.
制取并收集乙酸乙酯
B.
制取并验证乙炔的性质
C.
利用氯气制备漂白液和氯酸钠,可在中间试管得到漂白液
D.
利用硫酸的酸性制备氯化氢,分液漏斗中溶液不能换成磷酸
江西省重点中学盟校2024届高三下学期第一次联考化学试卷(Word版附解析): 这是一份江西省重点中学盟校2024届高三下学期第一次联考化学试卷(Word版附解析),文件包含江西省重点中学盟校2024届高三第一次联考化学试卷原卷版docx、江西省重点中学盟校2024届高三第一次联考化学试卷解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。
2024届江西省重点中学联盟校高三第一次联考化学试卷: 这是一份2024届江西省重点中学联盟校高三第一次联考化学试卷,文件包含盟校化学联考试题pdf、化学参考答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
江西省重点中学盟校2023届高三下学期第二次联考理综化学试题(无答案): 这是一份江西省重点中学盟校2023届高三下学期第二次联考理综化学试题(无答案),共9页。试卷主要包含了未知,单选题等内容,欢迎下载使用。












