

化学选择性必修1第3章 水溶液中的离子反应与平衡3.1水的电离和溶液的酸碱性同步达标检测题
展开
这是一份化学选择性必修1第3章 水溶液中的离子反应与平衡3.1水的电离和溶液的酸碱性同步达标检测题,共12页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.水的电离过程为。在25℃、35℃时水的离子积常数分别为、。下列叙述中正确的是
A.纯水中随着温度的升高而增大
B.在35℃时,纯水中
C.水的电离度
D.水的电离过程是放热过程
2.已知在100 ℃时水的离子积Kw=1×10-12,下列溶液的温度均为100 ℃。其中说法正确的是
A.0.005 ml·L-1的H2SO4溶液,pH=2
B.0.001 ml·L-1的NaOH溶液,pH=11
C.0.005 ml·L-1的H2SO4溶液与0.01 ml·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=9的NaOH溶液100 mL
3.在不同温度下,水达到电离平衡时与的关系如图所示。时,将的溶液和的溶液等体积混合后(混合后溶液的体积变化忽略不计),该溶液的是
A.1.7B.2C.10D.10.3
4.温度,向的蒸馏水中通入一定量的,保持温度不变,测得溶液的为2,下列叙述正确的是
A.T小于25
B.该溶液中由水电离出来的的浓度是
C.通入促进了水的电离
D.该温度下加入等体积的溶液可使该溶液,恰好呈中性
5.某温度下,由组成的水的离子积为,已知,下列关于的叙述正确的是
A.该温度下,呈中性,其
B.该温度下,1L含的溶液的
C.该温度下,1L含的溶液的
D.该温度下,的溶液和的的溶液混合后(混合后溶液的体积变化忽略不计),所得溶液的
6.时,若溶液中由水电离产生的,则下列说法正确的是
A.该溶液中水的电离被促进
B.该溶液的一定为12
C.该溶液一定是溶液
D.该溶液中、、、可以大量共存
7.下列说法错误的是
A.常温下,纯水中的c(H+)=c(OH-)=1×10-7ml·L-1
B.向水中加入NaCl,H+与Cl-结合生成HCl,使水的电离平衡向正反应方向移动
C.向水中加入HCl或者NaOH,水的电离平衡都向逆反应方向移动
D.改变温度,Kw也会发生改变
8.新制氯水中含有氯元素的微粒有和等。是家用消毒液的有效成分,能与反应生成。下列说法正确的是
A.新制氯水需存放在带玻璃塞的棕色试剂瓶中
B.可用广泛试纸测定新制氯水的值
C.新制氯水使滴有酚酞的溶液红色褪去是因为其中的
D.使用消毒时,可用盐酸酸化
9.水的电离平衡曲线如图所示,下列说法正确的是
A.T1>T2
B.Kw:b>c>a>d=e
C.b→c点可通过在水中加入适量的CH3COONa(s)实现
D.T2时,将pH=10的NaOH(aq)与pH=3的H2SO4(aq)等体积混合,溶液呈碱性
10.常温下,下列各组离子在指定条件下可能大量共存的是
A.含有的溶液中:、、、
B.的溶液中:、、、
C.的溶液中:、、、
D.水电离出的的溶液中:、、、
11.常温下,下列各组离子在指定的条件下能大量共存的是
A.c(Fe3+)=0.1ml/L的溶液中:K+、Cl-、SO、SCN-
B.在= 10−13的溶液中:NH、K+、F-、NO
C.通入足量CO2的溶液中:H+、Cl-、NH、Ca2+
D.由水电离出的c(H+)=10-12ml/L的溶液中:Mg2+、Na+、SO、ClO-
12.25°C时,某溶液中由水电离出的H+浓度为1.0×10-12ml·L-1,下列说法错误的是
A.若为酸溶液,则该溶液的pH为2
B.若为碱溶液,则该溶液中碱电离出的c(OH-)与水电离出的c(OH-)之比为1010
C.若该溶液中的溶质只有一种,该溶质一定是酸或碱
D.S2-在该溶液中可能大量共存
13.将纯水加热至较高温度,下列叙述正确的是
A.水的离子积不变
B.水的pH变小,呈酸性
C.水中的
D.水的pH变大、呈中性
14.某温度下,向c(H+)=1×10-6 ml·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 ml·L-1。下列对该溶液的叙述错误的是
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10 ml·L-1
C.加入NaHSO4晶体抑制水的电离
D.取该溶液加水稀释100倍,溶液中的c(OH-)减小
15.常温下,下列各溶液中水的电离程度最大的是
A.pH=1的硫酸溶液B.1 ml/L氯化钠溶液
C.0.01ml/L的烧碱溶液D.c(H+ )=10-2 ml/L的硫酸氢钠溶液
二、填空题
16.水的离子积
(1)表达式:Kw=c(H+)·c(OH-)
(2)影响因素
①水的电离是吸热过程。温度_______,水的离子积_______。
②室温下,Kw=c(H+)·c(OH-)=1.0×10-14;100℃下,Kw=c(H+)·c(OH-)=1.0×10-12
(3)若以c(H+)、c(OH-)为横、纵坐标,画出的图像如下:
17.某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:
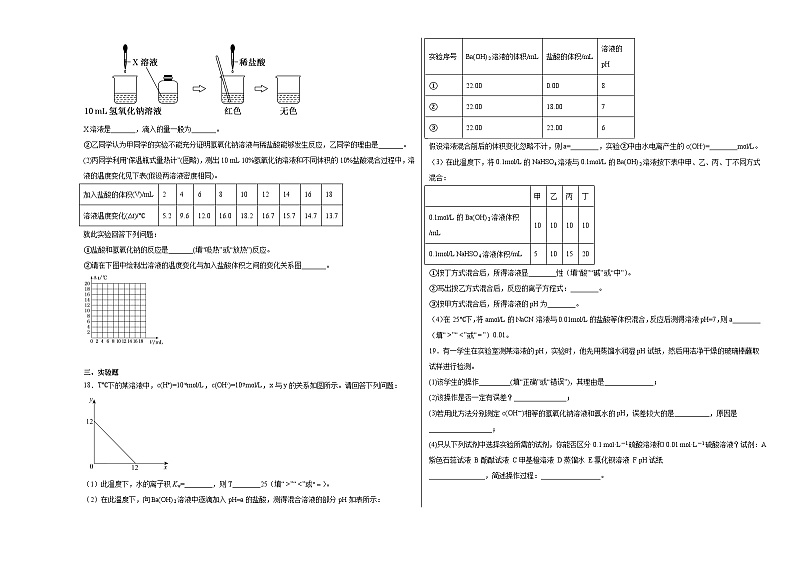
(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示实验。
X溶液是_______,滴入的量一般为_______。
②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是_______。
(2)丙同学利用“保温瓶式量热计”(图略),测出10 mL 10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
就此实验回答下列问题:
①盐酸和氢氧化钠的反应是_______(填“吸热”或“放热”)反应。
②请在下图中绘制出溶液的温度变化与加入盐酸体积之间的变化关系图_______。
三、实验题
18.T℃下的某溶液中,c(H+)=10-xml/L,c(OH-)=10-yml/L,x与y的关系如图所示。请回答下列问题:
(1)此温度下,水的离子积Kw=________,则T________25(填“”“”或)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示:
假设溶液混合前后的体积变化忽略不计,则a=________,实验②中由水电离产生的c(OH-)=________ml/L。
(3)在此温度下,将0.1ml/L的NaHSO4溶液与0.1ml/L的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
①按丁方式混合后,所得溶液显________性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:________。
③按甲方式混合后,所得溶液的pH为________。
(4)在25℃下,将aml/L的NaCN溶液与0.01ml/L的盐酸等体积混合,反应后测得溶液pH=7,则a________(填“”“”或“”)0.01。
19.有一学生在实验室测某溶液的pH,实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作_________(填“正确”或“错误”),其理由是______________;
(2)该操作是否一定有误差?_______________;
(3)若用此方法分别测定c(OH-)相等的氢氧化钠溶液和氨水的pH,误差较大的是__________,原因是__________________;
(4)只从下列试剂中选择实验所需的试剂,你能否区分0.1 ml·L-1硫酸溶液和0.01 ml·L-1硫酸溶液?试剂:A紫色石蕊试液 B酚酞试液 C甲基橙溶液 D蒸馏水 E氯化钡溶液 F pH试纸
________________,简述操作过程:_________________。
T/℃
0
10
20
25
40
50
100
Kw/10-14
0.114
0.292
0.681
1.00
2.92
5.47
55.0
加入盐酸的体积(V)/mL
2
4
6
8
10
12
14
16
18
溶液温度变化(Δt)/℃
5.2
9.6
12.0
16.0
18.2
16.7
15.7
14.7
13.7
实验序号
Ba(OH)2溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
甲
乙
丙
丁
0.1ml/L的Ba(OH)2溶液体积/mL
10
10
10
10
0.1ml/L NaHSO4溶液体积/mL
5
10
15
20
参考答案:
1.A
【详解】A.纯水中,在25℃、35℃时水的离子积常数分别为、,因此纯水中随着温度的升高而增大,故A项正确;
B.由水的电离方程式可知,纯水中,故B项错误;
C.化学反应平衡常数越大,说明反应进行程度越大,根据水的离子积常数可知,升高温度有利于水的电离,因此水的电离度,故C项错误;
D.升高温度促进水的电离,而升高温度平衡将向吸热反应方向移动,因此水的电离为吸热过程,故D项错误;
综上所述,正确的是A项。
2.A
【详解】A.0.005 ml·L-1的溶液中,=0.005 ml·L-1×2=0.01 ml·L-1, ,A正确;
B.0.001 ml·L-1的溶液中,=0.001 ml·L-1,,,B错误;
C.0.005 ml·L-1的溶液与0.01 ml·L-1的溶液等体积混合,溶液呈中性, ,C错误;
D.的H2SO4溶液=10-3 ml·L-1,pH=9的NaOH溶液,c(OH-)=10-3 ml·L-1,二者完全中和,需要溶液的体积相等,D错误;
故选A。
3.C
【详解】时,,该温度下溶液中,的溶液中,二者等体积混合后,混合溶液中,,。
4.B
【详解】A. 下蒸馏水的,所以,时,所以大于25,故A错误;
B. 由为2可知,,则,故B正确;
C. 将通入蒸馏水中,抑制水的电离,故C错误;
D. 因为,所以应加入等体积的溶液,才能使该溶液恰好呈中性,故D错误;
故选B。
5.D
【详解】A.呈中性,利用水的离子积可知,,A项错误;
B.,根据水的离子积可知,,B项错误;
C.溶液中,,C项错误;
D.两溶液混合后发生反应,因过量,故混合溶液中,则,D项正确;
答案选D。
6.D
【分析】时,纯水中由水电离产生的。
【详解】A.时,水电离产生的的溶液中水的电离受到抑制,故A错误;
B.酸、碱都抑制水电离,所以该溶液可能是酸溶液也可能是碱溶液,为12或2,故B错误;
C.酸、碱都抑制水电离,所以该溶液可能是酸溶液也可能是碱溶液,故C错误;
D.在酸性或碱性条件下,、、、都能大量共存,故D正确;
选D。
7.B
【详解】A.常温下,Kw= c(H+)×c(OH-)=1×10-14,所以纯水中的c(H+)=c(OH-)=1×10-7ml·L-1,A项正确;
B.向水中加入NaCl,由于Na+与水电离出的OH-或Cl-与水电离出的H+均不形成弱电解质,则不会破坏水的电离平衡,B项错误;
C.向水中加入HCl或者NaOH,增大了H+或OH-的浓度,即增大了生成物浓度,平衡逆向移动,C项正确;
D.水的电离为吸热反应,升高温度,平衡正向移动,Kw增大,反之,Kw减小,D项正确;
答案选B。
8.A
【详解】A.氯水中的见光易分解,应保存在棕色试剂瓶中,A正确;
B.新制氯水中含有,具有漂白性,能使试纸褪色,所以不能用试纸测定新制氯水的值,B错误;
C.氯气能和反应,使溶液的碱性降低,则红色褪去,而且新制氯水具有漂白性,C错误;
D.可以与盐酸发生氧化还原反应生成氯气,易发生中毒,故使用消毒时,不能用盐酸酸化,D错误;
故选A。
9.D
【详解】A.水的电离是吸热反应,温度升高电离平衡正向移动,c(H+)和c(OH-)都增大,由图可知,T2>T1,A错误;
B.Kw只受温度影响,温度不变,Kw不变,ade点都处于同一温度下,则三点的Kw相等,b点c(H+)和c(OH-)都大于a点的,由Kw=c(H+)∙c(OH-)可知,b点Kw大于c点大于a点,则Kw:b>c>a=d=e,B错误;
C.b→c点Kw变小,是降温导致的,在水中加入适量的CH3COONa(s)但温度不变,不能改变Kw,C错误;
D.T2时,Kw=c(H+)∙c(OH-)=10-6×10-6=10-12,pH=10的NaOH(aq)其c(OH-)=,pH=3的H2SO4(aq)其c(H+)=10-3ml/L,两者等体积混合,n(OH-)过量,则溶液呈碱性,D正确;
故选:D。
10.C
【详解】A.与能发生双水解反应,二者不能共存,A不符合题意;
B.的溶液呈酸性,酸性条件下,能氧化,二者不能共存,B不符合题意;
C.常温下,的溶液呈弱酸性,、、、可以大量共存,C符合题意;
D.常温下,水电离出的的溶液既可以为酸性溶液又可以为碱性溶液;酸性溶液中,S2-不能大量存在,碱性溶液中,不能大量存在,D不符合题意;
故选C。
11.C
【详解】A.Fe3+与SCN-结合生成配合物,不能共存,A不选;
B.常温下,= 10−13则氢离子浓度大于氢氧根离子浓度,溶液呈酸性,H+与F-结合成弱电解质HF,不能共存,B不选;
C.各种离子之间互不反应,能共存,C选;
D.酸或碱抑制水的电离,由水电离出的c(H+)=10-12ml/L的溶液可能是碱性或酸性,碱性溶液中:Mg2+、OH-不能共存,D不选;
故选:C。
12.C
【分析】25°C时,Kw=c(H+)·c(OH-)=1.0×10-14,某溶液中由水电离出的H+浓度为1.0×10-12ml·L-1,水电离出的H+和OH-浓度相等,据此分析解答。
【详解】A.若为酸溶液,则该溶液中OH-全部由水电离,则溶液中c(H+)==1.0×10-2ml/L,因此溶液的pH=-lgc(H+)=2,A正确;
B.若为碱溶液,则该溶液中H+全部由水电离,则溶液中碱电离出的c(OH-)=1.0×10-2ml/L,因此该溶液中碱电离出的c(OH-)与水电离出的c(OH-)之比为=1010,B正确;
C.该溶液可以呈酸性,也可以呈碱性,若该溶液中的溶质只有一种,不一定只是酸或碱,也可能是盐,C错误;
D.若该溶液呈碱性,S2-在该溶液中可以大量共存,D正确;
答案选C。
13.C
【详解】A.温度升高促进水的电离,水的离子积增大,A错误;
B.温度升高促进水的电离,水的离子积增大,但是氢离子浓度等于氢氧根离子浓度,呈中性,B错误;
C.水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,生成的氢离子和氢氧根离子浓度增大, pH减小,水的离子积增大,水中的,C正确;
D.水的电离是吸热过程,将纯水加热至较高温度,促进了水的电离,生成的氢离子和氢氧根离子浓度增大,水中的c(H+)=c(OH-),pH减小,呈中性,D错误;
故选C。
14.D
【详解】A.25℃时纯水中c(H+)=1×10-7ml/L,c(H+)=1×10-6ml/L说明促进了水的电离,故T>25℃,故A正确;
B.c(H+)=1×10-6ml/L,水的离子积常数为1×10-12,水的离子积常数=氢离子与氢氧根浓度的乘积,故由水电离出来的c(H+)=1×10-10ml/L,故B正确;
C.NaHSO4的电离生成氢离子,对水的电离起抑制作用,水的电离程度减小,故C正确;
D.温度不变时,Kw不变,加水稀释c(H+)减小,Kw=c(H+)×c(OH-),所以c(OH-)增大,故D错误;
故选:D。
15.B
【详解】酸或碱抑制水的电离,硫酸溶液、烧碱即NaOH溶液、硫酸氢钠溶液电离出氢离子或氢氧根离子都抑制水的电离,氯化钠溶液为中性溶液,水的电离程度最大,故选:B。
16. 升高 增大
【详解】水的电离为吸热过程,温度升高,水的电离平衡正向移动,水的离子积常数增大,故答案为:升高;增大。
17.(1) 酚酞 1~2滴 甲同学的实验不能说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应
(2) 放热
【详解】(1)①由题图知加入的指示剂在氢氧化钠溶液中呈红色,在酸性溶液中呈无色,故该试剂为酚酞;故X溶液是酚酞,滴入的量一般为1~2滴;
②甲同学的实验不能充分说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应;
(2)①结合表格中的数据可知,该反应为放热反应;
②温度变化与加入盐酸体积之间的关系图为。
18. 1×10-12ml2/L2 4 10-7 中 Ba2++OH-+H++=BaSO4↓+H2O 11
【分析】(1)根据Kw=c(H+)∙c(OH-)计算;
(2)根据OH-+H+=H2O及Kw=c(H+)∙c(OH-)计算
(3)根据OH-+H+=H2O判断;
(4)根据NaCN+HCl=HCN+NaCl可知,溶液为HCN、NaCl时,溶液显酸性,而NaCN显碱性,只有HCN、NaCl、NaCN混合时,显中性。
【详解】(1)此温度下,水的离子积Kw=c(H+)∙c(OH-)=10-xml/L×10-yml/L=1×10-12ml2/L2>10-14ml2/L2,升温促进水的电离,则T>25℃;
(2)由实验①可知,在此温度下,Ba(OH)2溶液的pH=8,c(OH-)==10-4ml/L,向22.00mL Ba(OH)2溶液中逐滴加入pH=a的盐酸22.00mL,所得溶液的pH=6,混合溶液呈中性,则盐酸中c(H+)=10-4ml/L,pH=a=4;实验②中溶液呈碱性,由水电离产生的c(H+)=c(OH-)=10-7ml/L;
(3)在此温度下,0.1ml/L的NaHCO3溶液中c(H+)=0.1ml/L,0.1ml/L的Ba(OH)2溶液中c(OH-)=0.2ml/L。
①按丁方式混合后,氢离子与氢氧根离子2:1反应,由于c(H+)=c(OH-),所以所得溶液显中性。
②按乙方式混合后,氢离子与氢氧根离子1:1反应,反应的离子方程式为Ba2++OH-+H++=BaSO4↓+H2O。
③按甲方式混合后,酸少量,OH-剩余,所得溶液中c(OH-)==0.1ml/L,c(H+)==1×10-11ml/L,故所得溶液的pH为11。
(4)NaCN+HCl=HCN+NaCl,若NaCN与HCl恰好完全反应生成HCN和NaCl,则HCN电离产生H+而使溶液呈酸性,只有反应剩余能够水解产生OH-的NaCN时,才可能使得反应后溶液pH=7,所以a>0.01。
19.(1) 错误 相当于将原溶液稀释
(2)该学生操作错误,但不一定产生误差。因为原溶液不是中性时,稀释后溶液pH发生了变化,只是弱酸或弱碱溶液变化程度小些;若是中性溶液,稀释不会产生误差
(3) 氢氧化钠溶液 稀释过程中,NH3·H2O继续电离出OH-,减弱了因稀释OH-浓度减小程度,所以测得氢氧化钠溶液误差较大
(4) 能 用玻璃棒分别蘸取两种溶液滴在两张pH试纸上,其显示的颜色与标准比色卡对照,pH较大的是0.01 ml·L-1硫酸溶液
【解析】(1)
用pH试纸测量溶液时,pH试纸不能润湿,否则相当于将原溶液稀释。
(2)
该学生操作错误,但不一定产生误差。因为原溶液不是中性时,稀释后溶液pH发生了变化,只是弱酸或弱碱溶液变化程度小些;若溶液呈酸性或碱性,稀释必然会造成测量数据错误,若溶液呈中性,则对结果无影响。
(3)
NH3·H2O是弱电解质,加水稀释时,促进它的电离,故对OH-浓度相等的氢氧化钠和氨水溶液来说,加水稀释相同倍数,氨水的pH减小程度小些,误差小些,原因为稀释过程中,NH3·H2O继续电离出OH-,减弱了因稀释OH-浓度减小程度,所以测得氢氧化钠溶液误差较大。
(4)
分别测定这两种硫酸溶液的pH,pH较小的是浓度较大的硫酸溶液,pH较大的是浓度较小的硫酸溶液,用玻璃棒分别蘸取两种溶液滴在两张pH试纸上,其显示的颜色与标准比色卡对照,pH较大的是0.01 ml·L-1硫酸溶液。
相关试卷
这是一份2022年高三化学寒假同步练习(含答案):18水的电离和溶液的酸碱性,共5页。
这是一份2022年高三化学寒假同步练习(含答案):15水的电离和溶液的酸碱性,共5页。
这是一份2022年高三化学寒假同步练习(含答案):14水的电离和溶液的酸碱性,共4页。










