

- 备战2025届新高考化学一轮总复习分层练习第6章化学反应与能量第33讲多池或多室电化学装置及分析(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第7章化学反应速率与化学平衡第34讲化学反应速率及影响因素(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第7章化学反应速率与化学平衡第36讲化学平衡常数及转化率(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第7章化学反应速率与化学平衡第37讲化学反应的方向与调控(附解析) 试卷 0 次下载
- 备战2025届新高考化学一轮总复习分层练习第7章化学反应速率与化学平衡第38讲化学反应速率和平衡图像(附解析) 试卷 0 次下载
备战2025届新高考化学一轮总复习分层练习第7章化学反应速率与化学平衡第35讲化学平衡状态及平衡移动(附解析)
展开1.(2023·广东梅州联考)下列事实中,不能用勒夏特列原理解释的是( )
A.开启啤酒瓶后,马上泛起大量泡沫
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
2.(2023·广东韶关检测)在一密闭容器中,反应aM(g)bN(g)达到平衡后,保持温度不变,将容器容积增加一倍,当达到新的平衡时,N的浓度变为原来的60%,则( )
A.平衡向正反应方向移动
B.物质M的转化率变小
C.反应的化学平衡常数变大
D.a、b的大小关系是a>b
3.(2023·广东广州检测)在恒容的密闭容器中,CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g)CH3OH(g) ΔH<0。能说明该反应达到平衡状态的是( )
A.混合气体的密度不再变化
B.CO和H2的物质的量之比不再变化
C.2v正(H2)=v逆(CH3OH)
D.CO在混合气体中的质量分数保持不变
4.(2023·广东湛江检测)向绝热恒容密闭容器中通入一定量的SO2和NO2,一定条件下发生反应:SO2(g)+NO2(g)SO3(g)+NO(g),正反应是放热反应。测得SO3浓度随时间变化如表所示,下列说法不正确的是( )
A.50 s时,SO3的生成速率为0.002 8 ml·L-1·s-1
B.40~90 s时段:v(正)>v(逆)
C.v正(SO2)=v逆(SO3)或v正(SO2)=v逆(NO2)均能说明反应达到平衡状态
D.100 s开始,容器中的温度不变,反应达到平衡状态
5.一定温度下,容积不变的密闭容器中发生反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),经2 min后达到平衡,NH3的浓度减少了0.6 ml·L-1。下列说法正确的是( )
A.平衡时5v正(O2)=4v逆(NO)
B.2 min末的反应速率,用NO表示是0.3 ml·L-1·min-1
C.由混合气体的密度不再改变可判定反应达到平衡
D.由混合气体的压强不再改变可判定反应达到平衡
6.(2023·广东梅州期末)某温度下,在一恒容密闭容器中进行如下两个反应并达到平衡:
①2X(g)+Y(g)Z(s)+2Q(g) ΔH1<0
②M(g)+N(g)R(g)+Q(g) ΔH2>0
下列叙述错误的是( )
A.加入适量Z,①和②平衡均不移动
B.通入稀有气体Ar,①平衡正向移动
C.降温时无法判断Q浓度的增减
D.通入气体Y,则N的转化率减小
7.(1)工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷)CH4(g)+C3H6(g) ΔH1
反应2:C4H10(g,正丁烷)C2H6(g)+C2H4(g) ΔH2
某温度下,向2 L恒容密闭容器中投入2 ml正丁烷,假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为。下列情况表明上述反应达到平衡的是 (填字母,下同)。
A.混合气体的密度保持不变
B.甲烷、丙烯的生成速率相等
C.混合气体压强保持不变
D.丙烯的体积分数保持不变
(2)深入研究碳、氮元素的物质转化有着重要的实际意义,合成尿素的反应为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l) ΔH=-87.0 kJ·ml-1。
若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是 。
A.断裂6 ml N—H的同时断裂2 ml O—H
B.压强不再变化
C.混合气体的密度不再变化
D.CO2的体积分数不再变化
(3)反应:4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),恒温恒容情况下,下列说法能判断此反应达到平衡的是 。
A.气体物质中氮元素与氧元素的质量比不变
B.容器内气体密度不变
C.容器内气体颜色不变
D.容器内NaNO3的浓度保持不变
层次2综合性
8.可逆反应mA(g)+nB(?)pC(g)+qD(?)中A和C都是无色气体,当达到平衡后,下列叙述正确的是( )
A.若改变条件后,平衡正向移动,D的百分含量一定增大
B.若升高温度,A的浓度增大,说明正反应是吸热反应
C.若增大压强,平衡不移动,说明m+n一定等于p+q
D.若增加B的量,平衡移动后体系颜色加深,说明B必是气体
9.已知:2H2S(g)+O2(g)S2(s)+2H2O(g) ΔH=-Q kJ·ml-1(Q>0)。T℃时,在容积为2 L的恒容密闭容器中,起始加入2 ml H2S(g)和1 ml O2(g),达到平衡时生成0.6 ml S2(s)。下列说法能说明反应达到平衡状态的是( )
A.硫化氢的浓度是氧气浓度的2倍
B.容器中混合气体的压强不变
C.反应放出的热量为0.3Q kJ
D.消耗2 ml H2S(g)的同时生成2 ml H2O(g)
10.(2024·湖南长沙高三模拟)臭氧分解反应2O3(g)3O2(g)中O3的消耗速率可表示为v(O3)=k(k为常数,仅与温度有关),恒温密闭容器中投入一定量O3,一段时间后达到化学平衡状态,下列说法正确的是( )
A.平衡时有2v(O2)=3v(O3)
B.容积不变,向平衡体系中充入O2,再次达到平衡,O2的体积分数变大
C.容积不变,分离出O2时,O3的消耗速率不发生变化
D.压强不变,充入气体Ne,平衡将不发生移动
11.用O2将HCl转化为Cl2的反应为4HCl(g)+O2(g)2Cl2(g)+2H2O(g) ΔH<0。在恒温恒容条件下测得反应过程中c(Cl2)的实验数据如表。下列说法错误的是( )
A.2~6 min用Cl2表示的化学反应速率为0.9 ml·L-1·min-1
B.当容器内气体的平均摩尔质量不变时,可说明反应达到化学平衡状态
C.化学平衡常数:K(200 ℃)>K(400 ℃)
D.增大压强,可以提高HCl的平衡转化率
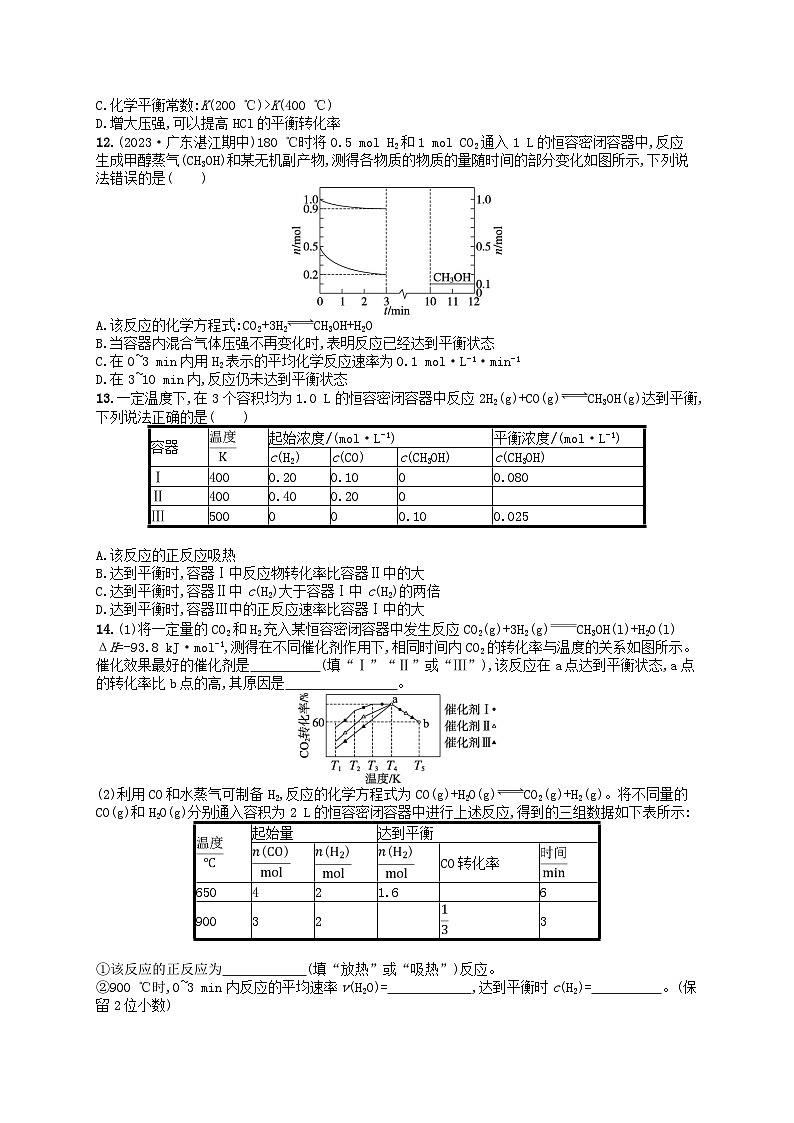
12.(2023·广东湛江期中)180 ℃时将0.5 ml H2和1 ml CO2通入1 L的恒容密闭容器中,反应生成甲醇蒸气(CH3OH)和某无机副产物,测得各物质的物质的量随时间的部分变化如图所示,下列说法错误的是( )
A.该反应的化学方程式:CO2+3H2CH3OH+H2O
B.当容器内混合气体压强不再变化时,表明反应已经达到平衡状态
C.在0~3 min内用H2表示的平均化学反应速率为0.1 ml·L-1·min-1
D.在3~10 min内,反应仍未达到平衡状态
13.一定温度下,在3个容积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)达到平衡,下列说法正确的是( )
A.该反应的正反应吸热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅰ中c(H2)的两倍
D.达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
14.(1)将一定量的CO2和H2充入某恒容密闭容器中发生反应CO2(g)+3H2(g)CH3OH(l)+H2O(l) ΔH=-93.8 kJ·ml-1,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的关系如图所示。催化效果最好的催化剂是 (填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是 。
(2)利用CO和水蒸气可制备H2,反应的化学方程式为CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入容积为2 L的恒容密闭容器中进行上述反应,得到的三组数据如下表所示:
①该反应的正反应为 (填“放热”或“吸热”)反应。
②900 ℃时,0~3 min内反应的平均速率v(H2O)= ,达到平衡时c(H2)= 。(保留2位小数)
层次3创新性
15.乙烯是石油化工最基本的原料之一。
(1)在乙烷中引入O2可以降低反应温度,减少积碳。涉及如下反应:
a.2C2H6(g)+O2(g)2C2H4(g)+2H2O(g) ΔH1<0
b.2C2H6(g)+5O2(g)4CO(g)+6H2O(g) ΔH2<0
c.C2H4(g)+2O2(g)2CO(g)+2H2O(g) ΔH3<0
氧气的引入可能导致过度氧化。为减少过度氧化,需要寻找催化剂降低反应 (填“a”“b”或“c”)的活化能,判断的依据是 。
(2)常压下,在某催化剂作用下按照n(C2H6)∶n(O2)=1∶1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
①乙烯的物质的量百分数随温度升高而降低的原因是 。
②在570~600 ℃温度范围内,下列说法正确的是 (填字母)。
A.C2H4产率随温度升高而增大
B.H2O的含量随温度升高而增大
C.C2H6在体系中的物质的量百分数随温度升高而增大
D.此催化剂的优点是在较低温度下降低CO的平衡产率
第35讲 化学平衡状态及平衡移动
1.B 解析 开启啤酒瓶后,压强减小,平衡向生成气体的方向移动,马上泛起大量泡沫,可以用勒夏特列原理解释,A不符合题意;在配制硫酸亚铁溶液时往往要加入少量铁粉,可以防止亚铁离子被氧化,与化学平衡无关,不能用勒夏特列原理解释,B符合题意;实验室制取氯气,用排饱和食盐水法收集氯气时,c(Cl-)增大,可以使平衡Cl2+H2OH++Cl-+HClO逆向移动,可以用勒夏特列原理解释,C不符合题意;工业上生产硫酸的过程中发生反应:2SO2+O22SO3,使用过量的空气,c(O2)增大,平衡正向移动,以提高二氧化硫的转化率,可以用勒夏特列原理解释,D不符合题意。
2.A 解析 在一密闭容器中,反应aM(g)bN(g)达到平衡后,保持温度不变,将容器容积增加一倍,此时N的浓度变为原来的50%,当达到新的平衡时,N的浓度变为原来的60%,则表明平衡向生成N的方向移动。由分析可知,增大体积,减小压强,平衡向生成N的方向移动,则平衡向正反应方向移动,A正确;减小压强,平衡向正反应方向移动,物质M的转化率增大,B不正确;在压强减小过程中,温度保持不变,则反应的化学平衡常数不变,C不正确;减小压强,平衡向气体分子数增大的方向(正反应方向)移动,则a、b的大小关系是a
4.A 解析 50s内,v(SO3)==0.0028ml·L-1·s-1,不能计算50s时的瞬时速率,A错误;40~90s时段,此时反应未达平衡,反应正向进行,v(正)>v(逆),B正确;v(正)=v(逆)时,反应达平衡状态,v正(SO2)=v逆(SO3)或v正(SO2)=v逆(NO2)均能说明反应达到平衡状态,C正确;该反应是放热反应,100s开始,容器中的温度不变,说明反应达到平衡状态,D正确。
5.D 解析 平衡时,4v正(O2)=5v逆(NO),A项错误;0~2min内的平均反应速率,用NO表示是=0.3ml·L-1·min-1,B项错误;容器容积不变,气体总质量不变,所以混合气体的密度始终不变,C项错误;该反应为气体分子数增大的反应,容器容积不变,温度不变,混合气体的压强是变量,当混合气体的压强不变时,说明反应达到平衡状态,D项正确。
6.B 解析 Z是固体,加入适量Z,不会改变①和②中反应物和生成物的浓度,①和②平衡均不移动,A正确;恒容密闭容器中通入稀有气体Ar,气体浓度不发生改变,反应①的平衡不移动,B错误;反应①是放热反应,反应②是吸热反应,温度降低,反应①正向进行,反应②逆向进行,但两个反应中反应物的起始浓度未知,故无法判断Q浓度的增减,C正确;通入气体Y,反应①平衡正向移动,Q的浓度增大,导致反应②平衡逆向进行,则N的转化率减小,D正确。
7.答案 (1)CD (2)A (3)ABC
解析 (1)气体密度等于气体质量除以容器容积,反应1的反应物和生成物都是气体,气体质量不变,容器容积不变,因此在恒温恒容条件下气体密度始终不变,因此密度不变不能作为判断平衡的标志,故A不符合题意;甲烷、丙烯均属于生成物,两者的化学计量数相同,无论是否达到平衡,它们的生成速率始终相等,故B不符合题意;在恒容恒温下,气体分子数逐渐增多,气体压强逐渐增大,当压强不变时反应达到平衡,故C符合题意;丙烯体积分数由0逐渐增大,丙烯体积分数不变时表明反应达到平衡,故D符合题意。
(2)根据方程式可知:每2分子NH3反应产生1分子CO(NH2)2,会断裂2个N—H,即1个NH3分子断裂1个N—H。现在断裂6mlN—H,就是6mlNH3反应,要生成3mlH2O,形成6mlO—H;断裂2mlO—H,就是1ml水发生反应,生成水的物质的量大于消耗水的物质的量,正、逆反应速率不相等,没有达到平衡,A符合题意;该反应在恒温恒容条件下进行,反应前后气体的物质的量发生改变,当气体压强不再变化时,气体的物质的量不变,则反应达到了平衡状态,B不符合题意;反应前后气体的质量发生变化,而反应在恒温恒容条件下进行,气体的体积不变,则混合气体的密度不再变化,说明反应达到了平衡状态,C不符合题意;若CO2的体积分数不再变化,说明混合气体中各气体的物质的量不变,反应达到了平衡状态,D不符合题意。
(3)反应物NO2中氮元素与氧元素的质量比为7∶16,生成物NO中氮元素和氧元素的质量比为7∶8,所以未平衡前气体物质中氮元素和氧元素的质量比是变量,当气体物质中氮元素与氧元素的质量比不变时,反应达到了平衡,故A选;随着反应的进行,气体物质的质量在减小,而容器容积不变,所以混合气体的密度在减小,当容器内气体密度不变时,反应达到了平衡,故B选;NO2是红棕色气体,Cl2是黄绿色气体,未平衡前混合气体的颜色在改变,当容器内气体颜色不变时,说明NO2和Cl2的浓度均不再改变,反应达到了平衡,故C选;NaNO3是固体,不能用固体浓度不变衡量反应是否达到平衡,故D不选。
8.D 解析 若改变条件后,平衡正向移动,D的百分含量不一定增大,因为B的状态不确定,故A错误;若升高温度,A的浓度增大,说明逆反应是吸热反应,故B错误;若增大压强,平衡不移动,如果B、D均为气体,则说明m+n一定等于p+q,如果B、D均不为气体,则m=p,故C错误;固体和液体的用量不影响平衡,若增加B的量,平衡移动后体系颜色加深,说明B必是气体,故D正确。
9.B 解析 硫化氢的浓度为氧气的2倍,不能说明反应达到平衡,A项错误;该反应是反应前后气体分子数不相等的反应,恒容容器中混合气体的压强不变,说明各气体的物质的量不变,反应达到平衡,B项正确;反应达到平衡时,生成0.6mlS2(s),消耗的H2S为1.2ml,反应放出0.6QkJ热量,故反应放出0.3QkJ热量时,未达到平衡,C项错误;根据已知热化学方程式可知,任何时间段,消耗2mlH2S(g)的同时一定生成2mlH2O(g),且可逆反应不能进行到底,D项错误。
10.A 解析 根据反应进行中反应速率之比等于化学计量数之比,即,2v(O2)=3v(O3),平衡时当然也存在2v(O2)=3v(O3),故A正确;该反应为分子数增大的反应,容积不变,向平衡体系中充入O2,体系压强增大,平衡逆向移动O2含量减少,再次达到平衡,O2的体积分数减小,故B错误;容积不变,分离出O2时,根据O3的消耗速率表达式,v(O3)=k,O3的消耗速率会随着O2的浓度减小而增大(改变生成物的浓度暂时对正反应速率没有影响仅适用于基元反应或速率方程与生成物无关的反应,显然这个反应不适用),故C错误;压强不变,充入气体Ne,容器容积将增大,平衡将正向移动,故D错误。
11.A 解析 2~6minc(Cl2)由1.8×10-3ml·L-1增大到5.4×10-3ml·L-1,则有v(Cl2)==9×10-4ml·L-1·min-1,A错误;恒温恒容时,平衡建立过程中,混合气体的总质量不变,气体的总物质的量不断变化,则气体的平均摩尔质量不断变化,当容器内气体的平均摩尔质量不变时,该反应达到化学平衡状态,B正确;该反应的ΔH<0,升高温度,平衡逆向移动,平衡常数K减小,则平衡常数:K(200℃)>K(400℃),C正确;该反应的正反应为气体分子数减小的反应,增大压强,平衡正向移动,则HCl的平衡转化率增大,D正确。
12.D 解析 将0.5mlH2和1mlCO2通入1L的恒容密闭容器中,反应生成甲醇蒸气(CH3OH)和某无机副产物,0~3min内消耗的CO2与H2物质的量之比为(1.0ml-0.9ml)∶(0.5ml-0.2ml)=1∶3,由原子守恒可知副产物为水,由原子守恒可知反应方程式为CO2+3H2CH3OH+H2O,A正确;该反应是反应前后气体体积不相等的反应,反应在恒容密闭容器中进行,当混合气体压强不再变化时,表明反应已经达到平衡状态,B正确;0~3min内,参加反应的CO2为0.1ml,根据物质转化关系可知反应消耗0.3mlH2,则0~3min内H2的平均反应速率为v(H2)==0.1ml·L-1·min-1,C正确;0~3min内生成的甲醇物质的量为0.1ml,则3min时甲醇物质的量为0.1ml,10min时甲醇物质的量也为0.1ml,在3~10min内反应处于平衡状态,D错误。
13.D 解析 对比容器Ⅰ和Ⅲ可知两者投料量相当,若温度相同,最终两者等效,但Ⅲ温度高,平衡时c(CH3OH)小,说明平衡向逆反应方向移动,即逆反应为吸热反应,正反应为放热反应,A错误;Ⅱ相对于Ⅰ成比例增加投料量,相当于加压,平衡正向移动,转化率提高,所以Ⅱ中转化率高,B错误;温度相同,Ⅱ中投料量是Ⅰ的两倍,相当于加压,平衡正向移动,所以平衡时Ⅱ中c(H2)小于Ⅰ中c(H2)的两倍,C错误;由容器Ⅲ中数据可得,平衡时c(H2)=0.15ml·L-1、c(CO)=0.075ml·L-1,容器Ⅰ平衡时c(H2)=0.04ml·L-1、c(CO)=0.02ml·L-1,温度:Ⅲ>Ⅰ,所以达到平衡时,容器Ⅲ中正反应速率比容器Ⅰ中的大,D正确。
14.答案 (1)Ⅰ 该反应为放热反应,温度升高,平衡逆向移动
(2)①放热 ②0.17 ml·L-1·min-1 0.50 ml·L-1
解析 (1)由图像可知催化剂Ⅰ的催化效果最佳;该反应为放热反应,达到平衡后,随温度升高,平衡逆向移动,CO2的转化率降低。
(2)①650℃时,根据三段式进行计算:
CO(g) + H2O(g) CO2(g) + H2(g)
起始/ml4200
转化/ml1.61.61.61.6
平衡/ml2.40.41.61.6
故650℃时,平衡时CO转化率为1.6÷4=0.4>,即温度越高,CO平衡转化率越低,故该反应的正反应为放热反应。②900℃时,结合CO的平衡转化率,根据三段式进行有关计算:
CO(g) + H2O(g) CO2(g) + H2(g)
起始/ml3200
转化/ml1111
平衡/ml2111
0~3min内v(H2O)=≈0.17ml·L-1·min-1,平衡时c(H2)==0.50ml·L-1。
15.答案 (1)a 制备的目标产品是C2H4,b、c均为副反应,应加快反应a的反应速率
(2)①反应a、c是放热反应,升高温度,a反应平衡逆向移动程度较大 ②BD
解析 (2)①分析反应a、c都为放热反应,升高温度,两者反应平衡均逆向移动,但反应a平衡逆向移动的程度较大,则乙烯的物质的量百分数降低。②根据图中信息,C2H4产率随温度升高而降低,故A错误;乙烷转化率增大,生成水的量增大,而乙烯量减小,说明发生反应c,水的量增大,因此H2O的含量随温度升高而增大,故B正确;根据图中信息C2H6转化率增大,则C2H6在体系中的物质的量百分数随温度升高而降低,故C错误;根据图中信息,CO在较高温度时含量较大,因此该催化剂的优点是在较低温度下降低CO的平衡产率,故D正确。反应时间/s
40
50
60
70
0.10
0.14
0.21
0.26
反应时间/s
80
90
100
110
0.30
0.32
0.33
0.33
t/min
0
2
4
6
c(Cl2)/(10-3 ml·L-1)
0
1.8
3.7
5.4
容器
起始浓度/(ml·L-1)
平衡浓度/(ml·L-1)
c(H2)
c(CO)
c(CH3OH)
c(CH3OH)
Ⅰ
400
0.20
0.10
0
0.080
Ⅱ
400
0.40
0.20
0
Ⅲ
500
0
0
0.10
0.025
起始量
达到平衡
CO转化率
650
4
2
1.6
6
900
3
2
3
2025届高考化学一轮总复习真题演练第8章化学反应速率与化学平衡第39讲化学平衡状态化学平衡的移动: 这是一份2025届高考化学一轮总复习真题演练第8章化学反应速率与化学平衡第39讲化学平衡状态化学平衡的移动,共2页。
2024届高考化学一轮复习练习第七章化学反应速率与化学平衡第35讲化学平衡移动原理: 这是一份2024届高考化学一轮复习练习第七章化学反应速率与化学平衡第35讲化学平衡移动原理,共20页。
2025版高考化学一轮总复习真题演练第7章化学反应速率和化学平衡第24讲化学平衡状态及平衡移动: 这是一份2025版高考化学一轮总复习真题演练第7章化学反应速率和化学平衡第24讲化学平衡状态及平衡移动,共4页。试卷主要包含了掌握一个原理,明确两个解题技巧等内容,欢迎下载使用。












