
广东省湛江市2024届高三下学期一模化学试卷(含答案)
展开一、单选题
1.“葡萄美酒夜光杯,欲饮琵琶马上催”。下列中国酒具中,主要由硅酸盐材料制成的是( )
A.AB.BC.CD.D
2.近年来,我国科技迅猛发展,下列科技成果中所蕴含的化学知识叙述不正确的是( )
A.在“人造太阳”中发生核聚变的是的同位素
B.华为麒麟芯片的主要成分是单质硅
C.歼-20战斗机采用大量先进复合材料、石墨烯材料等,其中石墨烯材料属于有机高分子材料
D.“奋斗者”号载人潜水器球壳所使用的钛合金能承受深海高压
3.化学让生活变得更美好。下列化学物质的应用说法正确的是( )
A.牡蛎、虾类等海洋产品均为高蛋白食物,可为人体补充多种氨基酸
B.碳酸钠可作为膨松剂,用来制作糕点
C.甘油是护肤品中常见的成分,不溶于水,可用于隔绝水分,起到保湿、保润作用
D.医学上常用体积分数为95%的乙醇溶液杀菌消毒
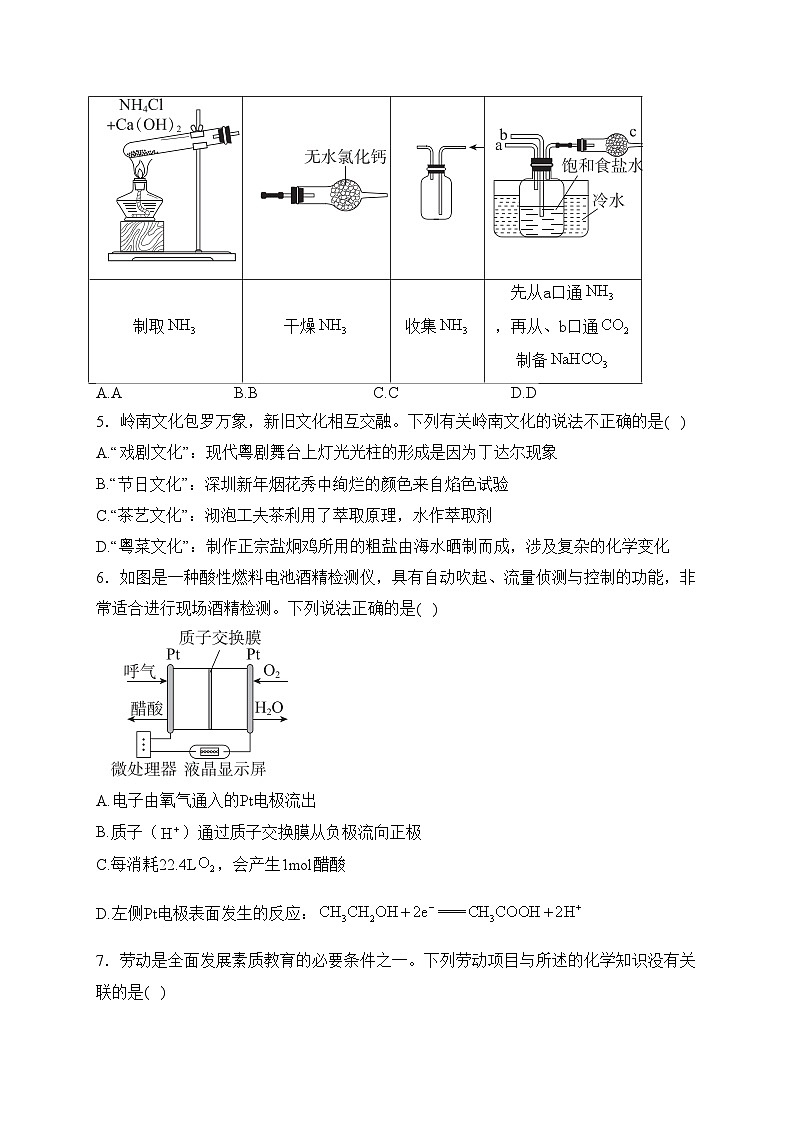
4.是一种广泛应用于工业、农业和医药领域的重要化工气体,下列有关氨气的实验中,能达到实验目的的是( )
A.AB.BC.CD.D
5.岭南文化包罗万象,新旧文化相互交融。下列有关岭南文化的说法不正确的是( )
A.“戏剧文化”:现代粤剧舞台上灯光光柱的形成是因为丁达尔现象
B.“节日文化”:深圳新年烟花秀中绚烂的颜色来自焰色试验
C.“茶艺文化”:沏泡工夫茶利用了萃取原理,水作萃取剂
D.“粤菜文化”:制作正宗盐炯鸡所用的粗盐由海水晒制而成,涉及复杂的化学变化
6.如图是一种酸性燃料电池酒精检测仪,具有自动吹起、流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法正确的是( )
A.电子由氧气通入的Pt电极流出
B.质子()通过质子交换膜从负极流向正极
C.每消耗22.4L,会产生1ml醋酸
D.左侧Pt电极表面发生的反应:
7.劳动是全面发展素质教育的必要条件之一。下列劳动项目与所述的化学知识没有关联的是( )
A.AB.BC.CD.D
8.绿原酸(结构如图)是金银花中富含的一类酚类化合物,具有抗菌、保肝、消炎、解热的作用。下列关于绿原酸的说法不正确的是( )
A.能发生加成反应
B.1ml绿原酸最多能与8mlNaOH完全反应
C.能使溴水和酸性溶液褪色
D.能与氨基酸和蛋白质中的氨基反应
9.制备并检验性质的装置如图所示。下列说法正确的是( )
A.紫色石蕊试纸先变红后褪色
B.品红溶液褪色体现了的强氧化性
C.用98%浓硫酸代替70%浓硫酸能加快反应速率
D.棉花可用饱和溶液浸泡,用于尾气处理
10.部分含Fe物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.可存在a+e→b的转化
B.e溶液可与KSCN溶液反应生成红色沉淀
C.能用a制作的容器运输浓硫酸
D.a可与稀硝酸恰好反应生成只含b的溶液
11.设为阿伏加德罗常数的值。下列关于钠及其化合物的叙述正确的是( )
A.1mlNa在空气中受热完全转化成转移电子数目为2
B.0.1溶液中所含的数目小于0.1
C.与反应的过程中涉及离子键、极性共价键和非极性共价键的断裂
D.Al与NaOH溶液的反应中NaOH作氧化剂
12.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是( )
A.AB.BC.CD.D
13.我国某科研团队设计了一种新型能量存储/转化装置。闭合、断开时,制氢并储能;断开、闭合时,供能。已知与的性质相似。下列说法正确的是( )
A.连接时,X电极发生还原反应
B.连接时,溶液pH不变
C.连接时,Zn电极表面生成沉淀
D.该装置能直接将光能转化成化学能
14.化合物是一种常见的复合肥。所含的4种元素均为前20号元素每个周期都有。Y的基态原子价层p轨道半充满,X最常见的同位素没有中子,M在地壳中含量最多。下列说法正确的是( )
A.元素电负性:M>Z>X
B.简单氢化物的熔点:Z>Y>M
C.第一电离能:X>Z>Y
D.为极性分子
15.在处理汽车尾气的三元催化剂中,Rh的主要作用是消除,Pd的主要作用是消除CO,部分催化机理及能量变化如图所示。下列说法不正确的是( )
A.在NO和CO的整个反应过程中步骤ⅲ是决速步骤
B.反应进行的三步分别是放热反应、放热反应和吸热反应
C.第一步反应:
D.CO能促进NO转化成
16.已知:常温下,碳酸的电离平衡常数。常温下,向溶液中缓慢滴加盐酸,溶液中各离子的物质的量浓度(不含和)随加入盐酸的体积的变化如图所示。
下列说法不正确的是( )
A.曲线为的物质的量浓度变化曲线
B.滴加至A点时,溶液pH约为10.32
C.滴加至C点时,溶液中
D.滴加至D点时,溶液中存在
二、实验题
17.标准溶液是氧化还原反应中常用的还原性标定试剂,但是固体通常含有一些杂质,且易风化和潮解,溶液也容易被O:氧化。因此,标准溶液配制好后常用进行标定。但是由于与反应的产物有很多种,不能按确定的反应式进行,故无法通过氧化还原滴定法确定浓度。故应先用与过量的KI反应,定量生成,再用滴定,发生反应的化学方程式为:、。我们将这种与联用的方法称为碘量法,碘量法是分析化学中常用的分析方法,常用于一些无法直接滴定的反应的物质的间接滴定。已知:与KI的反应需要一定时间才能进行得比较完全,故需放置约5min。
(1)标准溶液的配制:
①配制480mL0.1ml/L的标准溶液需要用到的玻璃仪器有:玻璃棒、烧杯、量筒、胶头滴管、_________。
②将下述实验步骤A到F按实验过程先后次序排列_________。
(2)标准溶液的标定:取溶液于250mL锥形瓶中,加5ml.6ml/LHCl溶液,再加入10mL,100g/LKI溶液,摇匀后用牛皮纸扎紧瓶口,静置约5分钟。用溶液滴定至浅黄色后加入2mL淀粉指示剂,继续滴定至终点,平行测定3次,计算标准溶液的浓度。
①用______量取溶液。
②加入KI摇匀后用牛皮纸扎紧瓶口的目的是______。
③如何判定滴定结束?______。
④列式并计算标准溶液的浓度。
(3)借鉴(2)的方法,用碘量法测量溶液的物质的量浓度:量取25.00mL待测液于250mL锥形瓶中,加入2ml/L溶液25mL,再加入10%KI溶液10mL,然后用已知浓度的溶液滴定到淡黄色,加0.5%的淀粉溶液3mL,用溶液继续滴定至终点。
①滴定时需加入硫酸。能否用盐酸代替硫酸,为什么?______。
②写出溶液与KI反应的离子方程式______。
(4)借鉴(3)的方法,某小组用碘量法测量磷酸铁锂溶液中的物质的量浓度。
提出问题:与是可逆反应,的存在是否会影响滴定?
实验验证:①在磷酸铁锂溶液中加入过量的KI,静置一段时间后,加入KSCN,观察到溶液颜色变红;请写出与反应的离子方程式:_______。
②取标准量的磷酸铁锂溶液,分成两组.其中一组加入过量的KI溶液,另一组加入等量的水。再分别使用溶液进行标定,发现消耗的溶液体积相同。
实验小结:是否会影响滴定:_______。
三、填空题
18.镓(Ga)是重要的半导体材料,氮化镓、砷化镓和氧化镓分别是第二代、第三代、第四代半导体材料的代表材料。金属镓在自然界中通常以微量分散于铝土矿、闪锌矿等矿石中,提取非常困难。从闪锌矿渣中提取镓是种常见的方法,具体工艺流程如下:
已知:①金属镓在化学性质上非常接近金属铝,其单质、氧化物和氢氧化物均有两性;
②闪锌矿渣通常含有、硅酸盐等杂质;
③25℃时,。
回答下列问题:
(1)为了提高镓的浸取率,可以采取的措施为____(填写一种)。
(2)滤渣工中主要含有____。
(3)写出加入氧化锌后发生反应的离子方程式(以Ga为例):____。
(4)工业上通常向溶液中通入过量,产生大量白色沉淀,过滤后加热固体能得到高纯,写出加入过量后的化学方程式:____。
(5)在工业上,通常用高纯镓作阴极,石墨作阳极,溶液作为电解质,通过电解制备高纯Ga。写出阴极电极反应式:______。
(6)氨化镓是目前应用最广泛的半导体材料之一,目前广泛应用于相控阵雷达、快速充电器等行业。氨化镓有不同的晶型,其中六方氮化镓和立方氮化镓之间可以
相互转化。
①六方氮化镓晶体硬度极高,熔点为1700℃,其高温熔融物不导电。六方氮化镓属于________晶体。
②写出六方氮化镓晶胞的组成:________。
(7)①已知的坐标为(,0,),请写出的坐标________。
②若立方氮化镓的边长为anm,则其密度为________(列出计算式)。
19.是重要的化工原料,在生产和生活中都发挥着重要作用。
(1)配合物广泛存在于自然界,其中能与形成深蓝色溶液。
①基态的3d电子轨道表示式为___。
②的配位原子是___,氨气中H-N-H的键角小于配合物中H-N-H的键角,其原因是___。
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
Ⅰ.
Ⅱ.
①反应_____。
②不同温度下氨催化氧化的平衡常数如下();
下列说法正确的是____。
A.如果对反应不加控制,氨和氧气反应的最终产物主要是
B.为使反应有利于向生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
C.在实际生产中,需采用高压氧化,以利于提高NO的产率
D.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
(3)已知可通过下列方法合成尿素:
第一步:
第二步:
在体积为5L的密闭容器中加入1ml和4ml,在一定条件下反应进行到10min时,测得和尿素的物质的量均为0.25ml,15min后,测得的物质的量为0.1ml,如图所示。
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成(1)(氨基甲酸铵)的平均反应速率为_____。
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比
较明显,但氨气和二氧化碳的物质的量基本不变,其主要原因是第一步反应的平衡常数=______(列出算式即可)。
20.莫西赛利(化合物K)是一种治疗心脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。以下为其合成路线之一:
已知:的结构为。
回答下列问题:
(1)化合物A的名称是________。化合物1的分子式为________。
(2)写出催化王生成化合物G的反应方程式________。
(3)根据化合物a的结构特征,分析预测其可能的化学性质,完成下表。
(4)下列说法中,不正确的有_______。
A.反应A→B过程中,有C-Br键和H-O键断裂
B.反应G→I过程中,苯环直接连接的N原子由杂化变成sp杂化
C.产物K中不存在手性碳原子
D.CO属于极性分子,分子中存在由p轨道“头碰头”形成的键
(5)在B的同分异构体中,同时满足下列条件的共有_______种(不考虑立体异构):
①含有苯环;②苯环上二取代;③遇氯化铁溶液显紫色,其中,含有手性碳的同分异构体的结构简式为_______(写出一种)。
参考答案
1.答案:D
解析:青铜属于合金,犀角和斫木的主要成分属于天然有机物。陶瓷的主要成分是硅酸盐。故选D。
2.答案:C
解析:石墨烯属于无机非金属材料,C项错误,
3.答案:A
解析:牡蛎、虾类等海洋食物产品富含蛋白质,可为人体补充多种氨基酸,A项正确;用来制作糕点的膨松剂为碳酸氢钠,B项错误;甘油含有亲水基团,易溶于水,C项错误;医学上常用体积分数为75%的乙醇溶液杀菌消毒,D项错误。
4.答案:D
解析:加热固体制备气体时,试管口应略向下倾斜,A项错误;不能用无水氯化钙干燥,B项错误;密度比空气小,应用向下排空气法收集。C项错误;在水中溶解度较大。在水中溶解度较小,制备时先通再通。D项正确。
5.答案:D
解析:由海水晒制粗盐过程主要涉及的是物理变化,D项错误,
6.答案:B
解析:由图可知,氧气通入的P电极做电池正极,电子流入正极。A项错误;电池工作时。质子B()通过质子交换膜从负极流向正极,B项正确;不是标准状况下。的物质的量无法判断,C项错误;左侧Pt电极表面发生的反应为,D项错误。
7.答案:C
解析:碳酸钠在水中水解,溶液呈碱性,可使油脂发生水解,A项正确;在酿酒过程中,醇母菌能将淀粉先水解成葡萄糖.然后在无氧的情况下将葡萄糖转化为乙醇,B项正确;乙醇分子间易形成氢键与汽油中添加乙醇无关,C项错误;回收铝制易拉罐可再利用废旧金属,节约资源,D项正确。
8.答案:B
解析:由结构式可知.绿原酸中含有碳碳双键和苯环,可以发生加成反应,A项正确;1个绿原酸分子中含有2个酚羟基、1个酯基、1个羧基,1ml绿原酸最多能与4mlNaOH发生反应,B项错误;绿原酸中含有碳碳双键,可以使溴水和酸性溶液视色。C项正确;绿原酸中含有羧基,能与氨基酸和蛋白质中的氨基反应。D项正确。
9.答案:D
解析:可使紫色石蕊试纸变红,不能使试纸褪色,入项错误;品红溶液褪色体现了的漂白性,B项错误;98%浓硫酸中电离程度很小,反应速率慢,C项错误;饱和溶液呈碱性,可以吸收未反应完的,D项正确。
10.答案:B
解析:存在的转化。A项正确;与KSCN溶液反应生成红色约合物,不是沉淀,B项错误;Fe会与浓硫酸发生钝化,C项正确;当Fe过量时,反应后溶液中溶质可以只存在,D项正确。
11.答案:C
解析:1mlNa在空气中受热完全转化成转移1ml电子,A项错误;未给出溶液体积,无法计算数目,B项错误;与反应的过程中涉及离子键Na-O键,极性共价键H-O键和非极性共价键O-O键的断裂,C项正确;Al与NaOH溶液的反应中作氧化剂,D项错误。
12.答案:D
解析:氨气溶于水生成一水合氨,再电离出可导电的离子,氨气本身不是电解质,A项错误;HF的沸点高于HCl与键能无关,B项错误;工业合成氨为放热反应,但为了合适的产率和反应速率及催化剂的适宜温度,选择的条件为高温、高压,C项错误;浓硫酸具有吸水性,可用于等气体干燥,D项正确。
13.答案:B
解析:连接时,X电极发生反应,Ni元素化合价升高,发生氧化反应,A项错误;连接时,Pt电极发生反应。电池反应为,溶液中浓度不变,pH不变,B项正确;连接时,Zn电极做原电池负极,表面发生反应,表面没有沉淀生成,C项错误;该装置将光能先转化为电能,再转化为化学能储能,D项错误。
14.答案:D
解析:由题可知.Z为K,X为H、Y为P,M为O,元素电负性:O>H>K,A项错误;KH为离子晶体,与为分子晶体且存在分子间氢键,则氢化物熔点;,B项错误;第一电离能:H>P>K。C项错误;为极性分子,D项正确
15.答案:A
解析:活化能较大的步骤反应速率较慢,即步骤ⅰ为整个反应的决速步骤,A项错误;由反应能量可知,第一步和第二步相对能量降低,为放热反应,第三步相对能量升高,为吸热反应,B项正确;由图像可知,第一步反应为。C项正确;没有CO存在时,NO转化成的活化能为,有CO存在时,转化活化能为,D项正确。
16.答案:C
解析:碳酸为二元弱酸,的物质的量随着盐酸的加入逐渐减小,的物质的量先增大后减小,则为的物质的量浓度变化曲线,为的物质的量浓度变化曲线,A项正确;由,A点时,B项正确;由图可知C点加入的盐酸的体积为10mL。则C点溶液的溶质为等物质的量的和NaCl,由物料守恒可得。因为的电离程度小于水解程度.所以溶液中。则,C项错误;滴加至D点时,溶质为NaCl,HCl和反应生成的部分和水反应根据溶液呈电中性,溶液中存在,且D点时,故D项正确。
17.答案:(1)①500mL容量瓶;②CBDFAE
(2)①酸式滴定管(或移液管);②防止空气中氧气氧化;③滴入最后半滴溶液,溶液蓝色褪去,且30内不恢复蓝色;④
(3)①不能,会与HCl发生反应生成;②
(4)实验验证:;实验小结:不影响
解析:(1)①配制的标准溶液需要用到的玻璃仪器有玻璃棒、烧杯、500mL容量瓶、胶头滴管、量筒。②配制溶液的实验步骤为称量、溶解、溶液转移至容量瓶、洗涤烧杯玻璃棒、洗涤液转移至容量瓶、定容、摇匀。
(2)①量取溶液应使用酸式滴定管或移液管。②加入KI摇匀后用牛皮纸扎紧瓶口的目的是防止被空气中氧气氧化。使测量结果偏高。③判定滴定结束的现象是滴入最后半滴溶液,溶液蓝色褪去,且30s内不恢复蓝色,①根据反应方程式,可知,排除误差较大的第4次滴定数据,可计算标准溶液的浓度。
(3)①滴定时若盐酸代替硫酸,会与HCl发生反应生成。②溶液与KI反应的离子方程式为。
(4)与反应的离子方程式为。通过两组对比,消耗的溶液体积相同,可知不会影响滴定。
18.答案:(1)粉碎、搅拌
(2)
(3)
(4)
(5)
(6)共价;
(7)(,,);
解析:(①)为了提高镓的浸取率,可以采用粉碎、搅拌等措施。
(2)闪锌矿渣中Pb、Si元素在酸浸时生成不溶的。
(3)加入氧化锌时发生反应的离子方程式为。
(4)向溶液中通入过量的化学方程式为。
(5)在工业上,电解溶液的阴极电极反应式为。
(6)①由六方氨化镓晶体硬度极高。熔点高.且熔融物不导电可知属于共价晶体。②六方氨化镓晶胞的组成为。
(7)①氨化镓的立方晶胞中的坐标为(,,);②立方氮化镓的密度为。
19.答案:(1)①;②N;中存在一个孤电子对,孤电子对对成键电子对的排斥力较强
(2);AD
(3)①;②第一步反应速率较快,15min内反应达到平衡;尿素与氨基甲酸铵均为液体.其物质的量的变化不会对第一步反应的平衡造成影响;
解析:(1)①基态的3d电子轨道表示式为。
②的配位原子是N,中存在一个孤电子对,孤电子对对成键电子对斥力较强,所以中H-N-H的键角小于配合物中的该键角。
(2)⑦根据盖斯定律,可知,②相同温度下,反应Ⅱ平衡常数更大如果对反应不加控制,氨和氧气反应的最终产物主要是,A项正确;为使反应有利于向生成更多的NO方向进行,需要同时关注热力学问题(平衡移动问题)和动力学问题(反应速率问题),B项错误;该反应为气体分子数目增加的反应.增大压强平衡逆向移动.故在实际生产中.采用高压氧化,不一定利于提高NO的产率,C项错误;反应中需控制氨氧比,选择性催化剂的形状、气固相接触时间等,D项正确。
(3)①用单位时间内物质的量的变化来表示固体或纯液体的反应速率.则10min内第一步反应中生成(1)(氨基甲酸钱)的平均反应速率。
第一步反应速率较快,15min内反应达到平衡,随着时间的变化,氨气和二氧化碳的变化很小,第二步反应速率较慢,15分钟反应还未达到平衡,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显:
可知,平衡时的物质的量为2.2ml,因为固体或液体纯物质一般不列入平衡常数。则第一步反应的平衡常数。
20.答案:(1)间甲基苯酚(3-甲基苯酚);
(2)
(3)①NaOH醇溶液,加热;(或碳碳双键);②NaOH水溶液,加热;-OH(或羟基)
(4)AD
(5)12;
解析:(1)化合物A的名称是间甲基苯酚(3-甲基苯酚),化合物1的分子式为。
(2)由E生成G的反应方程式为。
(3)由碳溴键性质可知,在邻位碳原子连有氢原子。在NaOH醇溶液加热条件下可以发生消去反应,反应生成新官能团为碳碳双键;碳溴键可以发生取代反应,在NaOH水溶液加热条件下发生水解,溴原子被取代生成羟基。
(4)反应A→B过程中,有C-Br键和C-H键断裂,没有O-H键断裂,A项错误;反应物中苯环直接连接的N原子为杂化。转化为Ⅰ中叠氩酸根中N原子是s杂化,B项正确;产物K中不存在手性联原子。C项正确;CO属于极性分子,分子中存在由p轨道“头碰头”形成的。键和由p轨道“肩井肩”形成的键,D项错误。
(5)B的同分异构体中,由条件可知苯环上两个取代基,其中一个为酚羟基,另一个为4个碳原子的支链,有、四种结构,每种结构分别有邻、间、对三种位置.共12种。其中存在手性碳的结构有。
A青铜兽面纹爵
B犀角雕玉兰花果纹杯
C研木云纹漆耳杯
D清代彩绘龙纹蓝瓷壶
A
B
C
D
制取
干燥
收集
先从a口通,再从、b口通制备
选项
劳动项目
化学知识
A
用热的纯碱溶液洗涤餐具
纯碱能促进油脂水解
B
用糯米酿制米酒
酵母能将淀粉水解为葡萄糖,进而转化为乙醇
C
汽油中添加乙醇
乙醇分子间易形成氢键
D
回收铝制易拉罐
再利用废旧金属、节约资源
选项
陈述Ⅰ
陈述Ⅱ
A
氨气的水溶液能导电
氨气是电解质
B
H—F键能比H—Cl键能大
HF的沸点比HCl高
C
工业合成氨需在高温、高压下才能进行
该反应是吸热反应
D
浓硫酸具有吸水性
可用于等气体干燥
溶液
KI溶液
20.35
________
20.45
20.40
21.20
温度
300
500
700
900
1100
反应Ⅰ()
反应Ⅱ()
序号
反应试剂、条件
反应形成的新结构
反应类型
①
_______
_______
消去反应
②
_______
_______
水解反应
广东省湛江市2024届高三下学期一模化学试题(Word版含解析): 这是一份广东省湛江市2024届高三下学期一模化学试题(Word版含解析),文件包含2024届广东省湛江市高三下学期一模化学试题docx、答案pdf等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
2024届广东省湛江市高三下学期一模化学试题: 这是一份2024届广东省湛江市高三下学期一模化学试题,文件包含2024届广东省湛江市高三下学期一模化学试题pdf、答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
2023届广东省湛江市高三下学期二模化学试卷PDF版含答案: 这是一份2023届广东省湛江市高三下学期二模化学试卷PDF版含答案,共10页。












