
2022-2023学年四川省凉山州安宁河联盟高二(下)期末化学试卷(含详细答案解析)
展开1.化学与生产、生活密切相关,对提高人类生活质量和促进社会发展具有重要作用。下列说法正确的是( )
A. 杀灭新冠病毒时所使用的酒精浓度越高灭菌效果越好
B. 煤经过气化和液化两个物理变化,可变为清洁能源
C. 疫苗一般应冷藏存放,以避免蛋白质变性
D. 明矾和高铁酸钾均可用于水的杀菌、消毒
2.下列物质属于强电解质的是( )
A. AlB. CH3COONaC. SO3D. 浓盐酸
3.下列化学用语或图示表述表示不正确的是( )
A. 硝基苯的结构简式:B. 质量数为2的氢核素: 12H
C. H2O2的电子式为:D. 氯离子的结构示意图:
4.NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 室温下,pH=9的Na2CO3溶液中由水电离出的OH−数目为10−5NA
B. 标准状况下,22.4LCCl4含有NA个CCl4分子
C. 电解精炼铜时,当阴极生成32g铜,转移电子数一定为NA
D. 将0.1mlH2和0.1mlI2于密闭容器中充分反应后,HI分子总数为0.2NA
5.可逆反应A(g)+B(g)⇌2C(g)+D(g)进行过程中的能量变化如图所示,下列叙述正确的是( )
A. 该反应的焓变ΔH>0,熵变ΔS<0
B. 增加压强,平衡常数将减小
C. 由ΔG=ΔH−TΔS可知,该反应能自发进行
D. 恒容密闭容器内混合气体的密度不再变化,说明该反应达到平衡状态
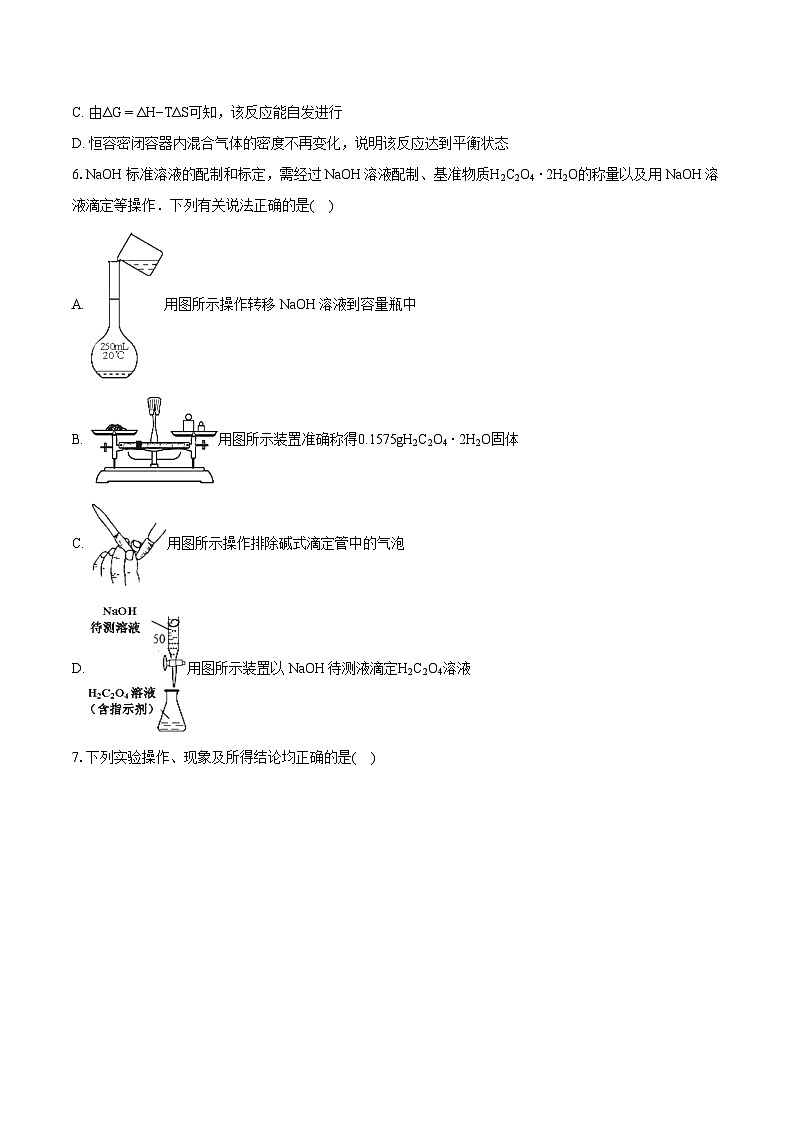
6.NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质H2C2O4⋅2H2O的称量以及用NaOH溶液滴定等操作.下列有关说法正确的是( )
A. 用图所示操作转移NaOH溶液到容量瓶中
B. 用图所示装置准确称得0.1575gH2C2O4⋅2H2O固体
C. 用图所示操作排除碱式滴定管中的气泡
D. 用图所示装置以NaOH待测液滴定H2C2O4溶液
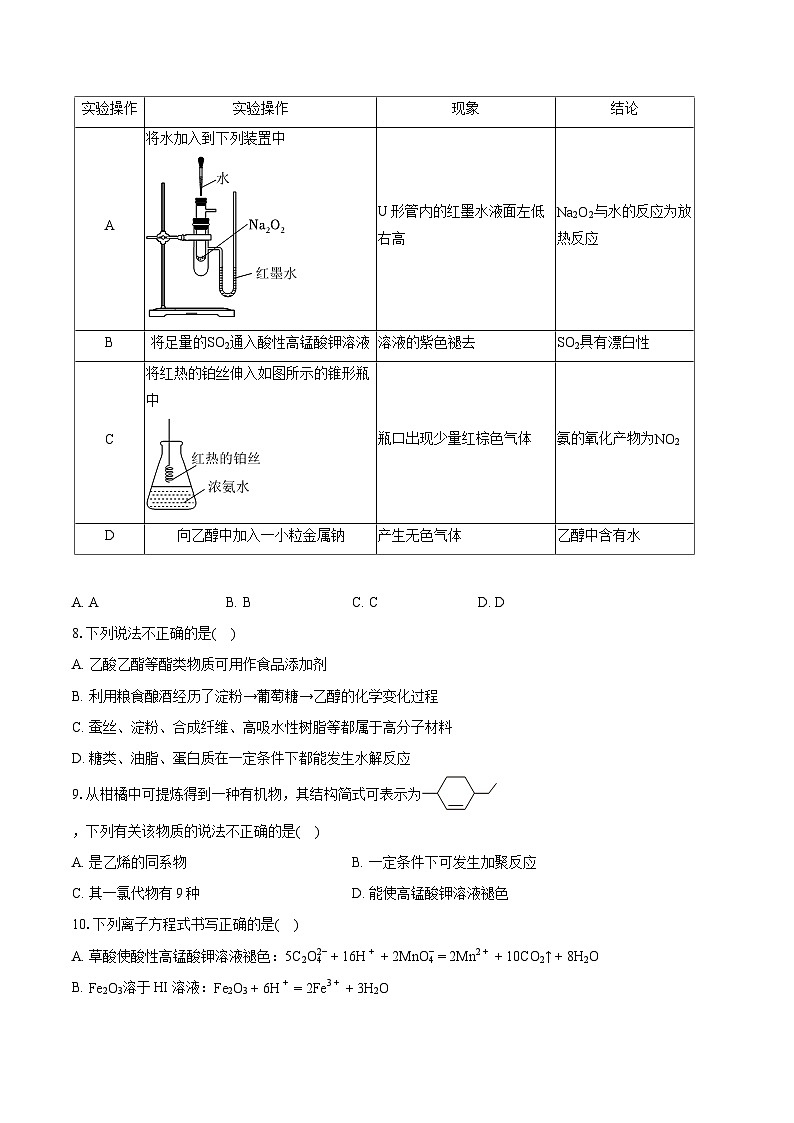
7.下列实验操作、现象及所得结论均正确的是( )
A. AB. BC. CD. D
8.下列说法不正确的是( )
A. 乙酸乙酯等酯类物质可用作食品添加剂
B. 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
C. 蚕丝、淀粉、合成纤维、高吸水性树脂等都属于高分子材料
D. 糖类、油脂、蛋白质在一定条件下都能发生水解反应
9.从柑橘中可提炼得到一种有机物,其结构简式可表示为
,下列有关该物质的说法不正确的是( )
A. 是乙烯的同系物B. 一定条件下可发生加聚反应
C. 其一氯代物有9种D. 能使高锰酸钾溶液褪色
10.下列离子方程式书写正确的是( )
A. 草酸使酸性高锰酸钾溶液褪色:5C2O42−+16H++2MnO4−=2Mn2++10CO2↑+8H2O
B. Fe2O3溶于HI溶液:Fe2O3+6H+=2Fe3++3H2O
C. 过氧化钠加入水中:2Na2O2+2H2O=4Na++4OH−+O2↑
D. 向氯化铝溶液中滴入过量的氨水:Al3++4NH3⋅H2O=AlO2−+4NH4++2H2O
11.部分含铁物质的分类与相应化合价关系如图所示。下列推断合理的是( )
A. a与浓硫酸不反应,因此可以用钢瓶运输浓硫酸
B. b、e为盐酸盐时,可用酸性高锰酸钾溶液鉴别
C. 可向e的盐溶液中加入NaOH溶液制得d的胶体
D. 可存在b→c→d→e→b的循环转化关系
12.一种新的工业制备无水氯化镁的工艺流程如图:
下列说法正确的是( )
A. 工业生产时,物质X最好选用NaOH
B. 工业上常用电解MgCl2水溶液制备金属镁
C. “氯化”过程中发生的反应为MgO+C+Cl2MgCl2+CO
D. “煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水MgCl2
13.下列说法不正确的是( )
A. 生活中金属构件表面喷涂环氧树脂涂层,是为了隔绝空气、水等防止形成原电池
B. 原电池反应是导致金属腐蚀的主要原因,故不能用原电池原理来减缓金属的腐蚀
C. 钢铁电化学腐蚀分为吸氧和析氢腐蚀,主要区别在于水膜的酸性不同,引起的正极反应不同
D. 无论哪种类型的腐蚀,其实质都是金属被氧化
14.某同学组装了如图所示的电化学装置,则下列说法不正确的是( )
A. 甲池为原电池
B. CH3OH电极的电极反应式为:CH3OH−6e−+H2O=CO2+6H+
C. 当乙池中B极质量增加5.40g时,甲池理论上消耗O2的体积为280mL(标准状况下)
D. 若丙中电极不变,电解质换成NaCl溶液,则一段时间后,丙中溶液的pH将增大
15.下列性质的比较,不能用元素周期律解释的是( )
A. 热稳定性:H2O>H2S>PH3B. 碱性:KOH>NaOH>LiOH
C. 酸性:H2SO3>H2CO3>HClOD. 非金属性:F>O>N
16.五种短周期元素X、Y、Z、M、W的原子序数与其一种常见化合价的关系如图所示,下列说法正确的是( )
A. 若X原子半径比Y原子大,则X为Li
B. 等量的Z单质与足量盐酸或NaOH溶液都能产生氢气,且与后者产生的氢气多
C. M的氧化物属于酸性氧化物,不与任何酸反应
D. W的氧化物对应的水化物为强酸
17.下列有关物质的用途或现象与盐的水解无关的是( )
A. 某雨水样品采集后放置一段时间,pH由4.68变为4.28
B. 实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
C. NaHCO3与Al2(SO4)3两种溶液可用作泡沬灭火剂
D. NH4Cl与ZnCl2溶液可用作焊接金属时的除锈剂
18.下列实验过程可以达到实验目的的是( )
A. AB. BC. CD. D
19.以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如图:
下列说法不正确的是( )
A. 从上述流程中可知,冶炼金属Ag可以用热分解的方法
B. 粗铜中含有铁,可将其溶于过量稀硝酸,过滤、低温干燥得纯铜
C. 电解时用粗银作阳极,硝酸银溶液为电解质溶液可获得纯银
D. 整个过程中涉及到化合、复分解、置换、氧化还原反应
20.25℃时,用2aml⋅L−1NaOH溶液滴定1.0L2aml⋅L−1HF溶液,得到混合液中HF、F−的物质的量与溶液pH的变化关系如图所示。下列说法正确的是( )
A. pH=3时,溶液中c(Na+)>c(F−)
B. 当c(F−)>c(HF)时,一定有c(OH−)>c(H+)
C. pH=3.45时,NaOH溶液与HF恰好完全反应
D. HF的电离平衡常数Ka=10−3.45
二、流程题:本大题共1小题,共12分。
21.硫酸锌常用于锌缺乏引起的食欲缺乏、贫血、生长发育迟缓、口疮等的辅助治疗。利用冶炼锌的废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4的实验流程如图:
(1)为提高反应效率,“酸浸”阶段需在70∼80℃条件下进行,适宜的加热方式为______。
(2)已知FeS2在稀硫酸的作用下生成硫单质和某种气体,试写出该反应的离子方程式______;“氧化”步骤的主要目的是______,发生主要反应的离子方程式为______。
(3)下表列出了几种离子生成氢氧化物沉淀的pH(“沉淀完全”是指溶液中离子浓度低于1.0×10−5ml⋅L−1)
加入ZnO调pH至少需要调到______才能达到除杂目的。
(4)滤渣Ⅰ的成分除了S、Fe(OH)3、还有______。
(5)“一系列操作”是指向滤渣Ⅱ中加入稍过量稀硫酸,过滤,再与过滤Ⅱ所得滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤后再用酒精洗涤,干燥。其中用酒精洗涤的原因是:______ (任答两点)。
三、实验题:本大题共1小题,共11分。
22.FeCl3是饮用水、工业用水、城市污水及游泳池循环水处理的高效廉价絮凝剂,也是中学实验室中常见的试剂。某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3易水解。
Ⅰ.FeCl3的制备
(1)装置C中碱石灰的作用是______。
(2)从D、E、F中选择合适的装置制备纯净的Cl2,正确的接口顺序为a→______ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可以重复使用)。
(3)写出装置D中制备Cl2的离子方程式:______。
Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1ml/LFeCl3溶液中滴加几滴0.2ml/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:CuCl和CuSCN均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1:Cu2+与过量的Cu粉反应生成Cu+,再结合Cl−生成白色沉淀CuCl。
猜想2:Cu2+与SCN−发生氧化还原反应生成Cu+,再结合SCN−生成白色沉淀CuSCN。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想______ (填“1”或“2”)不合理。
(5)根据实验现象进一步查阅资料发现:
i.Cu2+与SCN可发生如下两种反应:
反应A:Cu2++4SCN−=[Cu(SCN)4]2−(淡黄色)
反应B:2Cu2++4SCN−=2CuSCN↓+(SCN)2(黄色)。
ii.[Cu(SCN)4]2−与Cu2+共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A ______ (填“>”或“<”)B,说明反应B ______ (填“是”或“不是”)产生CuSCN的主要原因。
②进一步查阅资料可知,当反应体系中同时存在Fe2+、Cu2+、SCN时,Cu2+氧化性增强,可将Fe2+氧化为Fe3+。据此将实验2改进,向CuSO4溶液中同时加入KSCN、FeCl2,立即生成白色沉淀CuSCN,写出该反应离子方程式:______。
四、简答题:本大题共4小题,共37分。
23.X、Y、Z、W、R是原子序数依次增大的短周期主族元素。X是宇宙中含量最丰富的元素,Z与R的某种化合物常做自来水消毒剂,Y元素在自然界形成的化合物种类数最多,W与Y同族。根据物质性质回答下列问题:
(1)Y与R形成的化合物的电子式为______。
(2)Z与R分别与X形成的化合物沸点由高到低______ (用化学式表示),原因是______。
(3)元素M与X同族且不相邻,其某种化合物可做潜水艇供氧剂,当生成标况下11.2L氧气时,转移的电子数目为______。
(4)X、W、R三种元素形成的化合物WXR3与水反应时生成某种胶体以及可燃性气体,请写出该反应的化学方程式______。
24.有机物质A的产量可以用来衡量一个国家的石油化工发展水平。在一定条件下A能发生以下转化,其中B和C都是厨房能找到的两种调味品的主要成分,C与D相同的官能团,D的分子式为C7H6O2。请根据流程回答下列问题。
Ⅰ.A→加热H2O、催化剂B→加压一定条件C
Ⅱ.→△KMnO4,H+D
(1)A的结构简式为______, C中的官能团名称为______。
(2)写出A与水反应生成B的化学方程式______。
(3)由B转化为C的过程中,B物质是被______ (填“氧化”或“还原”)。
(4)B与有机物D能发生反应,请写出反应的化学方程式______,反应的类型为______。
(5)某物质E比D多一个碳原子且与D互为同系物,则E结构可能有______种。
25.2023年5月17日,西昌卫星发射中心成功发射第五十六颗北斗导航卫星,以后的中国将会在航天航空领域取得更优异成果!一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=−890kJ/ml
②H2(g)+12O2(g)=H2O(l)ΔH2=−286kJ/ml
③H2O(l)=H2O(g)ΔH3=+44kJ/ml
请写出H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的热化学方程式为______。
(2)科学家研发出一种新系统,将甲烷直接应用于燃料电池,以触发电化学反应,有效减少太空舱碳的排放,该电池采用KOH溶液为电解质,其工作原理如图所示:
①外电路电子移动方向:______ (填“a→b”或“b→a”)。
②a电极为______极(填“正”“负”),a电极的电极方程式为______。
26.有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)⇌COS(g)+H2O(g)。在610K时,将0.40mlH2S与0.20mlCO2充入5L的钢瓶中,反应达到平衡后水的物质的量分数为0.2。
①上述条件下H2S的平衡转化率α1=______。
②若在620K重复实验,平衡后水的物质的量分数为0.3,该反应的ΔH______ 0(填“<”“>”或“=”)。
③在610K时反应H2S(g)+CO2(g)⇌COS(g)+H2O(g)平衡建立的基础上,改变下列一种条件,能使H2S平衡转化率增大的是______ (填标号)。
A.向容器中通入H2S
B.向容器中通入CO2
C.加入催化剂
D.缩小容器的体积
(2)在气体总压强分别为p1和p2时,反应2SO3(g)⇌2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
①压强:p2______ p1(填“>”或“<”),判断的理由是______。
②若p1=8.1MPa,起始时充入aml的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=______ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
答案和解析
1.【答案】C
【解析】解:A.医用酒精的浓度为75%,并不是越大越好,浓度过大的酒精能够使细菌表明的蛋白质凝固,形成一层硬膜,这层硬膜阻止酒精分子进一步渗入细菌内部,反而保护了细菌,故A错误;
B.煤经过气化和液化两个变化将煤转化为水煤气或甲醇等液体,转化为清洁能源,该过程中生成了新物质,属于化学变化,故B错误;
C.疫苗是指用各类病原微生物制作的用于预防接种的生物制品,主要成分是蛋白质,一般应冷藏存放,以避免蛋白质变性,故C正确;
D.明矾能生成氢氧化铝胶体,吸附水中悬浮物形成沉淀,可用于净水,但明矾没有强氧化性,不能用于水的杀菌、消毒,故D错误;
故选:C。
A.浓度过大的酒精能够使细菌表面的蛋白质凝固,形成一层硬膜,这层硬膜阻止酒精分子进一步渗入细菌内部,反而保护了细菌;
B.煤的气化和液化均属于化学变化;
C.疫苗的主要成分是蛋白质,高温能使蛋白质变性;
D.明矾没有强氧化性,不能用于水的杀菌、消毒。
本题考查物质组成、性质与用途,明确物质的组成、性质、性质与用途的关系为解答关键,侧重考查学生的分析能力及灵活运用能力,注意元素及其化合物知识的应用,题目难度不大。
2.【答案】B
【解析】解:A.Al是单质,既不是电解质也不是非电解质,故A错误;
B.CH3COONa在水中能完全电离,是强电解质,故B正确;
C.SO3是非电解质,故C错误;
D.浓盐酸是混合物,既不是电解质也不是非电解质,故D错误;
故选:B。
强电解质:在水溶液中或熔融状态下能完全电离的化合物;弱电解质:在水溶液中或熔融状态下不能完全电离的化合物,单质和混合物既不是电解质也不是非电解质,据此判断解答。
本题考查了物质的分类,把握电解质、强电解质概念是解题关键,题目难度不大。
3.【答案】A
【解析】解:A.硝基苯中硝基中的N原子直接与苯环相连,不存在C−O键,则硝基苯的结构简式为,故A错误;
B.氢原子的质子数为1,质量数为2的氢核素为 12H,故B正确;
C.H2O2是共价化合物,O原子间共用1对电子,O、H原子间共用1对电子,O原子最外层电子数为8,其电子式为,故C正确;
D.氯离子的质子数为17,电子数为18,各层上电子数分别为2、8、8,其结构示意图为,故D正确;
故选:A。
A.硝基苯中含有C−N键,不含有C−O键;
B.氢原子的质子数为1,质量数标注于元素符号左上角,质子数标注于左下角;
C.H2O2为共价化合物,O原子间共用1对电子,O、H原子间共用1对电子;
D.氯离子的质子数为17,电子数为18,最外层电子数为8。
本题考查化学用语的正误判断,涉及电子式、核素、结构简式、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题侧重考查学生的规范答题能力,题目难度不大。
4.【答案】C
【解析】解:A.溶液体积未知,无法计算水电离出的氢氧根离子数目,故A错误;
B.标况下四氯化碳为液体,不能使用气体摩尔体积计算其物质的量,故B错误;
C.电解精炼铜时,阴极反应:Cu2++2e−=Cu,当阴极生成32g铜,转移电子数一定为NA,故C正确;
D.氢气与碘反应生成碘化氢为可逆反应,不能进行到底,所以将0.1mlH2和0.1mlI2于密闭容器中充分反应后,HI分子总数小于0.2NA,故D错误;
故选:C。
A.溶液体积未知;
B.气体摩尔体积使用对象为气体;
C.电解精炼铜时,阴极反应:Cu2++2e−=Cu;
D.氢气与碘反应生成碘化氢为可逆反应。
本题考查了阿伏加德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大。
5.【答案】C
【解析】解:A.由图可知,该反应是放热反应,则A(g)+B(g)⇌2C(g)+D(g)是气体分子数增大的放热反应,焓变ΔH<0,熵变ΔS>0,故A错误;
B.平衡常数只与温度有关,则增加压强,平衡常数不变,故B错误;
C.由选项A分析可知,反应A(g)+B(g)⇌2C(g)+D(g)的ΔH<0,ΔS>0,则始终存在ΔG=ΔH−TΔS<0,该反应在任何温度均能自发进行,故C正确;
D.反应体系中各物质均为气体,混合气体的质量不变,则恒容密闭容器内混合气体的密度始终不变化,所以密闭容器内混合气体的密度不再变化的状态不一定是平衡状态,故D错误;
故选:C。
A.若反应物的总能量高于生成物,则反应放热,反之相反;
B.平衡常数只与温度有关,与其他条件变化无关;
C.ΔG=ΔH−TΔS<0的反应能自发进行,反之相反;
D.恒容密闭容器内混合气体的密度始终不变化,不能据此判断反应是否达到平衡状态。
本题考查反应热与焓变、化学平衡状态的判定等知识,把握反应自发进行的条件、化学平衡常数的影响因素、平衡状态的判定为解答的关键,侧重分析与运用能力的考查,题目难度不大。
6.【答案】C
【解析】【分析】
本题考查化学实验方案的评价,为高频考点,涉及称量、溶液配制、中和滴定等,综合性较强,侧重实验基础知识及实验技能的考查,注意实验的评价性分析,题目难度不大。
【解答】
A.转移液体需要用玻璃棒引流,故A错误;
B.托盘天平精确到0.1g,无法称取0.1575gH2C2O4⋅2H2O固体,且不能直接放在托盘上,故B错误;
C.挤压时尖嘴向上,易于空气排出,图中挤压橡胶管中的操作合理,故C正确;
D.氢氧化钠呈碱性,应用碱式滴定管盛装,故D错误;
故选C。
7.【答案】A
【解析】解:A.Na2O2与水反应放热,大试管中空气受热膨胀,U形管内的红墨水液面左低右高可证明,故A正确;
B.二氧化硫被酸性高锰酸钾溶液氧化,紫色褪去,可知二氧化硫具有还原性,故B错误;
C.氨气催化氧化生成NO,在试管口NO与氧气反应生成二氧化氮,则瓶口出现少量红棕色气体,故C错误;
D.水、乙醇均与Na反应生成氢气,产生无色气体,不能证明乙醇中是否含水,故D错误;
故选:A。
A.Na2O2与水反应放热,大试管中空气受热膨胀;
B.二氧化硫被酸性高锰酸钾溶液氧化;
C.氨气催化氧化生成NO,在试管口NO与氧气反应生成二氧化氮;
D.水、乙醇均与Na反应生成氢气。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
8.【答案】D
【解析】解:A.乙酸乙酯等酯类物质具有特殊香味,可用作调味料,可用作食品添加剂,故A正确;
B.淀粉生成葡萄糖是化学变化,葡萄糖生成乙醇也是化学变化,粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程,故B正确;
C.蚕丝、淀粉、合成纤维、高吸水性树脂高都是高分子化合物,都属于高分子材料,故C正确;
D.单糖不能水解,故D错误;
故选:D。
A.乙酸乙酯等酯类物质具有特殊香味,可用作调味料;
B.淀粉生成葡萄糖,葡萄糖生成乙醇;
C.高分子材料是以高分子化合物为基体,再配有其他添加剂(助剂)所构成的材料;
D.单糖不能水解。
本题考查有机物的性质和变化,掌握基础是关键,题目难度不大。
9.【答案】A
【解析】解:A.乙烯的同系物只有1个碳碳双键,且不含环状结构,该有机物含2个碳碳双键,结构不相似,不互为同系物,故A错误;
B.含碳碳双键,一定条件下可发生加聚反应,故B正确;
C.结构不对称,分子中含9种H原子,其一氯代物有9种,故C正确;
D.含碳碳双键,能使高锰酸钾溶液褪色,故D正确;
故选:A。
A.乙烯的同系物只有1个碳碳双键,且不含环状结构;
B.含碳碳双键;
C.结构不对称,分子中含9种H原子;
D.含碳碳双键。
本题考查有机物的结构与性质,为高频考点,把握有机物的结构、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项A为解答的易错点,题目难度不大。
10.【答案】C
【解析】解:A.草酸使酸性高锰酸钾溶液褪色,离子方程式为:5H2C2O4+6H++2MnO4−=2Mn2++10CO2↑+8H2O,故A错误;
B.Fe2O3与HI发生氧化还原反应,其反应的离子方程式为:Fe2O3+6H++2I−=2Fe2++3H2O+I2,故B错误;
C.过氧化钠加入水中,离子方程式为:2Na2O2+2H2O=4Na++4OH−+O2↑,故C正确;
D.氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,正确的离子方程式为:Al3++3NH3⋅H2O=Al(OH)3↓+3NH4+,故D错误;
故选:C。
A.草酸为弱酸,应保留化学式;
B.铁离子能够氧化碘离子;
C.二者反应生成氢氧化钠和氧气;
D.不符合反应客观事实。
本题考查了离子方程式的判断,题目难度不大,注意明确离子方程式正误判断常用方法:生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等。
11.【答案】D
【解析】解:A.常温下,铁与浓硫酸会钝化,因此在工业上可以用铁槽车运输浓硫酸,钝化发生了化学反应,故A错误;
B.Fe2+、氯离子均与高锰酸钾发生氧化还原反应,溶液褪色,不能用酸性高锰酸钾溶液鉴别,故B错误;
C.向铁盐溶液中加入NaOH溶液中,发生复分解反应制得Fe(OH)3沉淀,不是胶体,向沸腾的蒸馏水中逐滴加入饱和FeCl3溶液可得到Fe(OH)3胶体,故C错误;
D.向亚铁盐溶液中加入碱,反应制取得到Fe(OH)2,该物质不稳定,容易被空气中的氧气氧化产生Fe(OH)3,Fe(OH)3用酸溶解,反应产生铁盐,向铁盐溶液中加入Fe或Cu具有还原性的物质,反应产生亚铁盐,从而可实现b→c→d→e→b的循环转化关系,故D正确;
故选:D。
根据含铁物质的分类与相应化合价关系可知:a是Fe,b是亚铁盐,c是Fe(OH)2,d是Fe(OH)3,e是铁盐,然后利用物质的性质及转化分析。
本题考查了含铁化合物相关知识,侧重考查学生的分析能力以及元素化合物知识的综合理解和运用,题目难度不大,注意把握物质的性质。
12.【答案】C
【解析】解:A.煅烧石灰石得到生石灰,价格便宜,NaOH相对昂贵,则工业生产时物质X最好为生石灰或氢氧化钙,故A错误;
B.工业上常用电解熔融无水MgCl2制备金属镁,电解MgCl2水溶液是生成Mg(OH)2、H2、Cl2,故B错误;
C.“氯化”过程中发生的氧化还原反应为MgO+C+Cl2MgCl2+CO,故C正确;
D.“煅烧”后的产物中含有MgO,加稀盐酸生成MgCl2,MgCl2易发生水解反应生成Mg(OH)2,MgCl2溶液加热蒸发不能得到无水MgCl2,应在HCl气流中加热蒸发得到无水MgCl2,故D错误;
故选:C。
制备无水氯化镁流程为:海水中含镁离子,浓缩得到苦卤水,加物质可沉淀镁离子,X为生石灰或氢氧化钙,过滤分离出氢氧化镁沉淀,煅烧氢氧化镁生成MgO,氯化时发生氧化还原反应生成MgCl2,反应为MgO+C+Cl2MgCl2+CO,据此分析解答。
本题考查物质的制备实验,把握物质的性质、发生的反应、制备原理为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
13.【答案】B
【解析】解:A、生活中金属构件表面喷涂环氧树脂涂层,是为了隔绝空气、水防止形成原电池,故A正确;
B、金属作原电池的正极被保护,所以可以用原电池原理来减缓金属的腐蚀,故B错误;
C、酸性较强时Fe主要发生析氢腐蚀,中性或弱酸性发生吸氧腐蚀,所以钢铁电化学腐蚀的两种类型主要区别在于水膜的酸性不同,引起的正极反应不同,故C正确;
D、金属被腐蚀实质是金属失电子,所以无论哪种类型的腐蚀,其实质都是金属被氧化,故D正确。
故选:B。
A、生活中金属构件表面喷涂环氧树脂涂层,是为了隔绝空气、水;
B、金属作原电池的正极被保护;
C、酸性较强时Fe主要发生析氢腐蚀,中性或弱酸性发生吸氧腐蚀;
D、金属被腐蚀实质是金属失电子。
本题考查学生金属的腐蚀和防护知识,注意把握金属的腐蚀原理和防护方法,注意基本概念的理解和掌握是关键,难度不大。
14.【答案】B
【解析】解:A.甲池是燃料电池,燃料在负极失电子发生氧化反应在碱溶液中生成碳酸盐,正极氧气得电子发生还原反应,故A正确;
B.燃料在负极失电子发生氧化反应在碱溶液中生成碳酸盐,甲池中通入CH3OH电极的电极反应为:CH3OH−6e−+8OH−=CO32−+6H2O,故B错误;
C.当乙池中B极质量增加5.4g为Ag,物质的量=5.4g108g/ml=0.05ml,依据电子守恒计算4Ag∼O2∼4e−,甲池中理论上消耗O2的体积=0.05ml4×22.4L/ml=0.28L=280ml,故C正确;
D.丙中电极不变,将其溶液换成NaCl溶液,阴极上氢离子放电生成氢气,电极反应为2H++2e−=H2↑,则丙中电解NaCl溶液生成氢氧化钠,所以溶液的pH增大,故D正确;
故选:B。
A.甲池是燃料电池;
B.燃料在负极失电子发生氧化反应在碱溶液中生成碳酸盐;
C.乙池是电解池结合电子守恒计算消耗氧气的体积;
D.丙中电极不变,将其溶液换成NaCl溶液,阴极上氢离子放电生成氢气,丙中电解NaCl溶液生成氢氧化钠。
本题考查了原电池电解池的相互串联问题,注意首先区分原电池和电解池,题目难度中等。
15.【答案】C
【解析】解:A.非金属性越强对应气态氢化物越稳定,非金属性:O>S>P,因此热稳定性:H2O>H2S>PH3可以用元素周期律解释,故A错误;
B.金属性越强,最高价氧化物对应水化物的碱性越强,金属性:K>Na>Li,因此碱性:KOH>NaOH>LiOH可以用元素周期律解释,故B错误;
C.非金属性越强,最高价氧化物对应水化物的酸性越强,因此酸性:H2SO3>H2CO3>HClO不能用元素周期律解释,故C正确;
D.同周期从左到右非金属性逐渐增强,因此非金属性:F>O>N可以用元素周期律解释,故D错误;
故选:C。
A.非金属性越强对应气态氢化物越稳定;
B.金属性越强,最高价氧化物对应水化物的碱性越强;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.同周期从左到右非金属性逐渐增强。
本题主要考查元素周期律的相关知识,为高频考点,题目难度不大。
16.【答案】A
【解析】解:X、Y、Z、M、W分别是Li或H、N、Al、Si、S元素;
A.同一周期元素,原子半径随着原子序数的增大而减小,除0族外的所有元素中氢原子的半径最小,若X原子半径比Y原子大,X、Y位于同一周期,则X为Li,故A正确;
B.Z为Al,等质量的Al与足量盐酸或NaOH溶液都能产生氢气,生成氢气的量与Al的物质的量成正比,Al的质量相等,则生成氢气的量相同,故B错误;
C.M为Si元素,M的氧化物SiO2能和HF反应生成SiF4和H2O,故C错误;
D.W的氧化物的水化物可能为弱酸,如:H2SO3为弱酸,故D错误;
故选:A。
这几种元素都是短周期元素,根据各元素的化合价知,X、Y、Z、M、W分别位于第ⅠA、ⅤA、ⅢA、ⅣA、ⅥA族,结合其原子序数知,X、Y、Z、M、W分别是Li或H、N、Al、Si、S元素;
A.同一周期元素,原子半径随着原子序数的增大而减小,除0族外的所有元素中氢原子的半径最小;
B.Z为Al,等质量的Al与足量盐酸或NaOH溶液都能产生氢气,生成氢气的量与Al的物质的量成正比;
C.M为Si元素,M的氧化物SiO2能和HF反应;
D.W的氧化物的水化物可能为弱酸。
本题主要考查学生对元素周期律与周期表的掌握与应用的情况,同时考查元素化合物的相关知识,属于基本知识的考查,难度中等。
17.【答案】A
【解析】解:A.正常的雨水溶解二氧化碳,其pH为5.6,pH值小于5.6为酸雨,pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸,由弱酸转化为强酸,酸性增强,与盐的水解无关,故A正确;
B.Na2CO3溶液中碳酸根离子水解生成氢氧根离子,能腐蚀磨口玻璃塞,与水解有关,故B错误;
C.碳酸氢根离子水解显碱性,铝离子水解显酸性,二者水解相互促进生成二氧化碳和氢氧化铝,与水解有关,故C错误;
D.NH4++H2O⇌NH3⋅H2O+H+,Zn2++2H2O⇌Zn(OH)2+2H+,生成的H+使铁锈中的氧化铁溶解,与盐的水解有关,故D错误;
故选:A。
A.正常的雨水溶解二氧化碳,其pH为5.6,pH值小于5.6为酸雨,pH由4.68变为4.28,主要是雨水中溶解的二氧化硫生成亚硫酸,亚硫酸被氧化为硫酸;
B.Na2CO3溶液呈碱性;
C.碳酸氢根离子水解显碱性,铝离子水解显酸性,二者水解相互促进;
D.NH4Cl与ZnCl2溶液中的阳离子均水解显酸性。
本题考查盐类的水解的应用,侧重于学生的分析能力和基本理论知识的理解和运用的考查,把握盐类水解的原理、规律和应用是做题的关键,题目难度不大。
18.【答案】C
【解析】解:溶液与0.05ml/L的NaCl溶液等体积混合后,过量的硝酸银与KI反应生成沉淀,为沉淀的生成,不能比较Ksp(AgI)、Ksp(AgCl)的大小,故A错误;
B.淀粉水解后,没有加NaOH中和硫酸,不能检验葡萄糖,操作不合理,故B错误;
C.乙醇可被酸性高锰酸钾溶液氧化,乙酸不能,现象不同,可鉴别,故C正确;
D.由2KMnO4∼5H2C2O4可知,高锰酸钾过量,应可知高锰酸钾不足,改变草酸的浓度探究浓度对反应速率的影响,故D错误;
故选:C。
溶液与0.05ml/L的NaCl溶液等体积混合后,硝酸银过量;
B.淀粉水解后,在碱性溶液中检验葡萄糖;
C.乙醇可被酸性高锰酸钾溶液氧化,乙酸不能;
D.由2KMnO4∼5H2C2O4可知,高锰酸钾过量。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、难溶电解质、物质的鉴别及检验、反应速率、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
19.【答案】B
【解析】解:A.根据分析可知,高温下不能生成氧化银,即氧化银高温下会分解为银和氧气,所以冶炼金属Ag可以用热分解的方法,故A正确;
B.粗铜溶于过量稀硝酸,完全反应生成硝酸铜、NO、水,过滤、低温干燥得不到纯铜,得到的是其它的不溶于稀硝酸的杂质,故B错误;
C.电解时用粗银作阳极,硝酸银溶液为电解质溶液,可以实现银的精炼,故C正确;
D.铜银合金(含少量铁)在空气中高温加热,生成氧化铜和氧化铁,属于化合反应、氧化还原反应;渣料溶于稀硫酸,为氧化铜、氧化铁和硫酸的反应,为复分解反应;向滤液中加入适量铁粉,置换出铜为置换反应,氧化还原反应,故D正确;
故选:B。
铜银合金(含少量铁)在空气中高温,生成含有氧化铜和少量氧化铁和银的渣料,同时得到熔融态的银,经冷却后得到粗银,再经电解得到纯银,渣料溶于稀硫酸,过滤,得到银和滤液,向滤液中加入适量铁粉,置换出铜,过滤,得到铜和滤液,据此分析作答即可。
本题主要考查物质的分离与提纯基本思路和方法,同时考查了金属的冶炼、硝酸和硫酸的性质、氧化还原反应等知识,属于基本知识的考查,难度中等。
20.【答案】D
【解析】解:A.pH=3时,c(H+)>c(OH−),溶液中存在c(Na+)+c(H+)=c(OH−)+c(F−),则c(F−)>c(Na+),故A错误;
B.当pH>3.45时,c(F−)>c(HF),溶液可能呈酸性、中性或碱性,故B错误;
C.HF 为弱酸,恰好反应时溶液应成碱性,当pH=3.45时HF酸过量,故C错误;
D.HF为弱酸,根据题给图象可知,恰好反应时溶液应呈碱性,当pH=3.45时HF酸过量,因而HF的电离平衡常数为:Ka=10−3.45,故D正确,
故选:D。
A.pH=3时,c(H+)>c(OH−),结合溶液中的电荷守恒判断;
B.当pH>3.45时,c(F−)>c(HF),结合图象分析;
C.HF为弱酸,恰好反应时溶液应成碱性;
D.HF为弱酸,结合题给图象分析。
本题考查酸碱混合的计算和判断,注意把握图象的曲线变化特点,为解答该题的关键,注意HF为弱电解质的特点,侧重考查学生的分析能力和运用能力,题目难度中等。
21.【答案】水浴加热 FeS2+2H+=Fe2++H2S↑+S将Fe2+氧化为Fe3+,便于后续除杂 2Fe2++H2O2+2H+=2Fe3++2H2O5.2SiO2、Al(OH)3 酒精易挥发,便于干燥、减少晶体溶解损失、抑制晶体水解等
【解析】解:(1)为提高反应效率,“酸浸”阶段需在70∼80℃条件下进行,适宜的加热方式为:水浴加热,
故答案为:水浴加热;
(2)已知FeS2在稀硫酸的作用下生成硫单质和某种气体,试写出该反应的离子方程式:FeS2+2H+=Fe2++H2S↑+S,“氧化”步骤的主要目的是:将Fe2+氧化为Fe3+,便于后续除杂,发生主要反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:FeS2+2H+=Fe2++H2S↑+S;将Fe2+氧化为Fe3+,便于后续除杂;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)加入ZnO调pH至少需要调到5.2,保证铝离子和铁离子完全沉淀,才能达到除杂目的,
故答案为:5.2;
(4)滤渣Ⅰ的成分除了S、Fe(OH)3、还有:SiO2、Al(OH)3,
故答案为:SiO2、Al(OH)3;
(5)“一系列操作”是指向滤渣Ⅱ中加入稍过量稀硫酸,过滤,再与过滤Ⅱ所得滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤后再用酒精洗涤,干燥。其中用酒精洗涤的原因是:酒精易挥发,便于干燥、减少晶体溶解损失、抑制晶体水解等,
故答案为:酒精易挥发,便于干燥、减少晶体溶解损失、抑制晶体水解等。
利用冶炼锌的废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4的实验流程分析可知,废渣加入稀硫酸酸浸,加入过氧化氢氧化亚铁离子生成铁离子,加入ZnO调节溶液pH沉淀铁离子生成氢氧化铁、铝离子生成氢氧化铝,过滤得到滤渣为反应生成的硫单质、不反应的二氧化硅、反应生成的Fe(OH3、Al(OH)3,滤液中加入锌粉过滤,“一系列操作”是指向滤渣Ⅱ中加入稍过量稀硫酸,过滤,再与过滤Ⅱ所得滤液合并,保持60℃左右蒸发浓缩,冷却至室温结晶,过滤后再用酒精洗涤,干燥得到硫酸锌,据此分析回答问题。
本题考查了物质提纯、物质分离过程的分析判断,注意物质性质和实验方案的理解应用,题目难度中等。
22.【答案】吸收多余的Cl2,用于尾气处理,同时可以防止空气中的水蒸气进入收集器中,防止FeCl3水解变质 b→c→b→cMnO2+4H++2Cl−Mn2++Cl2↑+2H2O1>是 Cu2++Fe2++SCN−=CuSCN↓+Fe3+
【解析】解:(1)由分析可知,装置C中碱石灰的作用是用于吸收多余的Cl2,用于尾气处理,同时可以防止空气中的水蒸气进入收集器中,防止FeCl3水解变质,
故答案为:吸收多余的Cl2,用于尾气处理,同时可以防止空气中的水蒸气进入收集器中,防止FeCl3水解变质;
(2)从D、E、F中选择合适的装置制备纯净的Cl2,正确的接口顺序为a→b→c→b→c,
故答案为:b→c→b→c;
(3)由分析可知,装置D为实验制备Cl2的发生装置,原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,该反应的离子方程式为:MnO2+4H++2Cl− Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl− Mn2++Cl2↑+2H2O;
(4)由题干对比实验1、2操作和现象可知,实验1的反应物质含有Cl−,而实验2中的反应物中不含Cl−,结果实验1无白色沉淀生成,而实验2生成白色沉淀,说明产生的白色沉淀为CuSCN,故实验结果说明猜想1不合理,
故答案为:1;
(5)①由实验2中的现象即溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀可推测,反应速率:A>B,说明反应B是产生CuSCN的主要原因,
故答案为:>;是;
②进一步查阅资料可知,当反应体系中同时存在Fe2+、Cu2+、SCN−时,Cu2+氧化性增强,可将Fe2+氧化为Fe3+,据此将实验2改进,向CuSO4溶液中同时加入KSCN、FeCl2,立即生成白色沉淀CuSCN,即Cu2+先将Fe2+氧化为Fe3+,自身被还原为Cu+,然后Cu+与SCN−结合为CuSCN白色沉淀,该反应的离子方程式为:Cu2++Fe2++SCN−=CuSCN↓+Fe3+,
故答案为:Cu2++Fe2++SCN−=CuSCN↓+Fe3+。
Ⅰ.由题干实验装置图可知,装置D为实验制备Cl2的发生装置,原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,装置E为盛有饱和食盐水的洗气瓶,用于除去Cl2中的HCl,装置E为浓硫酸,用于干燥Cl2,然后将干燥的Cl2通入装置A中,装置A为制备FeCl3,装置B中的收集器用于收集FeCl3,装置C中的碱石灰用于吸收多余的Cl2,用于尾气处理,同时可以防止空气中的水蒸气进入收集器中,防止FeCl3水解变质;
(4)由题干对比实验1、2操作和现象可知,实验1的反应物质含有Cl−,而实验2中的反应物中不含Cl−,结果实验1无白色沉淀生成,而实验2生成白色沉淀;
(5)①由实验2中的现象即溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀;
②进一步查阅资料可知,当反应体系中同时存在Fe2+、Cu2+、SCN−时,Cu2+氧化性增强,可将Fe2+氧化为Fe3+,据此将实验2改进,向CuSO4溶液中同时加入KSCN、FeCl2,立即生成白色沉淀CuSCN,即Cu2+先将Fe2+氧化为Fe3+,自身被还原为Cu+,然后Cu+与SCN−结合为CuSCN白色沉淀。
本题考查实验方案的设计,侧重考查学生仪器、实验装置、物质之间的转化和方程式书写的掌握情况,试题难度中等。
23.【答案】 H2O>HClH2O形成分子间氢键,沸点升高 NA SiHCl3+3H2O=H2SiO3(胶体)+3HCl+H2↑
【解析】解:(1)Y与R形成的化合物为CCl4,其电子式为,
故答案为:;
(2)Z与R分别与X形成的化合物为H2O、HCl,H2O形成分子间氢键,沸点升高,则沸点:H2O>HCl,
故答案为:H2O>HCl;H2O形成分子间氢键,沸点升高;
(3)元素M与X同族且不相邻,其某种化合物可做潜水艇供氧剂,则M为Na元素,该化合物为Na2O2,O元素由−1价变为0价,则转移电子数目为⋅ml−1×2×e−1×NAml−1=NA,
故答案为:NA;
(4)X、W、R三种元素形成的化合物WXR3为SiHCl3,SiHCl3与水反应生成硅酸胶体、HCl和H2,反应化学方程式为:SiHCl3+3H2O=H2SiO3(胶体)+3HCl+H2↑,
故答案为:SiHCl3+3H2O=H2SiO3(胶体)+3HCl+H2↑。
X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X为宇宙中最丰富的元素,则X为H元素;Z与R的某种化合物常做自来水消毒剂,则Z为O元素,R为Cl元素;Y元素在自然界形成的化合物种类数最多,则Y为C元素;W与Y同族,则W为Si元素,以此分析解答;
(1)Y与R形成的化合物为CCl4;
(2)Z与R分别与X形成的化合物为H2O、HCl;形成分子间氢键,沸点升高;
(3)元素M与X同族且不相邻,其某种化合物可做潜水艇供氧剂,则M为Na元素,该化合物为Na2O2,O元素由−1价变为0价;
(4)X、W、R三种元素形成的化合物WXR3为SiHCl3,SiHCl3与水反应生成硅酸胶体、HCl和H2。
本题考查结构性质位置关系应用,理解掌握元素周期表与元素周期律,熟练掌握元素化合物知识,注意对基础知识的积累,题目难度适中。
24.【答案】CH2=CH2 羧基 CH2=CH2+H2O→加热,加压催化剂CH3CH2OH氧化 +H2O取代反应(或酯化反应)4
【解析】解:(1)机物质A的产量可以用来衡量一个国家的石油化工发展水平,则A的结构简式为CH2=CH2;C为CH3COOH,C中的官能团名称为羧基,
故答案为:CH2=CH2;羧基;
(2)A与水反应生成B的化学方程式为CH2=CH2+H2O→加热,加压催化剂CH3CH2OH,
故答案为:CH2=CH2+H2O→加热,加压催化剂CH3CH2OH;
(3)由B→C的过程是CH3CH2OH转化为CH3COOH,CH3CH2OH发生氧化反应,
故答案为:氧化;
(4)B与有机物D能发生反应,反应的化学方程式为+H2O,该反应类型属于取代反应(或酯化反应),
故答案为:+H2O;取代反应(或酯化反应);
(5)某物质E比D()多一个碳原子且与D互为同系物,则E结构可能为、、、共4种,
故答案为:4。
有机物质A的产量可以用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B和C都是厨房能找到的两种调味品的主要成分,则乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3COOH,C与D相同的官能团,D的分子式为C7H6O2,则甲苯发生氧化反应生成D为。
本题考查有机物的推断,涉及官能团识别、有机反应方程式的书写、有机反应类型、限制条件同分异构体的书写等,熟练掌握官能团的性质与转化,题目比较基础,旨在考查学生对基础知识的掌握情况。
25.【答案】CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH=−166kJ/mla→b负 CH4−8e−+10OH−=CO32−+7H2O
【解析】解:(1)已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=−890kJ/ml,②H2(g)+12O2(g)=H2O(l)ΔH2=−286kJ/ml,③H2O(l)=H2O(g)ΔH3=+44kJ/ml,盖斯定律计算②×4−①+2×③得到H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH=−166kJ/ml,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH=−166kJ/ml;
(2)①a极为负极,b极为正极,外电路电子移动方向从负极流向正极,即a→b,
故答案为:a→b;
②a极为负极,甲烷燃烧生成二氧化碳,在KOH溶液中二氧化碳生成碳酸根,电极反应式为CH4−8e−+10OH−=CO32−+7H2O,
故答案为:负;CH4−8e−+10OH−=CO32−+7H2O。
(1)已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH1=−890kJ/ml,②H2(g)+12O2(g)=H2O(l)ΔH2=−286kJ/ml,③H2O(l)=H2O(g)ΔH3=+44kJ/ml,盖斯定律计算②×4−①+2×③得到H2(g)与CO2(g)反应生成CH4(g)和H2O(g)的热化学方程式;
(2)燃料电池以可燃物为负极,助燃剂作正极。
本题考查了热化学方程式和盖斯定律的计算应用、原电池原理和电极反应书写方法等知识点,掌握基础是解题关键,题目难度中等。
26.【答案】30%>B<其他条件相同时,增大压强平衡朝着气体体积减小的方向移动,再达平衡时SO3物质的量分数增大,SO2物质的量分数减小 0.6
【解析】解:(1)①反应H2S(g)+CO2(g)⇌COS(g)+H2O(g)是气体体积不变化的反应,即反应达到平衡后混合气体的总量为0.40ml+0.20ml=0.60ml,水的物质的量分数为0.2,则△n(H2S)=n(H2O)=0.60ml×0.2=0.12ml,所以H2S的平衡转化率α1=×100%=30%,
故答案为:30%;
②610K时原平衡体系中水的物质的量分数为0.2,升高温度到620K时重复实验,水的物质的量分数增大到0.3,说明升高温度,平衡正向移动,则反应为吸热反应,反应的ΔH>0,
故答案为:>;
③A.向容器中通入H2S,平衡正向移动,但H2S的转化量远小于H2S的增加量,所以H2S的平衡转化率反而降低,故A错误;
B.向容器中通入CO2,平衡正向移动,H2S的平衡转化率增大,故B正确;
C.加入催化剂,能加快反应速率,但不能改变反应的始态和终态,H2S的平衡转化率不变,故C错误;
D.该反应是气体体积不变化的反应,缩小容器的体积增大压强,平衡不发生移动,则H2S的平衡转化率不变,故D错误;
故答案为:B;
(2)①反应2SO3(g)⇌2SO2(g)+O2(g)是气体体积增大的反应,温度一定增大压强时,平衡逆向移动,SO3(g)的物质的量分数增大,SO2(g)的物质的量分数减小,即温度一定时压强越大,SO3(g)的物质的量分数越大,SO2(g)的物质的量分数越小,所以压强:p2
②反应为2SO3(g)⇌2SO2(g)+O2(g),达到平衡时n(SO2)=2n(O2),p1=8.1MPa,Q点SO3(g)的物质的量分数为50%,则平衡分压:p(SO3)=12p1=12×8.1MPa=4.05MPa,p(SO2)=2p(O2),p(SO2)=23×4.05MPa=2.7MPa,p(O2)=1.35MPa,分压平衡常数Kp=p2(SO2)×p(O2)p2(SO3)=2.72×,
故答案为:0.6。
(1)①反应H2S(g)+CO2(g)⇌COS(g)+H2O(g)是气体体积不变化的反应,即反应达到平衡后混合气体的总量为0.40ml+0.20ml=0.60ml,水的物质的量分数为0.2,则△n(H2S)=n(H2O)=0.60ml×0.2=0.12ml;
②升高原平衡体系温度到620K时重复实验,水的物质的量分数增大,说明升高温度,平衡正向移动;
③除增大H2S浓度外的使平衡正向移动的措施均能提高H2S平衡转化率;
(2)①反应2SO3(g)⇌2SO2(g)+O2(g)是气体体积增大的反应,温度一定增大压强时,平衡逆向移动,SO3(g)的物质的量分数增大,SO2(g)的物质的量分数减小,即温度一定时压强越大,SO3(g)的物质的量分数越大,SO2(g)的物质的量分数越小;
②反应为2SO3(g)⇌2SO2(g)+O2(g),达到平衡时n(SO2)=2n(O2),p1=8.1MPa,Q点SO3(g)的物质的量分数为50%,则平衡分压:p(SO3)=12p1=12×8.1MPa=4.05MPa,p(SO2)=2p(O2),p(SO2)=23×4.05MPa=2.7MPa,p(O2)=1.35MPa,结合平衡常数Kp=p2(SO2)×p(O2)p2(SO3)进行计算。
本题考查化学平衡计算和化学平衡影响因素,侧重基础知识检测和运用能力考查,把握化学平衡常数含义及其计算、化学平衡影响因素即可解答,题目难度中等。实验操作
实验操作
现象
结论
A
将水加入到下列装置中
U形管内的红墨水液面左低右高
Na2O2与水的反应为放热反应
B
将足量的SO2通入酸性高锰酸钾溶液
溶液的紫色褪去
SO2具有漂白性
C
将红热的铂丝伸入如图所示的锥形瓶中
瓶口出现少量红棕色气体
氨的氧化产物为NO2
D
向乙醇中加入一小粒金属钠
产生无色气体
乙醇中含有水
编号
实验目的
实验过程
A
验证Ksp(AgI)
B
验证淀粉水解产物
取5mL的淀粉溶液,加5滴硫酸并加热,5min后加入新制的Cu(OH)2悬浊液并加热,观察沉淀颜色变化
C
鉴别乙醇和乙酸
向KMnO4溶液中分别加入相同体积和浓度的乙醇和乙酸溶液,观察溶液颜色变化
D
探究浓度对反应速率影响
向2支盛有2mL0.01ml/LKMnO4溶液的试管中,分别加入2mL0.01ml/L和0.02ml/LH2C2O4溶液,观察溶液褪色的快慢
Al3+
Fe3+
Fe2+
Cu2+
Zn2+
开始沉淀的pH
4.0
2.7
7.6
4.4
6.2
沉淀完全的pH
5.2
3.7
9.6
6.4
8.2
实验编号
操作
现象
实验1
加入铜粉后无现象
实验2
溶液很快由蓝色变为绿色,未观察到白色沉淀;2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀
2022-2023学年重庆市缙云教育联盟高二(下)期末化学试卷(含详细答案解析): 这是一份2022-2023学年重庆市缙云教育联盟高二(下)期末化学试卷(含详细答案解析),共19页。试卷主要包含了单选题,流程题,实验题,简答题等内容,欢迎下载使用。
四川省凉山州安宁河联盟2023-2024学年高二上学期期末联考化学试题: 这是一份四川省凉山州安宁河联盟2023-2024学年高二上学期期末联考化学试题,共9页。试卷主要包含了中提取金属铜的工艺流程图,00,26,69等内容,欢迎下载使用。
四川省凉山州安宁河联盟2022-2023学年高二下学期期末联考化学试题(原卷版+解析版): 这是一份四川省凉山州安宁河联盟2022-2023学年高二下学期期末联考化学试题(原卷版+解析版),共45页。试卷主要包含了 下列说法不正确的是等内容,欢迎下载使用。












