



福建省福州市部分学校教学联盟2023-2024学年高一上学期期末质量检测化学试题
展开2023~2024学年第一学期福州市部分学校教学联盟高一年级期末质量检测
化 学 试 卷
(完卷时间:75分钟;满分:100分)
温馨提示:请将所有答案填写到答题卡的相应位置上!请不要错位、越界答题!
一、单项选择题:本题共16小题,每小题3分,共48分。在每小题所给出的的四个选项中,只有一个选项是符合题目要求的。
1.2023年10月26日搭载神舟十七号载人飞船的长征二号F发射升空,宇航员们预计会在空间站驻留约6个月,开展空间科学与应用载荷在轨实验。下列说法中不正确的是
A.“长征二号F”的推进剂液氢、液氧和N2O4,它们均为非电解质
B.光束通过火箭中隔热保温材料纳米气凝胶时,可观察到丁达尔效应
C.神舟号表面防热材料的组成成分含有金属合金,其熔点比纯金属低
D.“神舟十七号”中表面结构的主要材料是铝合金,其耐腐蚀性能强
2.下列仪器使用前不需要检查是否漏液的是
A. B. C. D.
3.日本将福岛核污水排海引起了全世界强烈谴责,核污水中含有放射性氚、碘-131、铯-134、铯-137、碳-14等伤害性物质。下列叙述正确的是
A.铯-134和铯-137核外电子数之差为3 B.碘-131核素所含中子数与质子数之差为25
C.氕、氘、氚三种核素都含有中子 D.碳-14和碳-12互为同素异形体
4.RO3n−中共有x个电子、R原子的质量数为A,则a g RO3n−中含有质子的物质的量为
A.aA+48(x+24−n)mlB.aA+48(x−24−n)ml
C.(x−n)mlD.aA+48(x−n)ml
5.下列各组离子,在溶液中能大量共存的是
A.S2-、Na+、ClO-、OH-B.Na+、HCO3-、Cl-、H+
C.Na+、Al3+、Cl-、SO42-D.H+、Fe2+、NO3-、SO42-
6.X、Y、Z都为短周期主族元素,它们在周期表中的位置如图所示。
已知X、Y两种元素的原子序数之和等于Z元素的原子序数,下列说法正确的是
A.最外层电子数:X>Z>Y B.简单离子半径由大到小:X3−>Y−
C.Z的简单气态氢化物比Y的稳定 D.Z的氧化物对应的水化物一定是强酸
7.下列化学用语错误的是
A.次氯酸的电子式:H:O····:Cl····:
B.CH4的空间填充模型:
C.用电子式表示H2O的形成过程:
D.NH3的结构式:
8.下列离子方程式书写正确的是
A.饱和Na2CO3溶液中通入过量CO2:CO32−+H2O+CO2=2HCO3−
B.CaHCO32溶液中滴入少量澄清石灰水溶液:Ca2++OH−+HCO3−=CaCO3↓+H2O
C.FeOH3中加入氢碘酸(HI)溶液:FeOH3+3H+=Fe3++3H2O
D.氯气通入水中:Cl2+H2O=2H++Cl−+ClO−
9.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.4.6g钠与足量氧气充分反应生成Na2O和Na2O2的混合物,转移电子数为0.2NA
B.用含有0.1mlFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA
C.100g4%的NaOH水溶液中含氧原子的数目为0.1NA
D.0.2ml⋅L−1的CaCl2溶液中,含有Cl−的数目为0.4NA
10.在学习了氯及其化合物的知识后,某学生绘制了如图所示的“价-类”二维图,下列叙述错误的是
A.a在水中完全电离
B.新制的b的水溶液光照一段时间后酸性增强
C.在d的水溶液中加入几滴紫色石蕊,观察到的现象是溶液变红
D.c可以用于自来水的杀菌消毒
11.如图是A、B、C三种物质的溶解度曲线图。下列说法中,不正确的是
A.t1℃时,A的溶解度小于C的溶解度
B.t1℃时,100 g水溶解40gA就可达到饱和状态
C.t1℃时,等质量的三种物质的饱和溶液中,含溶剂质最多的是B溶液
D.A和B的饱和溶液从t2℃时降到t1℃时,溶质质量分数都变小
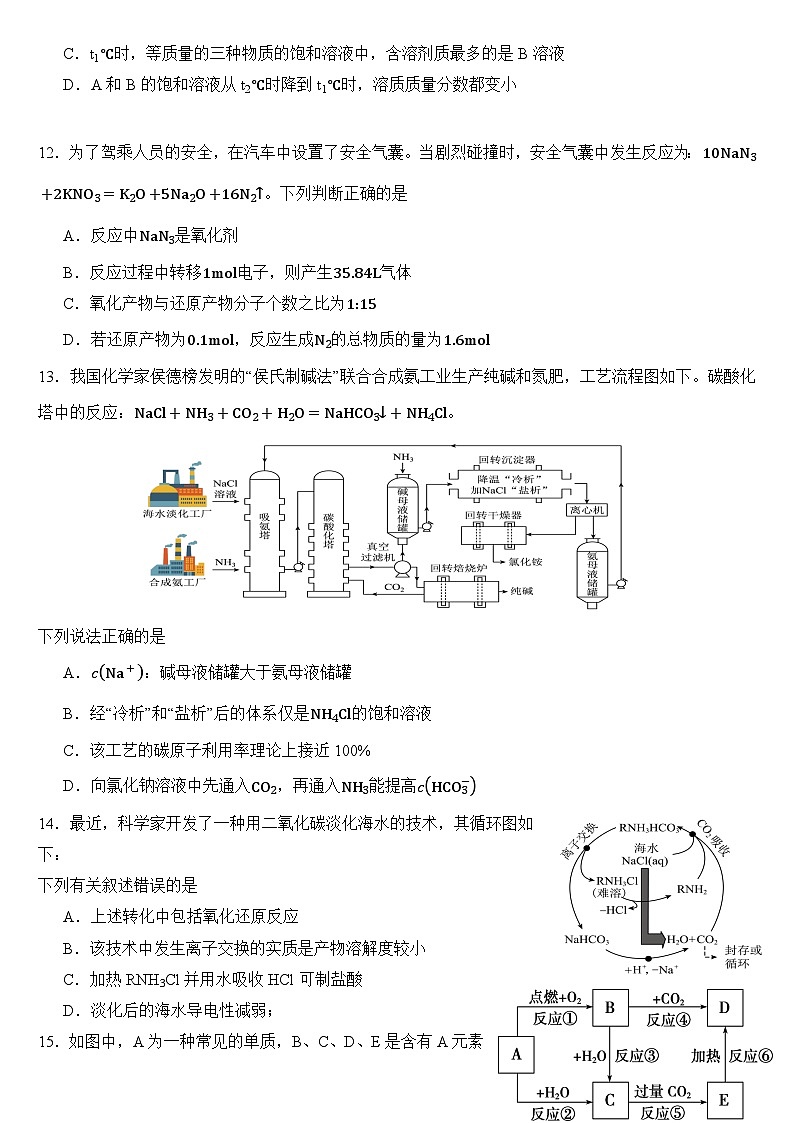
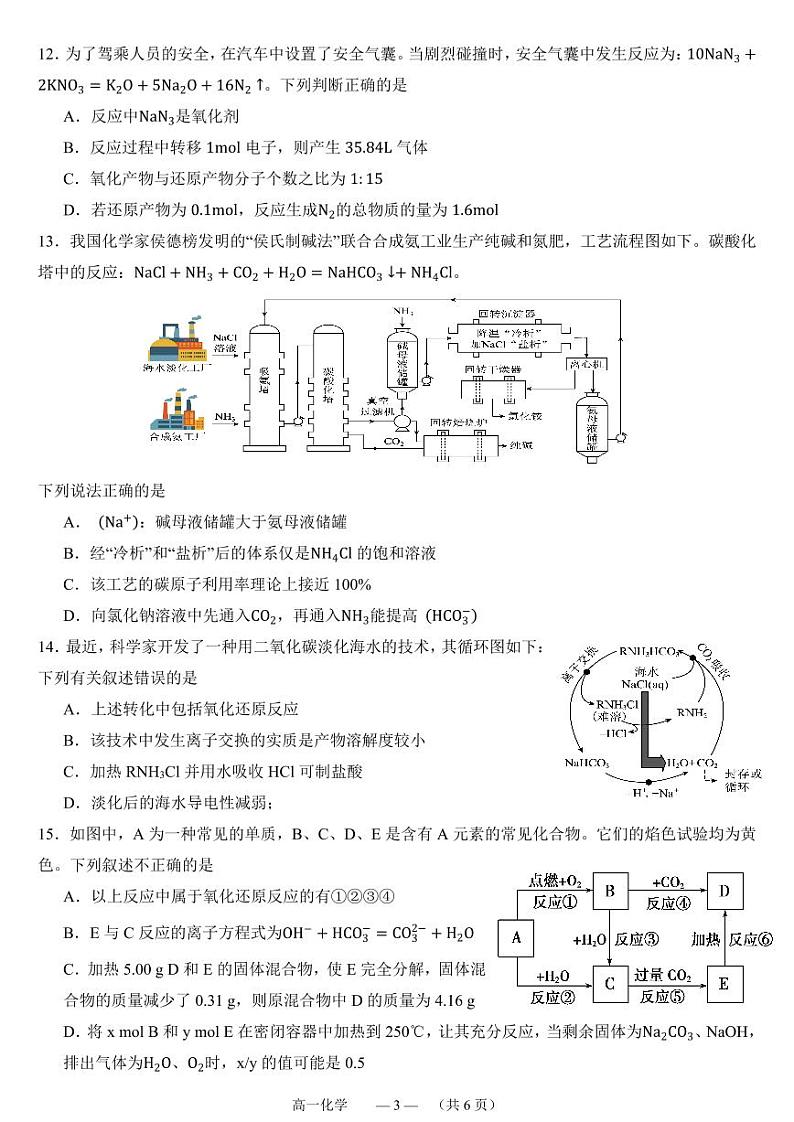
12.为了驾乘人员的安全,在汽车中设置了安全气囊。当剧烈碰撞时,安全气囊中发生反应为:10NaN3+2KNO3=K2O+5Na2O+16N2↑。下列判断正确的是
A.反应中NaN3是氧化剂
B.反应过程中转移1ml电子,则产生35.84L气体
C.氧化产物与还原产物分子个数之比为1:15
D.若还原产物为0.1ml,反应生成N2的总物质的量为1.6ml
13.我国化学家侯德榜发明的“侯氏制碱法”联合合成氨工业生产纯碱和氮肥,工艺流程图如下。碳酸化塔中的反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
下列说法正确的是
A.cNa+:碱母液储罐大于氨母液储罐
B.经“冷析”和“盐析”后的体系仅是NH4Cl的饱和溶液
C.该工艺的碳原子利用率理论上接近100%
D.向氯化钠溶液中先通入CO2,再通入NH3能提高cHCO3−
14.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:
下列有关叙述错误的是
A.上述转化中包括氧化还原反应
B.该技术中发生离子交换的实质是产物溶解度较小
C.加热RNH3Cl并用水吸收HCl可制盐酸
D.淡化后的海水导电性减弱;
15.如图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色试验均为黄色。下列叙述不正确的是
A.以上反应中属于氧化还原反应的有①②③④
B.E与C反应的离子方程式为OH−+HCO3−=CO32−+H2O
C.加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为4.16 g
D.将x ml B和y ml E在密闭容器中加热到250℃,让其充分反应,当剩余固体为Na2CO3、NaOH,排出气体为H2O、O2时,x/y的值可能是0.5
16. 向两份20 ml 0.1 ml/LBa(OH)2溶液中各加入定量的KAl(SO4)2和Al2(SO4)3溶液的导电性随
(混合前)的变化关系如图所示,下列分析不正确的是
A.a点溶液的pH值约为7 B.b点溶液中大量存在的阳离子有Al3+和Ba2+
C.c、d两点溶液中OH-均已完全反应 D.②代表加入Al2(SO4)3的变化曲线
二、非选择题:本题共3小题,共52分。
17.(14分)海水是一个巨大的化学资源宝库。实验室模拟从海水中提取溴,设计实验流程如下:
(1)海水中的溴元素存在形式是 (填“游离态”或“化合态”)。
(2)步骤(Ⅰ)中分离粗盐和母液的操作名称是 ,该操作使用的玻璃仪器有烧杯、玻璃棒和 。
(3)①步骤(Ⅳ)中主要反应的离子方程式为: (配平该离子方程式)
___________Br- +___________BrO3− +___________H+= ___________Br2+___________H2O
②该反应的还原剂与氧化剂的物质的量之比是 ,可推断氧化性:BrO3− Br2(填“>”或“<”),若生成0.2mlBr2,则转移的电子数目为 个。
(4)为了除去粗盐中Mg2+、Ca2+、SO42−及泥沙,先将粗盐溶于水,过滤后根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
18.(22分)酸雨是全球三大环境危害之一,根据其所带的酸性物质不同,酸雨分为硫酸型酸雨和硝酸型酸雨。
(1)写出硫酸型酸雨的形成过程(用化学方程式表示) 、 。
(2)有学者提出利用Fe2+、Fe3+等离子的催化作用,常温下将SO2氧化成SO42−而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42−的转化率。
①测定模拟烟气中SO2的体积分数:该小组采用下图装置进行测定,X溶液可以是 (选填字母)。
a.氯化钡溶液 b.酸性高锰酸钾溶液 c.氢氧化钠溶液
②测定转化器中SO2氧化成SO42−的转化率:若上述实验是在标准状况下进行的,已知气体流速,还需测定的数据有 、 。
(3)如图是对煤燃烧产生的废气进行脱硫处理的基本流程图,请写出废气脱硫过程中发生的主要反应的化学方程式。
① 、
②废气脱硫以后含量明显增加的气体是 ,它对环境的负面影响是 。
③检验脱硫后的气体中是否含有SO2的简单方法是 。
19.(16分)二氧化氯(ClO2)是安全消毒剂,杀菌能力优于氯气。常温下ClO2为黄绿色气体,极易溶于水但不与水反应,浓的ClO2受热时易分解,将其制备成NaClO2固体以便运输和储存。过氧化氢法制备NaClO2固体的实验装置如图所示。
已知:i.装置A用于制备ClO2,发生的主要反应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
ii.NaClO2饱和溶液在低于38℃时会析出NaClO⋅3H2O晶体,高于38℃时析出NaClO2晶体
(1)该实验中,盛放70%硫酸所用仪器的名称是 。
(2)关闭止水夹②,打开止水夹①③,通空气一段时间,ClO2与装置C中物质反应生成NaClO2的化学方程式为 。若关闭止水夹③,打开止水夹①②,B装置的作用是 。
(3)制备NaClO2过程中需要控制空气的流速,过快或过慢均会降低NaClO2产率,原因是 。
(4)D装置是用NaOH溶液吸收尾气中的ClO2,生成物质的量之比为1∶1的两种盐,一种为NaClO2,另一种盐的化学式为 。充分反应后,从装置C反应后溶液中获取NaClO2固体的操作步骤是:减压蒸发、 ,洗涤、干燥。
(5)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到溶液。上述过程中,产生“气泡”的离子方程式为 。
(6)ClO2对污水中CN−有明显的去除效果,其原理为:2ClO2+2CN−=2CO2+N2+2Cl−。某污水中含有CN−浓度为104mg/L。处理2000L这种污水,至少需要ClO2 ml;若用Cl2处理相同的废水时,所需Cl2的物质的量是ClO2的 倍。
实验步骤
试剂
预期沉淀的离子
步骤1
BaCl2溶液
SO42−
步骤2
步骤3
安徽省部分学校2023-2024学年高一上学期期末质量检测化学试题: 这是一份安徽省部分学校2023-2024学年高一上学期期末质量检测化学试题,共8页。
福建省福州市四校教学联盟2023-2024学年高一上学期12月阶段适应性检测化学试题(Word版附解析): 这是一份福建省福州市四校教学联盟2023-2024学年高一上学期12月阶段适应性检测化学试题(Word版附解析),共17页。试卷主要包含了5 Fe-56 Mn-55, 下列说法中不正确的是等内容,欢迎下载使用。
福建省福州市九师教学联盟2023-2024学年高一上学期期末学业联考化学试题(Word版附解析): 这是一份福建省福州市九师教学联盟2023-2024学年高一上学期期末学业联考化学试题(Word版附解析),共14页。试卷主要包含了2LCO2中含有原子的数目为0,0g,36g配成待测溶液,加入0,0 ml/L,75%, 5等内容,欢迎下载使用。












