

化学必背知识手册分类第四章 物质结构 元素周期律 -【知识手册】(人教版必修第一册)(教师版)14
展开
这是一份化学必背知识手册分类第四章 物质结构 元素周期律 -【知识手册】(人教版必修第一册)(教师版)14,共12页。学案主要包含了原子结构,元素在周期表,核素,原子结构与元素的性质等内容,欢迎下载使用。
一、原子结构
1、原子的构成
原子由原子核和核外电子组成(原子核包括质子和中子),质子带 正电 ,电子带 负电 ,中子中立 不带电 。
2、质量数
(1)概念:将核内所有 质子 和 中子 的相对质量取近似整数值相加,所得的数值。
(2)构成原子的粒子间的两个关系
①质量数(A)= 质子数(Z) + 中子数(N)
②质子数= 核电荷数 =核外电子数
3、原子的表示方法
如作为相对原子质量标准的eq \\al(12, 6)C表示质子数为 6 ,质量数为 12 的碳原子。
4、粒子符号(eq \\al(A,Z)eq \(X,\s\up6(±b))eq \\al(n±,m))中各数字的含义
5、原子核外电子排布的表示方法
(1)原子结构示意图
用小圆圈和圆圈内的符号及数字表示 原子核 及 核内质子数 ,弧线表示各电子层,弧线上的数字表示该电子层上的电子数。以钠原子为例:
(2)离子结构示意图
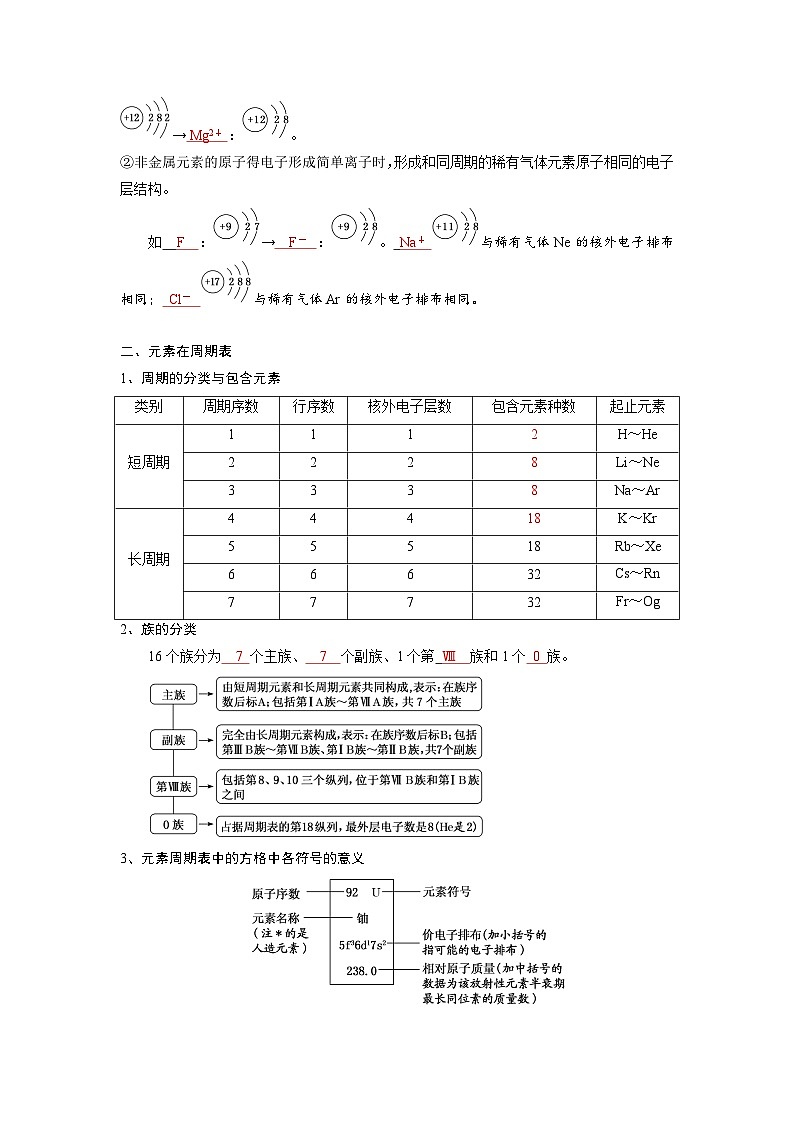
①金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排的电子数也相同)。如 Mg :→ Mg2+ :。
②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体元素原子相同的电子层结构。
如 F :→ F- :。 Na+ 与稀有气体Ne的核外电子排布相同; Cl- 与稀有气体Ar的核外电子排布相同。
二、元素在周期表
1、周期的分类与包含元素
2、族的分类
16个族分为 7 个主族、 7 个副族、1个第 Ⅷ 族和1个 0 族。
3、元素周期表中的方格中各符号的意义
注:元素周期表记忆口诀
横行叫周期,现有一至七;
三四分长短,四长副族现;
竖行称作族,总共十六族;
Ⅷ族最特殊,三列是一族;
二三分主副,先主后副族;
镧锕各十五,均属ⅢB族。
4、元素在周期表中的位置与原子结构的相互推断
(1)元素的位置与原子结构的关系
(2)短周期元素原子结构与位置的关系
①族序数等于周期数的元素有 H、Be、Al 。
②族序数是周期数2倍的元素有 C、S 。
③族序数是周期数3倍的元素是 O 。
④周期数是族序数2倍的元素是 Li 。
⑤周期数是族序数3倍的元素是 Na 。
5、由元素的原子序数推断元素在周期表中的位置
常用0族元素定位法:
(1)明确0族元素信息
(2)比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,若该元素的原子序数小于相邻近0族元素的原子序数,那么该元素就和原子序数大的0族元素处于同一周期,反之则在下一周期。
(3)求差值定族数
①若某元素的原子序数比相应的0族元素多 1或2 ,则该元素应处在该0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
②若某元素的原子序数比相应的0族元素少 5~1 时,则该元素处在同周期的第ⅢA~ⅦA族。
③若某元素的原子序数与相应的0族元素相差 其他数 ,则由相应差数找出相应的族。
三、核素
1、核素
(1)概念:具有一定数目质子和一定数目中子的一种原子。
(2)实例
①氢元素的三种核素
②氧元素的三种核素:eq \\al(16, 8)O、 eq \\al(17, 8)O 和eq \\al(18, 8)O。
③碳元素的三种核素:eq \\al(12, 6)C、eq \\al(13, 6)C和 eq \\al(14, 6)C 。
④铀元素有eq \\al(234, 92)U、eq \\al(235, 92)U、eq \\al(238, 92)U等核素。
2、同位素
(1)概念:质子数相同而 中子数 不同的同一元素的不同原子互为同位素。
(2)性质
①同一元素的各同位素虽然 质量数 不同,但它们的化学性质基本相同。
②天然存在的同位素,相互间保持一定的比率。
(3)用途
①考古时利用 eq \\al(14, 6)C 测定一些文物的年代。
②eq \\al(2,1)H和 eq \\al(3,1)H 用于制造氢弹。
③利用放射性 同位素 释放的射线育种、给金属探伤、诊断和治疗疾病等。
3、“四素”的区别
四、原子结构与元素的性质
(一)碱金属元素
1、钠、钾与氧气反应的实验
(1)总结:相同条件下,碱金属从Li到Cs,与 O2 反应越来越剧烈, 产物 越来越复杂,说明金属越来越 活泼 。
(2)结论为与水反应的剧烈程度: K>Na ;金属活泼性: K>Na 。
2、碱金属单质的主要物理性质
3、碱金属元素化学性质的相似性和递变性
(1)相似性(用R表示碱金属元素)
(2)递变性
具体表现如下(按Li→Cs的顺序)
①与O2的反应越来越剧烈,产物越来越复杂,如Li与O2反应只能生成 Li2O ,Na与O2反应生成 Na2O、Na2O2 ,而K与O2反应能够生成 K2O、K2O2、KO2 ,Rb、Cs遇空气立即 燃烧 ,生成更复杂的产物。
②与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微 爆炸 ,Rb和Cs遇水会发生爆炸。
③最高价氧化物对应水化物的碱性逐渐增强,即碱性: LiOH
相关学案
这是一份化学必背知识手册分类第四章 生物大分子-【知识手册】(人教版选择性必修3)(教师版)15,共10页。学案主要包含了糖类的组成和分类,蛋白质等内容,欢迎下载使用。
这是一份化学必背知识手册分类第二章 海水中的重要元素——钠和氯-【知识手册】(人教版必修第一册)(教师版)3,共13页。学案主要包含了活泼的金属单质——钠,钠的几种化合物,焰色试验,纯碱的生产历史等内容,欢迎下载使用。
这是一份化学必背知识手册分类第八章 化学与可持续发展【知识手册】(人教版必修第二册)(教师版)2,共7页。学案主要包含了金属矿物的开发利用,海水资源的开发利用等内容,欢迎下载使用。








