

江苏省泰州2023_2024高三化学上学期期初调研考试试题
展开可能用到的相对原子质量:H-1 Li-12 C-12 N-14 O-16 F-19 P-31
S-16 V-51 Fe-56 C-59
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
1.有利于实现“碳达峰、碳中和”的是( )
A.风能发电B.粮食酿酒C.燃煤脱硫D.石油裂化
2.下列化学用语或图示表达正确的是( )
A.分子的球棍模型:
B.的VSEPR模型:
C.基态原子价层电子轨道表示式:
D.电子云轮廓图:
3.X、Y、Z、W四种短周期主族元素,原子序数依次增大。X、Y与Z位于同一周期,且只有X、Y元素相邻。X基态原子核外有2个未成对电子,原子在同周期中原子半径最大。下列说法不正确的是( )
A.第一电离能:
B.X单质中只有共价键
C.Z、W原子形成稀有气体电子构型的简单离子的半径:
D.与水反应生成产物之一是非极性分子
4.完成下述实验,装置或试剂不正确的是( )
A.图①装置可除去中混有的少量
B.图②装置可用于制取并收集氨气
C.图③操作可排出盛有溶液滴定管尖嘴内的气泡
D.图④装置可用于测量体积
阅读下列资料,完成5~7题:含氯化合物在生产生活中应用广泛。舍勒发现将软锳矿和浓盐酸混合加热可产生氯气,该方法仍是当今实验室制备氮气的主要方法之一。工业上以为原料可制得、、、和等。在催化剂作用下,通过氧气直接篻化氯化氢制备氮气。该反应为可逆反应,热化学方程式为。
5.下列有关说法正确的是( )
A.与的晶体类型相同
B.和中的夹角都为
C.中基态时末成对电子数为5
D.与都是由极性键构成的极性分子
6.下列化学反应表示正确的是( )
A.实验室制氯气:
B.电解饱和溶液的阴极反应:
C.
D.氯气溶于水具有漂白性:
7.下列有关物质的性质与用途具有对应关系的是( )
A.能溶于水,可用于工业制盐酸B.有强篻化性,可用于水体消毒
C.溶液显酸性,可用作漂白剂D.受热易分解,可用作氮肥
8.硫及其化合物的转化具有重要应用。下列说法不正确的是( )
A.废水中的可以被还原后除去
B.大气中的遇雨水最终形成进入地面或海洋
C.工业排放尾气中的可与和反应生成
D.水垢中的可与饱和溶液反应生成
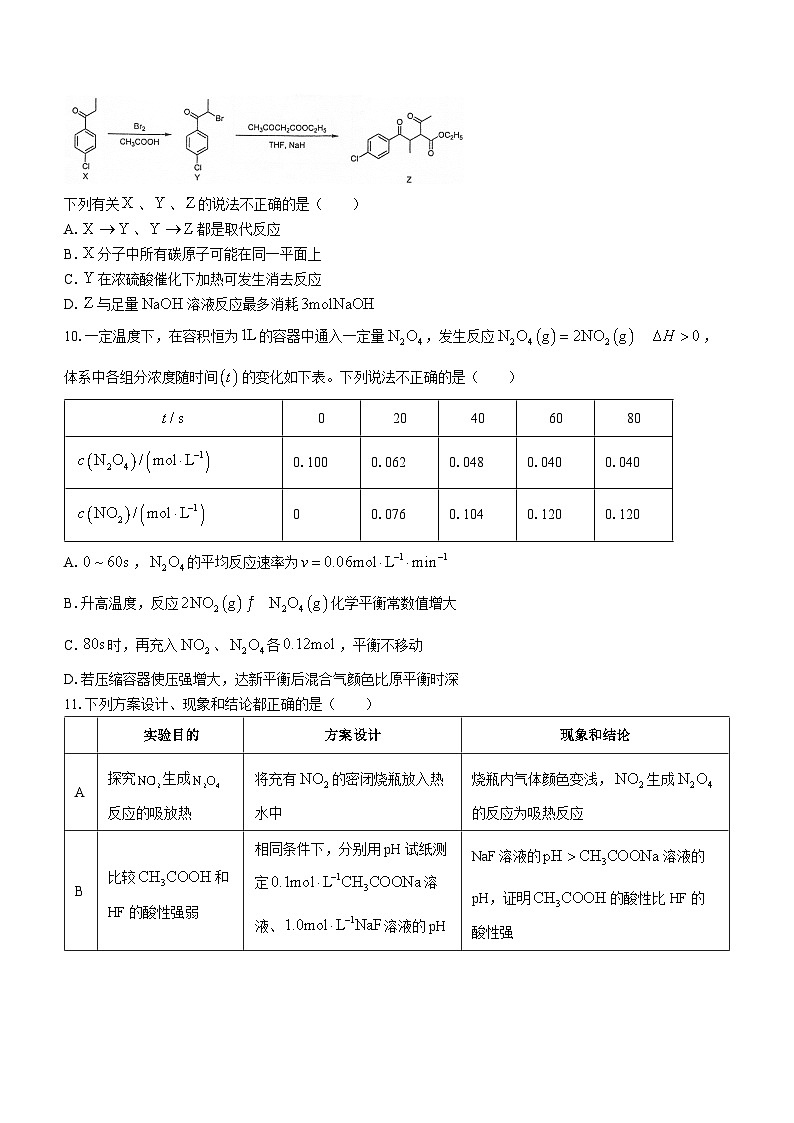
9.化合物是合成用于降低体重、缩小腰围药物利莫那班的重要中间体。
下列有关、、的说法不正确的是( )
A.、都是取代反应
B.分子中所有碳原子可能在同一平面上
C.在浓硫酸催化下加热可发生消去反应
D.与足量溶液反应最多消耗
10.一定温度下,在容积恒为的容器中通入一定量,发生反应,体系中各组分浓度随时间的变化如下表。下列说法不正确的是( )
A.,的平均反应速率为
B.升高温度,反应化学平衡常数值增大
C.时,再充入、各,平衡不移动
D.若压缩容器使压强增大,达新平衡后混合气颜色比原平衡时深
11.下列方案设计、现象和结论都正确的是( )
12.为二元弱碱。室温下,配制一组的与的混合溶液,溶液中相关组分的物质的量分数随溶液变化的曲线如下图所示,下列说法正确的是( )
A.由图可知的
B.的溶液中:
C.等物质的量的和混合溶液中
D.在的水溶液中,
13.用草酸二甲酯和氢气为原料制备乙二醇的反应原理如下:
乙醇酸甲酯
在条件下,将氢气和草酸二甲酯体积比(氢酯比)为的混合气体以一定流速通过装有催化剂的反应管,草酸二甲酯的转化率、产物的选择性与温度的关系如下图所示。产物的选择性。下列说法不正确的是( )
A.曲线I表示草酸二甲酯的转化率随温度的变化
B.其他条件不变,增大压强或升高温度,草酸二甲酯的平衡转化率均增大
C.其他条件不变,在温度范围,随着温度升高,出口处乙醇酸甲酯的量不断增大
D.其他条件不变,在温度范围,随着温度升高,出口处甲醇和乙二醇的物质的量之比逐渐减小且大于2
二、非选择题:共4题,共61分
14.(15分)锌冶炼过程中产生的锌渣主要成分为铁酸锌和二氧化硅,以及少量的铜、铁、锌的氧化物和硫化物。利用酸溶的方法可溶出金属离子,使锌渣得到充分利用。
(1)铁酸锌酸溶。铁酸锌难溶于水,其晶胞由A、B结构按照交替累积而成,如图1所示。将铁酸锌粉末投入到中,保温,匀速搅拌。浸出液中和的浓度随时间的变化如下表所示。
①B结构的化学式为________。
②铁酸锌和硫酸反应的离子方程式为________。
③酸溶时,溶出效率较高的金属离子是________。
图1 图2
(2)锌渣酸溶。将锌渣放入、以及三种体系中实验,保持,匀速搅拌,所得结果如图2所示。已知:时,;;;;和可溶于稀硫酸,和不溶于稀硫酸。
①在体系中,漫出率较高的原因是________。
②在体系中,溶渣中的质量增加,原因是________。
15.(15分)有机物是一种新型大环芳酰胺的合成原料,可通过以下方法合成:
(1)A中采用杂化方式的碳原子有________个。
(2)的反应类型为________。
(3)若B直接硝化,最后主要产物的结构简式为________。
(4)写出一种符合下列条件的B的同分异构体的结构简式:________。
①能与溶液发生显色反应;
②分子中含有2个苯环,共有3种不同化学环境的氢原子。
(5)已知:,写出以、和为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
16.(16分)以废旧锂离子电池的正极材料[活性物质为、附着物为炭黑、聚乙烯醇粘合剂、淀粉等]为原料,制备纳米钴粉和。
(1)预处理。将正极材料研磨成粉末后进行高温煆烧。高温抜烧的目的是________。
(2)浸出。将煅烧后的粉末(含和少量难溶杂质)与硫酸混合,得到悬浊液,加入如图1所示的烧瓶中。控制温度为,边搅拌边通过分液漏斗滴加双氧水,充分反应后,滤去少量固体残渣,得到、和硫酸的混合溶液。漫出实验中当观察到________,以判断反应结束,不再滴加双氧水。
图1 图2 图3
(3)制钴粉。向浸出后的溶液中加入调节,接着加入可以制取单质钴粉,同时有生成。已知不同时(Ⅱ)的物种分布图如图2所示。可以和柠檬酸根离子生成配合物。
①写出时制钴粉的离子方程式:________。
②后所制钴粉中由于含有而导致纯度降低。若向的溶液中加入柠檬酸钠,可以提高钴粉的纯度,原因是________。
(4)请补充完整由浸取后滤液先制备,并进一步制取的实验方案:取浸取后滤液,________,得到。[已知:易溶于水,难溶于水,在空气中加热时的固体残留率)与随温度的变化如图3所示。实验中须使用的试剂有溶液、溶液]
(5)用下列实验可以测定的组成:
实验1:准确称取一定质量的样品,加入盐酸,加热至固体完全溶解(溶液中的金属离子只存在和),冷却后转移到容量瓶中并定容至。
实验2:移取实验1容量瓶中溶液,加入指示剂,用溶液滴定至终点(滴定反应为),平行滴定3次,平均消耗EDTA溶液。
实验3:准确称取与实验1中等质量的样品,加入一定量的硝酸和溶液,加热至固体完全溶解。冷却后转移到容量瓶中并定容至。移取溶液,通过火焰原子吸收光谱法测定其中浓度为。
计算化学式中的值,并写出计算过程。
17.(15分)乙苯被吸附在催化剂表面发生脱氢可生成苯乙烯、苯甲醛等,生成苯乙烯的相关反应如下。反应1:
反应2:
反应3:
(1)反应4:________。
(2)较低温度下,向乙苯脱氢的反应体系中加入少量,乙苯平衡转化率较高而苯乙烯的选择性较低,其原因可能是________。
(3)向乙苯脱氢反应体系中加入,乙苯转化率与体系中分压强的关系如题图1所示。随的增加,乙苯转化率先增大后减小的可能原因为________。
图1 图2
(4)研究发现在催化剂表面进行的乙苯脱氢反应中,(+5价)是反应的活性中心,转化过程如题图2所示。
①转化Ⅰ发生反应的化学方程式为________。反应一段时间后,催化剂活性有所下降,原因可能有反应过程产生的积碳覆盖在活性中心表面和________。
②简述转化Ⅱ的作用________。
③参与的乙苯脱氢机理如题图3所示(、表示乙苯分子中或原子的位置;为催化剂的活性位点,其中位点带部分正电荷,、位点带部分负电荷)。
图3
图中所示反应机理中步骤Ⅰ和步骤Ⅱ可描述为________。
化学试卷评分标准
一、单项选择题:共13题,每题3分,共39分
1.A 2.D 3.B 4.D 5.D 6.A 7.B 8.A 9.C 10.B 11.C 12.C 13.B
二、非选择题:共4题,共61分
14.(14分)
(1)①或(3分)
②(3分)
③(2分)
(2)①与体系相比体系中浓度更大,有利于、、溶出、通入发生反应,增大了浓度,降低了浓度,促进等溶出(3分)
②酸浸时产生的被还原成+1价的铜,与、提供的转化为(3分)
15.(15分)
(1)8(2分)
(2)取代反应(2分)
(3)(3分)
(4)或
(5)(5分)
16.(17分)
(1)除去正极材料中的炭黑、聚乙烯醇、淀粉等有机物(2分)
(2)圆底烧瓶中不再产生气泡(2分)
(3)①(3分)
②与柠檬酸钠反应生成配合物,能抑制生成[或促进溶解](2分)(4)边搅拌边加入溶液,当静置后向上层清液中加入溶液不再产生沉淀时,停止滴加,过滤,用蒸馏水洗涤至取最后一次洗涤滤液加入溶液时无沉淀生成,将固体在下加热,当残余固体质量不再发生变化后停止加热(5分)
(5)样品中
样品中
(3分)
17.(15分)
(1)-124.2(2分)
(2)加入少量,与反应放热,氢气浓度减小和体系温度升高都使反应1平衡右移使乙苯转化率升高,但温度升高,苯乙烯(或乙苯)被进一步氧化成苯乙醛等副产物(2分)
(3)前一阶段,随着分压强增大,反应2的平衡正向移动,降低了,促进反应1正向进行,使乙苯转化率增大。当分压强过大多时,占据了催化剂表面,使催化剂表面吸附的乙苯减少,乙苯转化率下降(2分)
(4)①(2分)
催化剂中V(+5价)的含量减少(2分)
②将转化为,使催化剂获得再生,同时可以消除积碳(2分)
③乙苯带部分正电荷,被带部分负电荷的位点吸引,随后解离出并吸附在位点上;位点上的与位点上中带部分负电荷的作用生成生成,带部分正电荷的吸附在带部分负电荷的位点上(3分)0
20
40
60
80
0.100
0.062
0.048
0.040
0.040
0
0.076
0.104
0.120
0.120
实验目的
方案设计
现象和结论
A
探究生成反应的吸放热
将充有的密闭烧瓶放入热水中
烧瓶内气体颜色变浅,生成的反应为吸热反应
B
比较和HF的酸性强弱
相同条件下,分别用pH试纸测定溶液、溶液的pH
NaF溶液的溶液的pH,证明的酸性比HF的酸性强
C
比较氢氧化铜和氢氧化镁的大小
向浓度均为的、混合溶液中逐滴加入NaOH溶液
先出现蓝色沉淀,
D
镀锌铁皮锌镀层厚度的测定
装有镀锌铁皮的烧杯中加入足量稀硫酸
产生气泡的速率突然减小,证明镀锌层完全反应
0.5
1.0
1.5
2.0
2.5
0.10
0.11
0.15
0.21
0.21
0.12
0.13
0.16
0.21
0.30
2023-2024学年江苏泰州中学高三期初调研考试 化学试题(含答案): 这是一份2023-2024学年江苏泰州中学高三期初调研考试 化学试题(含答案),共11页。
江苏省泰州中学2023-2024高三上学期期初调研化学试卷+答案: 这是一份江苏省泰州中学2023-2024高三上学期期初调研化学试卷+答案,共11页。
2024泰州中学高三上学期期初调研考试化学含答案: 这是一份2024泰州中学高三上学期期初调研考试化学含答案,文件包含江苏省泰州中学2023-2024学年高三上学期期初调研考试化学docx、江苏省泰州中学2023-2024学年高三上学期期初调研考试化学答案docx等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。












