




江苏省南通六市2024年高考化学一模考前押题化学卷(Word版含解析)
展开一、 单选
1. 元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的是
A. 反应①表明 Cr₂O ₃有酸性氧化物的性质
B. 反应②发生时应避免溶液温度过高
C. 反应②的离子方程式为 2CrO + 3H2 O2 + 2OH− = 2CrO− + 4H2 O
D. 反应②③中铬元素的化合价均发生了变化
2. 下列关于化学用语的表示正确的是
A. 镁离子结构示意图:
B. 质子数与中子数相等的硫原子: 16 S
16
C. 二氟化氧分子电子式:
D. 二甲苯的分子式: C₈H₁₀
3. 下列符合元素周期律的是
A. 碱性: CaOH〕₂ > Mg OH ₂ B. 酸性: H₂ SO₃ > H₂CO₃
C. 热稳定性: NH₃ < PH₃ D. 还原性: S2− < CI−
4. 下列现象或事实中不能用同一原理解释的是
A. 浓硝酸和氯水用棕色试剂瓶保存
B. 硫化钠和亚硫酸钠固体长期暴露在空气中变质
C. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
D. 二氧化硫和乙烯使酸性高锰酸钾溶液褪色
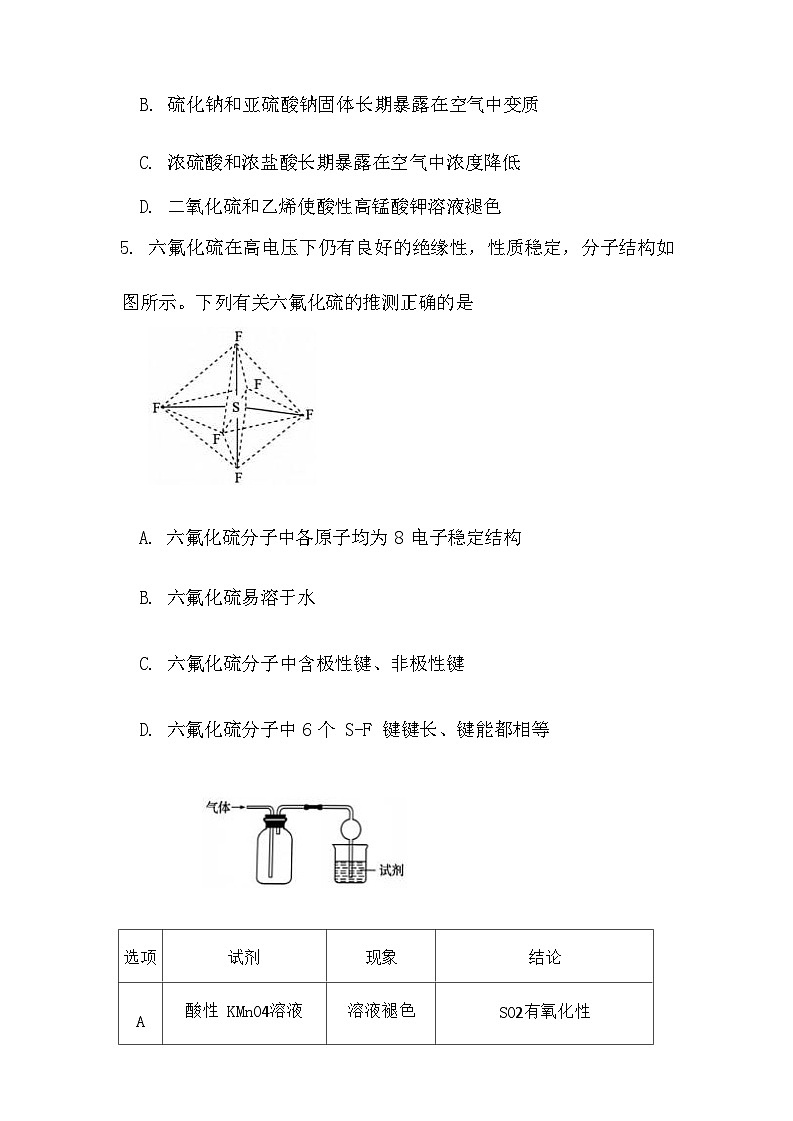
5. 六氟化硫在高电压下仍有良好的绝缘性,性质稳定,分子结构如
图所示。下列有关六氟化硫的推测正确的是
A. 六氟化硫分子中各原子均为 8 电子稳定结构
B. 六氟化硫易溶于水
C. 六氟化硫分子中含极性键、非极性键
D. 六氟化硫分子中 6 个 S-F 键键长、键能都相等
选项
试剂
现象
结论
A
酸性 KMnO4溶液
溶液褪色
SO2有氧化性
B
品红溶液
溶液褪色
SO2有漂白性
C
NaOH 溶液
无明显现象
SO2与 NaOH 溶液不反应
D
溴水
溶液褪色
SO2有漂白性
A. A B. B C. C D. D
7. 在一定条件下,反应: 2SO₂ g) + O₂ g〕= 2SO₃ g〕达到了平衡,改变
某一条件,发生下述变化,其中可确定该平衡一定发生移动的是
A. O2 的百分含量发生变化 B. SO3 的密度不变
C. v(SO2)增大 D. v(SO3) 减小
8. 下列离子方程式中能正确表达反应现象的是
A. 向偏铝酸钠溶液中加入小苏打溶液,出现白色沉淀: AlO + HCO
Hl 双氧水中, 得到无色溶液 : 2MnO
+H₂ O₂ + 6H⁺ = 2Mn²⁺ + 3O₂ ↑+ 4H₂ O
C. 将铁棒和铜棒靠紧插入 AgNO3溶液中,铜棒表面附着银白色金属:
2Ag⁺ + Cu = 2Ag + Cu²⁺
D. 向久置的浓硝酸中通入空气,浓硝酸的黄色消失: 4NO + 3O₂ +
2H₂ O = 4H⁺ + 4NO
9.3-氨基-1-金刚烷醇是一种重要的医药中间体,其分子结构如图。 下
列说法正确的是
A. 分子中 H、O 之间形成 s-p σ键
B. 分子间存在 4 种氢键
C. 该物质存在芳香族化合物的同分异构体
D. 分子中带有*的碳原子均为手性碳原子
10. 通过膜电池可除去废水中的乙酸钠和对氯苯酚 ,
其原理如图所示,下列说法错误的是
A. 环境温度对该电池会有影响
B. 每消耗 1mlCH₃COO⁻ , 电路中通过的电子数为 8NA
C. 均能与氯化铁溶液发生显色反应
D. 该电池工作时,外电路中的电流由 b 极流向 a 极
11. 下列离子方程式书写正确的是 ( )
A. 稀盐酸滴在铜片上: Cu + 2H⁺ = Cu²⁺ + H₂ ↑
B. 石灰石上滴加稀醋酸: CaCO₃ + 2H⁺ = Ca²⁺ + H₂O + CO₂ ↑
C. 氧化镁与稀盐酸混合: MgO + 2H⁺ = Mg²⁺ + H₂ O
D. 铜片插入硝酸银溶液中: Cu + Ag⁺ = Cu²⁺ + Ag
12. 常温下, 0.2ml/LCH₃COOH 溶液与 0.1ml/L NaOH 溶液等体积
混合后(忽略混合前后溶液体积的变化),溶液的 pH<7,则下列有关
此溶液的叙述正确的是
A. 溶液中由水电离产生的 H⁺ 浓度为 1 × 10⁻ ⁷ml/L
B. c (CH₃COO⁻ + cCH₃COOH) − c Na⁺) = 0.05ml/L
C. 溶液中 CH₃COOH 的电离程度小于( CH₃COONa 的水解程度
D. 溶液中离子浓度的大小关系为:c Na⁺ > cCH₃COO⁻) > cH⁺) >
c OH⁻)
13. 下列有关反应热的叙述中正确的是
氢气的燃烧热为 △ H = − 241.8kJ ⋅ ml⁻ ¹
①已知 2H₂ g + O₂ g = 2H₂ O g △ H = − 483.6kJ ⋅ ml⁻ , 则
②由单质 A 转化为单质 B 是一个吸热过程,由此可知单质 B
比单质 A 稳定
③X(g)+Y(g) = Z(g) +W(s) ΔH>0,恒温恒容条件下达到平衡
后加入 X , 上述反应的ΔH 增大
④已知:
上表数据可以计算出 的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生
成 1mlc0₂固体时,放出的热量相等
⑥25℃, 101 kPa 时, 1ml 碳完全燃烧生成 CO₂所放出的热量为
碳的燃烧热
A.①②③④ B. ③④⑤ C. ④⑤ D.⑥
二、解答题
14. 碱式碳酸锰 Mn₂OH₂ CO₃ 一种不溶于水的固体,是制造其他含 锰化合物的原料。工业上以方锰矿(主要成分为 MnO,还含有少量的
Fe₃O₄ 、Al₂O₃ 、CaO 、SiO₂)为原料制备碱式碳酸锰。
共价键
C—C
C=C
C ―H
H ―H
键能/(kJ·ml-1)
348
610
413
436
25° C 时,相关物质的 Ksp 如下表:
回答下列问题:
(1)“酸浸 ”时,滤渣Ⅰ的成分是 (填化学式)。
(2)“氧化 ”时,该反应的离子方程式为 。
(3)“除杂 ”时,使用氨水的目的是将 Fe³⁺和 Al³⁺转化为沉淀而除去,
则调节溶液的pH≥ : 若 Al³沉淀完全时,则溶液中 Fe³⁺的
物质的量浓度为 ml·L- 1 , (通常认为溶液中的离子浓度
≤ 1 × 10⁻ ⁵ml ⋅ L⁻ ¹沉淀完全)
( 4 ) “ 离 子 交 换 ” 和 “ 洗 脱 ” 时 , 发 生 反 应 : Mn2+ +
2HR MnR2 + 2H+ (HR 是氢型交换树脂)。洗脱为了提高“洗
脱 ”效率, 淋洗液应呈 (填“酸 ”、“碱 ”或“ 中 ”)性。 (5)“沉锰 ”时,反应的离子方程式为 ,过滤、 洗涤、 干
燥,得到 Mn₂OH ₂ CO₃,确保洗涤干净的操作是 。
(6)为测定产品中锰的含量,取 ag 样品于烧杯中,加水溶解,加入
足量的稀硫酸溶解,滴加过量的 0.1000ml ⋅ L⁻ ¹ NH₄ ₂S₂O₈ 溶液将 锰元素转化为 Mn0,, 充分反应后加热一段时间,冷却将烧杯中的
溶液全部转移至 250mL 容量瓶中。取 25.00mL 于锥形瓶中,用
0.1000ml ⋅ L - ¹Fes04 标准溶液滴定,达滴定终点时,消耗 Fes04
溶液的体积为 VmL。
物质
Mn (OH)2
Fe(OH)2
Fe(OH)3
Al(OH)3
Ca(OH)2
Ksp
2×10-13
5×10-17
3×10-39
1×10-32
6×10-6
①滴定终点的现象是 。
②该产品中锰的质量分数为 。 (用含 a、V 的式子表示)。
15. 高聚物 H 可用于光刻工艺中,作抗腐蚀涂层。下列是高聚物 H 的一
种合成路线:
已知:①D 属于高分子化合物;
请回答下列问题:
(1)A 的化学名称为 。
(2)B 中含氧官能团的名称是 。
(3)由 A 生成 B 和 Y 生成 E 的反应类型分别为 。
(4)由 F 生成 G 的化学方程式为 。
(5)H 的结构简式为 。
(6)只有一种官能团的芳香化合物 W 是 G 的同分异构体,W 能发生 银镜反应,其中核磁共振氢谱为四组峰,峰面积 比为 3:2:2:1
的结构简式为 。
(7)参照上述合成路线,设计由对二甲苯和乙酸为原料制备
HOOCCH = CH −CH = CHCOOH 的合成路线(无机 试剂任选)
。
1 6 . 现 有 铁 粉 、 铜 粉 和 Cu0OH ₂ 三 种 固 体 , 以 及
CuSO₄ 、KOH 、KNO₃ 、FeSO₄ 、K₂ SO₄ 和稀硫酸等 6 种溶液,它们中
的某几种在常温下相互转化,关系如下:
①固体甲+溶液 B=溶液 C+水
②溶液 A+溶液 C=固体甲+溶液 D
③固体乙+溶液 B=溶液 E+氢气
试回答下列问题。
(1) 根据以上关系推断出(写化学式)
甲 乙 B B
(2) 写出上述反应的离子方程式
① ;
② ;
③ 。
17. 乙醇与水催化反应可以制得氢气。
( 1 ) 已 知 : C₂H₅OH g〕+ H₂ O g ) ⇌ 2CO g + 4H₂ g △ H₁ =+
255.7kJ/ml, 回答下列问题:
①升温, 平衡 移动(填“ 向左 ”、“ 向右 ”、“不 ”);
②与原平衡相比较, 增大压强,新平衡时 c(CO) (填“增大 ”、
“减小 ”、“不变 ”,下同) ;
;
③恒温、恒容条件下。 加入水蒸气,转化率 a C₂H₅0H
④恒温、恒压条件下,加入稀有气体,体积分数 φ C ₂H₅0H
。
(2)乙醇与水催化制氢同时发生以下三个反应,回答下列问题:
反 应 Ⅰ : C₂ H₅OH g ) + H₂ O g ⇌ 2CO g + 4H₂ g △ H₁ =+ 255.7kJ/
ml
反应Ⅱ: CO g ) + H₂ O g ⇌ CO₂ g) + H₂ g △ H₂
反 应 Ⅲ : C₂ H₅OH g ) + 3H₂ O g ⇌ 2CO₂ g) + 6H₂ g △ H₃ =+
173.3kJ/m
则 △ H₂ =kJ/ml。
(3)压强为 100kPa, H₂ 的平衡产率与温度、 起始时 的关 系如图所示,x、y、z 三条曲线上的点都代表 H₂在不同条件下的平衡
产率,且每条曲线上 H₂ 的平衡产率相同,如:A、B 两点的 H₂平衡产
率相等,B、C 两点的 H₂平衡产率不相等。
H₂ 的平衡产率: B 点 C 点(填“> ”或“< ”)。
(4)恒容条件下,将 1mlC₂ H₅OH g 和 3mlH ₂O(g)投入密闭容器中发 生上述三个反应,平衡时 CO₂ 的选择性、平衡时 CO 的选择性、平衡
时乙醇的转化率随温度的变化曲线如图所示。
【已知: CO 的选择性 = n生成成 CO2 】
①表示乙醇转化率的曲线是 (填“a ”、“b ”或“c ”)。
②573K 时,反应Ⅱ的压强平衡常数 I Kₚ= (已知:分压=总压
×该组分物质的量分数,计算结果保留整数。 )
江苏省南通六市2024年高考化学一模考前押题化学卷(PDF版含解析): 这是一份江苏省南通六市2024年高考化学一模考前押题化学卷(PDF版含解析),文件包含江苏省南通六市2024年高考化学一模考前押题化学卷答案pdf、南通六市一模考前押题卷化学pdf等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
2023年高考考前押题密卷化学试题(天津卷)(Word版附解析): 这是一份2023年高考考前押题密卷化学试题(天津卷)(Word版附解析),共18页。
山东省中学联盟2023届高三高考考前热身押题+化学+Word版含解析: 这是一份山东省中学联盟2023届高三高考考前热身押题+化学+Word版含解析,共25页。试卷主要包含了6%等内容,欢迎下载使用。












