






- 第07讲 氧化还原反应(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考) 课件 0 次下载
- 第08讲 钠及其重要化合物(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考) 课件 0 次下载
- 第08讲 钠及其重要化合物(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考) 课件 0 次下载
- 第09讲 镁、铝及其重要化合物(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考) 课件 0 次下载
- 第09讲 镁、铝及其重要化合物(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考) 课件 0 次下载
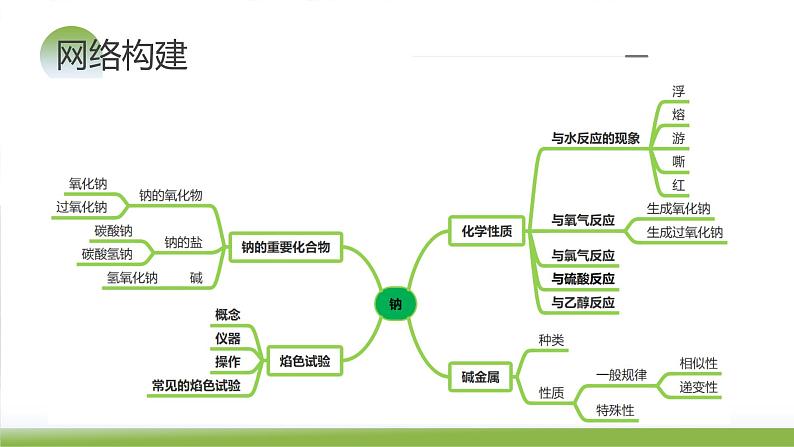
第08讲 钠及其重要化合物(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考)
展开知识梳理 题型归纳
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
银白色,有金属光泽的固体,质地柔软,熔点低(小于100 ℃),密度比水的小,但比煤油的大,即ρ(H2O)>ρ(Na)>ρ(煤油)。
知识点1 钠的性质及应用
2.从钠原子的原子结构认识钠的化学性质——还原性
(1)与非金属单质(如O2、Cl2)的反应
②与滴加酚酞的水反应的现象及解释
(3)与盐酸、硫酸反应
离子方程式:2Na+2H+=2Na++H2↑。
(制取金属钾,因为钾的沸点比钠的沸点低,使钾成为蒸汽而逸出)
①投入NaCl溶液中,只有H2放出:2Na+2H2O=2NaOH+H2↑
若投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变)
②投入NH4Cl溶液中有H2和NH3逸出:2Na+2NH4Cl=2NaCl+H2↑+2NH3↑
③投入CuSO4溶液中有H2逸出和蓝色沉淀生成
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
总反应:2Na+CuSO4+2H2O=Na2SO4+H2↑+Cu(OH)2↓。
(5)与某些有机物(含羟基)反应
2Na+2CH3CH2OH―→2CH3CH2ONa+H2↑
2Na+2CH3COOH―→2CH3COONa+H2↑
【易错提醒】Na先与酸反应,再与水反应即先酸后水;与盐溶液反应时先与水反应,生成的碱与盐可能发生复分解反应。
(2)保存:密封保存,通常保存在石蜡油或煤油中,钠易与空气中的O2、H2O反应,且钠的密度比煤油的密度大,不与煤油反应,故通常将少量钠保存在煤油中,大量钠保存在石蜡中。
(1)钠钾合金(液态)可用于原子反应堆的导热剂。
(2)用作电光源,制作高压钠灯。
(3)冶炼某些金属:钠能与钛、锆、铌、钽等氯化物(熔融)发生置换反应,金属钠具有强还原性,熔融状态下可以用于制取金属。
2.取用金属钠时,用镊子夹取金属钠,用滤纸擦干表面的煤油,放在洁净干燥的玻璃片上用小刀切割,不能用手直接接触金属钠,并且将剩余的钠放回原试剂瓶中保存。
1.钠燃烧时不能用水灭火,应用沙土盖灭。
3.钠与溶液反应的共同现象
①浮:钠浮在液面上;②熔:钠熔化成光亮的小球;③游:在液面上不停地游动直至反应完全;④响:反应中不停地发出“嘶嘶嘶”的响声。若溶液中H+浓度较大,与水相比反应更加剧烈,最后钠可能在液面上燃烧。
5.考虑钠与酸、碱、盐的水溶液反应时,要注意Na与水反应的同时,生成的NaOH还可能继续与部分溶质反应。
4.钠性质的巧记口诀:银白轻低软,传导热和电;遇氧产物变,遇氯生白烟;遇水记五点,浮熔游响红;遇酸酸优先,遇盐水在前。
6.对钠与酸反应的计算问题,勿忽略Na若过量还可与H2O反应。
知识点2 钠的氧化物与氢氧化物
1.氧化钠与过氧化钠的比较
(1)强氧化性的五个表现
①遇KMnO4等强氧化剂时,表现出还原性,氧化产物为O2。
②遇H2O、H+则发生自身的氧化还原反应。
③遇还原性氧化物(即低价非金属氧化物),表现强氧化性,一般不生成氧气,而生成高价钠盐,如Na2O2+SO2=Na2SO4。
④遇最高价金属氧化物(酸酐)发生自身的氧化还原反应,有氧气生成,如2Mn2O7+2Na2O2=4NaMnO4+O2。
⑤无论是过氧化钠还是其他过氧化物,具有强氧化性、漂白性等特殊性质的根本原因是这些物质中都含有过氧键。
(2)理解Na2O2强氧化性的两个角度
①从结构角度:Na2O2的结构中含有过氧键(—O—O—),含有过氧键结构的物质有较强的氧化性,以此类推,如H2O2、H2SO5(过硫酸,相当于H2O2中的一个H被—SO3H取代)、Na2S2O8(过二硫酸钠)中都有过氧键结构,都是很强的氧化剂。
②从化合价的角度:Na2O2中的氧元素为-1价,有很强的氧化性,能氧化一些常见的还原剂,如SO2、Fe2+、SO32-、HSO3-、H2S、S2-、I-。同时-1价的O也有还原性,如遇到强氧化剂KMnO4也可以被氧化成O2。
(1)过氧化钠是常用的工业漂白剂,但是不能用于食品的漂白;
(2)Na2O2既有氧化性又有还原性,但主要表现为氧化性。当遇到KMnO4等强氧化剂时,可表现出还原性,氧化产物为O2;
(3)Na2O2遇到CO2、H2O、H+发生自身氧化还原反应。Na2O2既是氧化剂又是还原剂,且1 ml Na2O2转移的电子是1 ml而不是2 ml。
(4)Na2O、Na2O2中阴、阳离子个数比均为1∶2。
(5)Na2O2与H2O、CO2的反应规律
电子转移关系:当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2~O2~2e-,n(e-)=n(Na2O2)=2n(O2)
气体体积变化关系:若CO2、水蒸气(或两混合气体)通过足量Na2O2,气体体积的减少量是原气体体积的1/2,等于生成氧气的量,ΔV=V(O2)=(1/2)V
固体质量变化关系:CO2、水蒸气分别与足量Na2O2反应时,固体相当于吸收了CO2中的“CO”、水蒸气中的“H2”,所以固体增加的质量Δm(CO2)=28 g·ml-1×n(CO2)、Δm(H2O)=2 g·ml-1×n(H2O)
(1)物理性质:NaOH的俗名为烧碱、火碱或苛性钠;它是一种白色固体,易溶于水并放出大量的热,有吸水性;吸收空气中的水分而潮解;有很强的腐蚀性。
①具有碱的通性:能使酸碱指示剂变色;与强酸反应;与酸性氧化物、两性氧化物反应;与盐反应(强碱制弱碱)。
与金属铝反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
与非金属单质反应:Cl2+2OH-=Cl-+ClO-+H2O
①实验室(土法)制烧碱:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)NaOH在有机反应中的应用
提供碱性环境,如卤代烃的水解和消去反应、酯类的水解和油脂的皂化等。
考向1 考查钠的性质及其应用
【变式训练】(2022吉林长春实验中学模拟)把一小块金属钠放入下列溶液中,说法正确的是( )A.放入饱和NaOH溶液中:有氢气放出,恢复至原温度后溶液的pH增大B.放入稀CuSO4溶液中:有氢气放出,有紫红色铜析出C.放入MgCl2溶液中:有氢气放出,有白色沉淀生成D.放入NH4NO3溶液中:有无色无味气体放出
【思维建模】金属钠与可溶性盐溶液反应的思维模板
考向2 考查钠的氧化物及其应用
例2.(2023·上海·一模)Na2O和Na2O2具有相似的性质是 A.颜色B.水溶液的酸碱性C.氧化性D.漂白性
【变式训练1】(2023·河南开封·统考二模)图示为证明过氧化钠可在呼吸面具和潜水艇中做供氧剂的实验装置图,其中a装置是实验室制备二氧化碳的装置,c中盛放的是过氧化钠。
A.a中可以用Na2CO3和稀盐酸来制备CO2B.b装置中是饱和Na2CO3溶液,作用是除去a中产生的HClC.c中只发生2Na2O2 +2CO2=2Na2CO3+O2D.f中收集的气体是纯净的O2
【变式训练2】(2022·长沙模拟)1 ml过氧化钠与2 ml碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )A.Na2CO3 B.Na2O2 Na2CO3C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
【变式训练3】(2022·日照模拟)某化学兴趣小组在学校科技节活动中表演了“滴水生火”“吹气生火”的小魔术。如图所示,在蒸发皿上放一小团脱脂棉,在里面裹入一种淡黄色的化合物,对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉会燃烧起来。下列说法不正确的是( )A.淡黄色化合物为Na2O2B.“滴水生火”的小魔术本质上是发生了2Na2O2+2H2O=4NaOH+O2↑C.“吹气生火”的小魔术中的火不可以用泡沫灭火器扑灭D.在活动中为了更清楚地观察现象,需要近距离俯视蒸发皿
知识点1 Na2CO3、NaHCO3的性质、用途及制法
1、Na2CO3、NaHCO3的物理性质
2、Na2CO3、NaHCO3的化学性质
①Na2CO3性质稳定,受热难分解。
①Na2CO3:CO32-+2H+=H2O+CO2↑。
②NaHCO3:HCO3-+H+=H2O+CO2↑。
(3)与碱(NaOH溶液)反应
①Na2CO3与NaOH溶液不反应。
②NaHCO3:NaHCO3+NaOH=Na2CO3+H2O。
①Na2CO3→NaHCO3:向Na2CO3溶液中通入CO2,化学方程式为Na2CO3+H2O+CO2=2NaHCO3。
②NaHCO3→Na2CO3:NaHCO3固体加热分解转化成Na2CO3。
3、Na2CO3、NaHCO3的主要用途
(1)碳酸钠:用于造纸、制造玻璃、制皂、洗涤等。
(2)碳酸氢钠:用于制发酵粉、医药、灭火剂等。
4、Na2CO3的制备—侯氏制碱法
食盐、氨气、二氧化碳其中二氧化碳为合成氨厂用水煤气制取氢气时的废气
产生NaHCO3反应:NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl。
④循环使用的物质:CO2、饱和食盐水。
知识点2 Na2CO3、NaHCO3性质的应用
1、Na2CO3、NaHCO3的鉴别
①固体的鉴别用加热法:产生使澄清石灰水变浑浊的气体的是NaHCO3固体。
②溶液的鉴别可用沉淀法、气体法和测pH法。
a.沉淀法:加入BaCl2溶液或CaCl2溶液,产生沉淀的是Na2CO3溶液。
b.气体法:滴入稀盐酸,立即产生气泡的是NaHCO3溶液。
c.测pH法:用pH试纸测相同浓度的稀溶液,pH大的是Na2CO3溶液。
2、Na2CO3、NaHCO3的除杂
①NaHCO3与碱溶液反应的实质是HCO3-与OH-反应生成CO32-,CO32-有可能发生续反应,如NaHCO3与Ca(OH)2溶液反应可以生成白色沉淀CaCO3;
②不能用澄清石灰水来鉴别Na2CO3与NaHCO3:Ca(OH)2溶液与二者反应均生成白色沉淀CaCO3,无法区别;
③用盐酸鉴别Na2CO3溶液和NaHCO3溶液时,要求两溶液浓度相差不大,且加入的盐酸等浓度且不宜过大;
④Na2CO3、NaHCO3与酸、碱、盐的反应均为复分解反应,因而反应能否进行应从复分解反应的条件来判断。
知识点3 Na2CO3、NaHCO3与盐酸反应的基本图象
知识点4 金属钠露置在空气中发生的一系列变化
写出上述各步反应的化学方程式:
①4Na+O2=2Na2O;
②Na2O+H2O=2NaOH。
③2NaOH+CO2+9H2O=Na2CO3·10H2O;
④Na2CO3·10H2O=Na2CO3+10H2O。
考向1 考查碳酸钠和碳酸氢钠性质与检验
例1.(2023·天津南开·统考一模)下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是A.取ag混合物充分加热,质量减少bgB.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体C.取ag混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干、得到bg固体D.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,质量增加bg
(1)Na2CO3、NaHCO3的鉴别与除杂
(2)Na2CO3和NaHCO3混合物的除杂方法
考向2 考查侯氏制碱法
知识点1 碱金属的一般性与特殊性
①碱金属的密度一般随核电荷数的增大而增大,但钾的密度比钠的小。
②碱金属一般都保存在煤油中,但由于锂的密度小于煤油的密度而将锂保存在石蜡中。
③碱金属跟氢气反应生成的碱金属氢化物都是离子化合物,其中氢以H-形式存在,显-1价,碱金属氢化物是强还原剂。
④试剂瓶中的药品取出后,一般不能放回原瓶,但Na、K等需放回原瓶。
⑤锂与O2反应与钠不同,只生成Li2O,与反应条件、氧气的量等无关。
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验,属于物理变化,是元素的性质。
钠元素:黄色;钾元素:紫色(透过蓝色钴玻璃观察);铜元素绿色;钡元素:黄绿色;钙元素:砖红色。
(1)焰色试验是物理变化,是金属元素的性质,既可以是单质,也可以是化合物,如不论灼烧Na2CO3、NaCl、Na2SO4还是钠的单质,均发出黄色火焰。
(2)用稀盐酸清洗的原因:生成金属氯化物,而金属氯化物在高温时可挥发。
(3)焰色反应中所用的火焰应是无色或浅色的。
(4)灼烧铂丝时应一直烧至火焰恢复到原来的颜色。
(5)可用洁净无锈的铁丝代替铂丝,不能用铜丝代替。
考向1 考查碱金属的相似性、递变性
例1.铷(Rb)原子钟”被誉为卫星的“心脏”。下列说法正确的是A.金属铷的熔点高于钾B.3785Rb的中子数为48C.3785Rb和3787Rb化学性质不同D.铷元素属于ⅠB族
【变式训练】已知有钠、钾及钠钾合金,对于它们三者熔点高低比较正确的是A.钠钾合金>钠>钾B.钠>钾>钠钾合金C.钠>钠钾合金>钾D.钾>钠钾合金>钠
【名师点拨】熟悉碱金属的常见设问点,应对相应问题
(1)碱金属单质与水(或酸)反应的现象;
(2)碱金属单质的保存(注意碱金属的密度);
(3)碱金属单质与氧气反应产物的判断;
(4)碱金属对应的氢氧化物碱性强弱的比较;
(5)碱金属的碳酸盐性质的比较;
(6)与最新的科学技术相关的碱金属的应用。
例2.(2023·广东汕头·统考二模)2023年1月23日,汕头迎春大型焰火晚会点亮了汕头湾,为汕头发展注入强心剂。下列焰火颜色与钾元素相关的是A.黄色B.紫色C.绿色D.洋红色
【易错提醒】焰色试验是物理变化。
1.(2023·浙江·高考真题)下列关于元素及其化合物的性质说法不正确的是A.Na和乙醇反应可生成H2B.工业上煅烧黄铁矿(FeS2)生产SO2C.工业上用氨的催化氧化制备NOD.常温下铁与浓硝酸反应可制备NO2
2.(2023·浙江·高考真题)下列物质中属于耐高温酸性氧化物的是A.CO2B.SiO2C.MgOD.Na2O
5.(2021·海南·统考高考真题)一次性鉴别等浓度的KNO3、NH4Cl、Na2CO3三种溶液,下列方法不可行的是A.测定pH B.焰色试验C.滴加ACl3溶液D.滴加饱和Ca(OH)2溶液,微热
第10讲 铁及其重要化合物(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考): 这是一份第10讲 铁及其重要化合物(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第10讲铁及其重要化合物练习原卷版docx、第10讲铁及其重要化合物练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
第10讲 铁及其重要化合物(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考): 这是一份第10讲 铁及其重要化合物(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
第10讲 铁及其重要化合物(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考): 这是一份第10讲 铁及其重要化合物(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第10讲铁及其重要化合物讲义原卷版docx、第10讲铁及其重要化合物讲义解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。












