

重庆市部分中学2024届高三上学期11月一轮复习联考(二)化学试题含答案
展开注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
考试时间为75分钟,满分100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 S-32 Fe-56 Bi-209
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活、生产、科技等密切相关。下列说法不正确的是( )
A.“酒中之水,皆可蒸烧”是因为酒精的沸点比水的沸点低
B.用作光导纤维,是因为其具有强导电性
C.维生素C用作食品中的防腐剂,是因为维生素C有较强的还原性
D.古壁画红色颜料用铁红,是由于其在空气中性质稳定
2.下列类比或推理合理的是( )
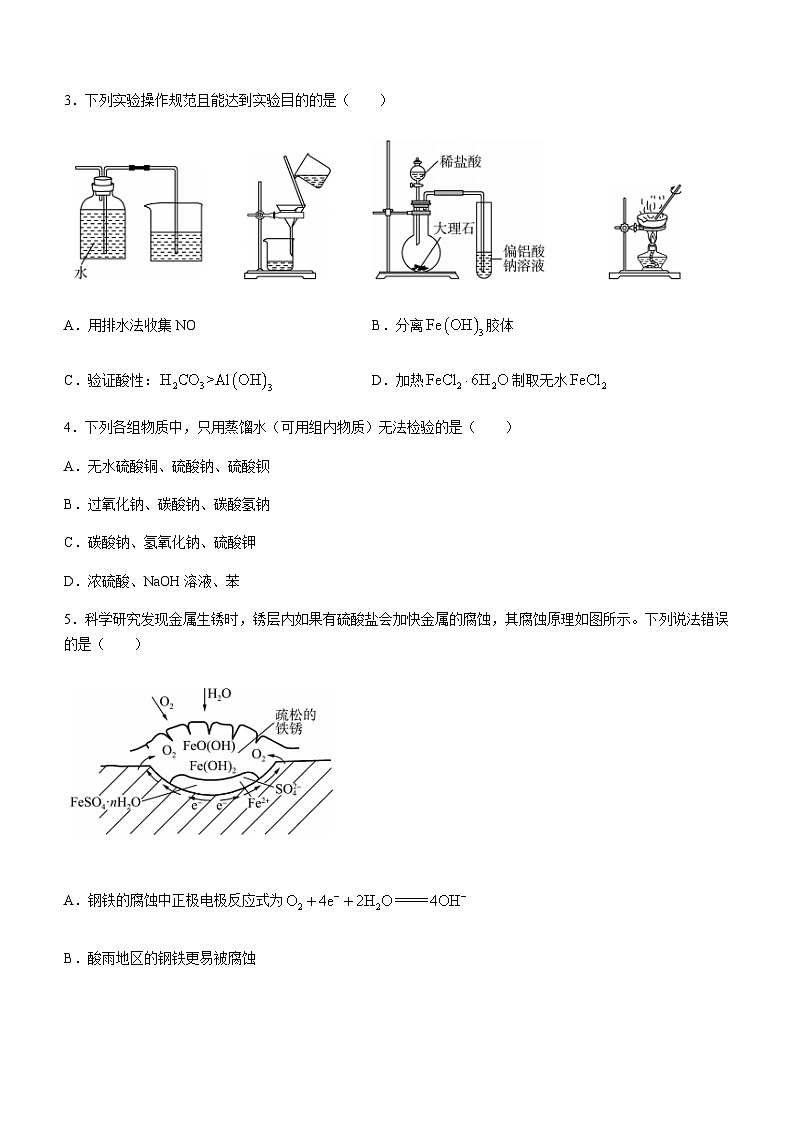
3.下列实验操作规范且能达到实验目的的是( )
A.用排水法收集NOB.分离胶体
C.验证酸性:D.加热制取无水
4.下列各组物质中,只用蒸馏水(可用组内物质)无法检验的是( )
A.无水硫酸铜、硫酸钠、硫酸钡
B.过氧化钠、碳酸钠、碳酸氢钠
C.碳酸钠、氢氧化钠、硫酸钾
D.浓硫酸、NaOH溶液、苯
5.科学研究发现金属生锈时,锈层内如果有硫酸盐会加快金属的腐蚀,其腐蚀原理如图所示。下列说法错误的是( )
A.钢铁的腐蚀中正极电极反应式为
B.酸雨地区的钢铁更易被腐蚀
C.生成反应的化学方程式为
D.硫酸盐加速电子传递,有一定的催化剂作用
6.下列离子方程式书写正确的是( )
A.向溶液中通入过量:
B.CuO溶于溶液:
C.向溶液中通入:
D.Fe与稀硝酸反应,当时:
7.设为阿伏加德罗常数的值,下列说法错误的是( )
A.常温、常压下,1.4 g环丁烷与环丙烷混合气体中含有的氢原子数为0.2
B.标准状况下,22.4 L氯气、氢气和一氧化碳的混合气体中含有2个原子
C.100 g 32%的甲醇溶液中含有的氢原子数为4
D.两份质量均为5.6 g的铁粉分别与足量硫粉、碘单质充分反应,转移的电子数均为0.2
8.如图1、图2分别表示1 ml 和1 ml 分解时的能量变化情况(单位:kJ)。下列说法错误的是( )
图1 1 ml 分解时的能量变化
图2 1 ml 分解时的能量变化
A.CO的燃烧热
B.
C.O==O的键能为
D.无法求得的反应热
9.根据实验操作及现象,下列结论中正确的是( )
10.某化学兴趣小组通过查阅文献,设计了从阳极泥(成分为、、Au、Pt)中回收贵重金属的工艺,其流程如图所示。已知:“酸溶”时,Pt、Au分别转化为和。下列判断正确的是( )
A.“焙烧”时,转化为CuO的化学方程式为
B.“转化”后所得溶液经过在空气中加热蒸发结晶可得到
C.“酸溶”时,铂溶解的离子方程式为
D.结合工艺流程可知盐酸的氧化性强于硝酸
11.计算机模拟单个处理废气在催化剂表面发生反应的反应历程如下。下列说法错误的是( )
A.反应Ⅰ为反应决速步骤
B.反应的热化学方程式为
C.反应Ⅰ的离子方程式为
D.反应中消耗1 ml 可处理含92 g 的废气
12.在直流电源作用下,双极膜中间层中的解离为和。某技术人员利用双极膜(膜c、膜d)电解技术从含葡萄糖酸钠(用GCOONa表示)的溶液中提取NaOH和葡萄糖酸(GCOOH),工作原理如图所示。下列说法错误的是( )
A.M为阴极
B.③室和④室所得产物相同
C.膜a为阳离子交换膜,膜b为阴离子交换膜
D.N极电极反应式为
13.铝硫二次电池是一种具有高能量密度、廉价原材料、有前途的替代储能装置,一种铝硫电池如图所示,M极为表面吸附了硫的活性电极,电解质为,(、)。下列说法错误的是( )
A.放电时铝电极的电极反应式为
B.电池放电时的反应原理为
C.离子交换膜为阳离子交换膜
D.充电时,M极为阳极,被氧化
14.化石燃料燃烧会产生大气污染物、等,科学家实验探究用硫酸铈循环法吸收,其转化原理如图所示。下列说法正确的是( )
A.检验可以选用盐酸酸化的溶液
B.反应①的离子方程式为
C.反应②中氧化剂与氧化产物的物质的量之比为1:2
D.理论上每吸收标准状况下224 mL ,一定消耗0.32 g
二、非选择题:本题共4小题,共58分。
15.(14分)某兴趣小组设计用铜粉将NO还原为。
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收,不能吸收NO。
(1)装置F的名称为____________,装置的连接顺序为a→________________________。
(2)装置A中发生反应的离子方程式为__________________________________________。
装置C中发生反应的离子方程式为_______________________________________________。
(3)装置D的作用为__________________________________________________________。
(4)E装置中可观察到的现象为____________________________________。
(5)反应一段时间后拆下E装置,连接为如下图装置,一段时间后无水硫酸铜变蓝色,写出通入氨气后E装置中发生反应的化学方程式:________________________,该反应可证明氨气具有____________性。
16.(14分)(1)已知:①
②
则 ______。
(2)已知:①
②
则表示氨气燃烧热的热化学方程式为___________________________________,该反应可设计为碱性条件下的燃料电池,负极电极反应式为__________________。
(3)已知几种化学键的键能和热化学方程式如下:
,a=________。
(4)4种不饱和烃分别与氢气发生加成反应生成1 ml环己烷()的能量变化如图所示。根据图示判断4种有机反应物中最稳定的是________;反应的________。
(5)用电解法处理有机废水是目前工业上一种常用手段,电解过程中阳极催化剂表面水被电解产生氧化性强的羟基自由基,羟基自由基再进一步把有机物氧化为无毒物质。下图为电解二氯乙烷废水的装置图,写出电解池阴极的电极反应式:______________________;羟基自由基与二氯乙烷反应的化学方程式为______________________。
17.(15分)铋(Bi)的化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为,含FeS、CuO、等杂质)制备,的工艺流程如下:
已知:
ⅰ.难溶于冷水;
ⅱ.“氧化浸取”时,铋元素转化为,硫元素转化为硫单质;
ⅲ.。
回答下列问题。
(1)“氧化浸取”步骤中温度升高可以增大速率,但高于50℃时浸取速率会下降,其可能的原因是_____________________。滤渣1经过除硫后的另一种成分在工业上用途广泛,写出一种用途:_____________________。
(2)“氧化浸取”时,FeS发生反应的离子方程式为_____________________。
(3)“除铁”步骤中调节pH最好选用的试剂为______(填字母)。
A.稀硫酸B.碳酸钠C.三氧化二铋D.氨水
(4)“转化”时,生成,的反应中氧化剂与氧化产物的物质的量之比为______。
(5)产品纯度的测定。取产品w g,加入足量稀硫酸和a 稀溶液10 mL使其完全反应(Bi被还原为+3价),再用b 标准溶液滴定溶液中剩余的(Cr被还原为+3价),恰好消耗10 mL 标准溶液。该产品的纯度为______(用含w、a、b的代数式表示)。
(6)组装为下图装置后发现导线中电流方向为石墨1→石墨2,则该装置的负极为______,石墨2电极上的电极反应式为________________________。
18.(15分)某小组在验证反应“”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的0.05 硝酸银溶液中(忽略的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有可以选用的试剂为____________(填化学式)溶液。产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生
假设b:空气中存在,被氧化为,写出反应的离子方程式:____________。
假设c:酸性溶液中的具有氧化性,可产生。
(2)某同学证明上面假设c不成立,向硝酸酸化的____________硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无。
(3)取过滤后的黑色固体,洗涤后,____________________________________________________________(填操作和现象),证明黑色固体中含有Ag。
(4)某同学利用原电池证明可以将氧化为,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除)。甲溶液中的溶质为____________。写出石墨电极上发生的电极反应式:________________________。电流表指针不再偏转后,向左侧烧杯中加入固体,发现电流表指针反向偏转,此时石墨电极为______(填“正极”或“负极”),银电极的电极反应式为________________________。
重庆市部分中学2024届高三上学期11月一轮复习联考(二)
化学参考答案及评分意见
1.B【解析】制取高度酒的方法是蒸馏,蒸馏是利用沸点不同,酒精的沸点比水的低,A正确;不导电,用作光导纤维是传递的光信号,B错误;维生素C用作食品中的防腐剂,是因为维生素C有较强的还原性,C正确;在空气中性质稳定,常用作颜料和油漆,D正确。
2.D【解析】碘单质遇淀粉变蓝色是特性,不能推断溴单质遇淀粉也变蓝色,A错误;在空气中易变质,是因为+4价硫元素很容易被氧化,而碳酸钠在空气中非常稳定,B错误;HF是弱酸,C错误;同族元素的氢化物由上往下还原性增强,D正确。
3.A【解析】NO在水中的溶解度较小,可用排水法收集,A正确;胶体不是沉淀,不能用过滤的方法提纯,B错误;用图中所给装置制取的中有HCl杂质,溶液中产生沉淀,不能证明是由产生的沉淀,也可能是由HCl产生的沉淀,C错误;加热固体不能用蒸发皿,应该用坩埚,另外加热制取无水应该在HCl的气氛下加热,D错误。
4.C【解析】A项,加入蒸馏水,呈蓝色的是无水硫酸铜,不溶于水的是硫酸钡,溶液呈无色的是硫酸钠,可以检验;B项,加入蒸馏水,与水反应产生无色无味气体,碳酸钠中滴加少量水会结成块状生成,中滴加少量水不会结成块状,可以检验;C项,加入蒸馏水,均得到无色溶液,不能检验;D项,浓硫酸是粘稠液体,并且溶于水放出大量热,NaOH溶液与水混合不分层,苯与水混合分层,可以检验。
5.C【解析】钢铁的腐蚀中正极电极反应式为,A正确;酸雨地区雨水中的电解质浓度大,会加快钢铁的腐蚀,B正确;生成反应的化学方程式为,C错误;结合题干信息,铁锈中的硫酸盐加速电子传递,有一定的催化剂作用,D正确。
6.D【解析】向溶液中通入过量生成的产物是沉淀和,A错误;应拆写成,B错误;向溶液中通入,酸性条件下将氧化为,中氮元素被还原为NO,C错误;当时,发生的反应为,当时,可假设是3 ml ,消耗0.75 ml Fe,生成0.75ml ,再加入0.25 ml Fe,则生成0.75 ml ,剩余0.25 ml ,即溶液中,由此可得离子方程式为,D正确。
7.C【解析】环丁烷与环丙烷的最简式均为,1.4 g 的物质的量为0.1 ml,含有的氢原子数为0.2,A正确;标准状况下,22.4 L气体物质的量是1 ml,、和CO均为双原子分子,则混合气体中含有2个原子,B正确;100 g质量分数为32%的甲醇溶液中含有甲醇的质量是32 g,物质的量是1 ml,1 ml 所含的氢原子数为4,但100 g溶液中还有68 g ,水分子中也含有氢原子,所以100 g溶液中含有的氢原子数大于4,C错误;铁粉与硫、碘反应均生成+2价铁元素,所以5.6 g的铁粉分别与足量硫粉、碘单质充分反应,转移的电子数均为0.2,D正确。
8.D【解析】由图2可知 ,A正确;
由图1可得① ,
由图2可得② ,
根据盖斯定律①+②得, ,B正确;
由图1或图2均可得出O==O的键能为,C正确;
,D错误。
9.C【解析】铁的还原性比铜的强,而常温下,铁片与浓硝酸会发生钝化,导致现象不明显,A错误;向碳酸钙的悬浊液中通入无色气体,悬浊液逐渐变澄清,气体不一定是HCl,也可能是等,B错误;铁比银活泼,在组成的原电池中铁作负极,铁失电子产生的与反应生成蓝色沉淀,C正确;溴水、碘水由于浓度不同,溶液均有可能呈现黄色,所以向某无色溶液中通入,溶液变黄色,不能证明原溶液中有,D错误。
10.A【解析】阳极泥“焙烧”时,硫化亚铜与氧气高温条件下反应生成氧化铜、二氧化硫,反应的化学方程式为,A正确;铵盐受热易分解,并且易被氧化,所以不能用直接加热蒸发结晶的方法得到,B错误;滤渣酸溶时,铂与氯气、盐酸反应转化为,反应的离子方程式为,C错误;用盐酸“酸溶”铂和金的过程中作氧化剂,并且+4价铂元素和+3价金元素分别与形成配合物,不能得出盐酸的氧化性强于硝酸的结论,D错误。
11.B【解析】反应Ⅰ的活化能大于反应Ⅱ的活化能,所以反应Ⅰ为决速步骤,A正确;图中给出的是单个反应的能量变化,而热化学方程式表示的是1 ml 参与反应的能量变化,B错误;结合图像可知反应Ⅰ的离子方程式为,C正确;与发生的总反应的离子方程式为,所以消耗1 ml 可处理含2 ml 的废气,其质量是92 g,D正确。
12.B【解析】若要产生葡萄糖酸,则②室中的移向③室,双极膜中的膜c产生的进入③室,最终在③室中生成GCOOH,所以膜b是阴离子交换膜;②室中的进入①室,同时电极M处产生,①室中产生NaOH,所以膜a为阳离子交换膜,M为阴极,A、C正确;⑤室中的移向⑥室,N电极上产生,电极反应式为,D正确;⑤室中的进入④室,双极膜中的膜d产生的进入④室,④室中的产物为NaOH,B错误。
13.D【解析】放电时,负极反应为,正极反应为,总反应为,A、B正确;充电时,阴极反应为,阳极反应为;离子交换膜两侧阳离子相同,因此选用阳离子交换膜,C正确;充电时,M极为阳极,在阴极被还原,D错误。
14.B【解析】检验溶液中的需要先加盐酸,排除、、等离子的干扰,再加入溶液,A错误;图示中在酸性条件下氧化,结合得失电子守恒和电荷守恒、质量守恒可以写出反应的离子方程式为,B正确;反应②中氧化剂是,氧化产物是,根据得失电子守恒可判断二者的物质的量之比为1:4,C错误;根据总反应,,,D错误。
15.(14分)
(1)球形干燥管(1分) f→e→j→i→h(或g)→g(或h)→b→c→d(2分)
(2)(2分)(2分)
(3)吸收挥发出来的硝酸蒸气和产生的(2分)
(4)红色粉末变为黑色(1分)
(5) 还原(2分)
【解析】首先利用铜与稀硝酸反应生成NO,由于硝酸具有挥发性,所以制得的NO中会混有硝酸蒸气,故先将产生的气体通过装置D除去可能产生的和挥发出的硝酸蒸气,再通过装置F干燥,得到纯净干燥的NO,然后进入装置E中与铜粉反应,最后处理多余的NO。由于NaOH溶液不与NO反应,而浓硝酸可将NO氧化为NO2,所以先通过装置B氧化NO,再通过装置C吸收。
(1)装置F的名称为球形干燥管,上述装置的连接顺序为a→f→e→j→i→h(或g)→g(或h)→b→c→d。
(2)装置A中稀硝酸与铜粉反应的离子方程式为。C中发生反应的离子方程式为。
(3)装置D的作用为吸收挥发出来的硝酸蒸气和产生的。
(4)反应一段时间后装置E的铜粉变为CuO,故观察到的现象为红色粉末变为黑色。
(5)根据题意可知,在加热条件下CuO与氨气反应生成,所以反应的化学方程式为,反应中氨气表现还原性。
16.(14分)
(1)+79.2 (1分)
(2) (2分)
(2分)
(3)946(2分)
(4)(1分) (2分)
(5)(2分)(2分)
【解析】(1)②-①×2可得,所以。
(2)可得出,所以。碱性条件下在负极上失电子,电极反应式为。
(3)反应物的键能之和-生成物的键能之和=4×391 +193 +2×243 -a -4×432 =-431 ,所以a=946。
(4)能量越低越稳定,所以最稳定的是;根据图像可以看出。
(5)电解时阴极产生和,电极反应式为;阳极产生,1个在反应中得1个生成,所以与二氯乙烷反应的化学方程式为。
17.(15分)
(1)高于50℃时盐酸挥发,分解(2分) 作光导纤维、石英坩埚等(1分)
(2)(2分)
(3)C(2分)
(4)1:1(2分)
(5)(或)(2分)
(6)石墨2(2分) (2分)
【解析】(1)辉铋矿主要成分为,含FeS、CuO、等杂质,向辉铋矿中加入和盐酸进行“氧化浸取”,发生的反应有:、、,得到含S和的滤渣1。高于50℃时浸取速率下降,其可能的原因是盐酸挥发,分解。
(2)“氧化浸取”时,FeS与、发生反应:。
(3)该工艺主要是提取Bi并制取,从不引入杂质的角度考虑加入最好。
(4)除铜后得到氢氧化铋沉淀,加入盐酸溶解滤渣,再加入NaOH、NaClO,发生反应,得到产品。氧化剂和氧化产物的物质的量之比为1:1。
(5)中加入稀硫酸和,溶液,Bi被还原为+3价,根据得失电子守恒可得关系式,剩余的与反应,二者的关系式为,所以消耗的的物质的量为0.06b ml,消耗的的物质的量为ml,的物质的量为ml,该产品的纯度为。
(6)原电池装置中电流由正极流向负极,所以石墨2是负极,电极反应式为。
18.(15分)
(1)KSCN(答案合理即可)(1分) (2分)
(2)0.05 (2分)
(3)加入足量稀盐酸,充分反应,溶液中仍有黑色固体剩余(答案合理即可)(2分)
(4)(2分,答案合理即可) (2分) 正极(2分) (2分)
【解析】(1)溶液中的常用KSCN溶液检验,溶液中被氧化为的离子方程式为。
(2)对比实验应做到只有1个变量,所以选用0.05 的硝酸钠溶液。
(3)剩余固体中可能有铁粉,所以应用稀盐酸或稀硫酸将其溶解后,若仍有固体剩余,则证明黑色固体中含有Ag。
(4)证明可以将氧化为,则原电池中负极发生的电极反应一定是,正极发生的电极反应一定是;电流表指针反向偏转后,石墨电极为正极,发生的电极反应一定是,Ag电极是负极,发生的电极反应一定是。
选项
已知
方法
结论
A
碘遇淀粉显蓝色
类比
溴单质遇淀粉变蓝色
B
在空气中易变质
类比
在空气中也易变质
C
HCl是强酸
推理
HF是强酸
D
有还原性
推理
有强还原性
选项
实验操作及现象
结论
A
常温下将铁片和铜片分别插入浓硝酸中,前者无明显现象,后者产生气体
铜的还原性比铁强
B
向碳酸钙的悬浊液中通入无色气体,悬浊液逐渐变澄清
该气体是HCl
C
将银和溶液与铁和、溶液用盐桥连接组成原电池,连通后铁电极附近溶液产生蓝色沉淀
形成原电池,铁作负极
D
向某无色溶液中通入溶液变黄色
原溶液中有
化学键
H—N
N—N
Cl—Cl
N≡N
H—Cl
键能/()
391
193
243
a
432
重庆市部分学校2023-2024学年高三上学期11月一轮复习联考(二)化学试题Word版含答案: 这是一份重庆市部分学校2023-2024学年高三上学期11月一轮复习联考(二)化学试题Word版含答案,文件包含重庆市部分学校2023-2024学年高三上学期11月一轮复习联考二化学试卷重庆卷docx、重庆市部分学校2023-2024学年高三上学期11月一轮复习联考二化学答案重庆卷pdf等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
山东省部分学校2023-2024学年高三上学期一轮复习联考(一)化学试题(Word版含答案): 这是一份山东省部分学校2023-2024学年高三上学期一轮复习联考(一)化学试题(Word版含答案),共16页。试卷主要包含了96L气体生成时,转移电子数为,下列实验装置能达到实验目的的是等内容,欢迎下载使用。
河北省部分学校2023-2024学年高三上学期一轮复习联考(一)化学试题(Word版含答案): 这是一份河北省部分学校2023-2024学年高三上学期一轮复习联考(一)化学试题(Word版含答案),共17页。试卷主要包含了下列事实涉及的化学反应正确的是,下列实验装置能达到实验目的的是,向100 mL 0等内容,欢迎下载使用。












