

山东省临沂市第二中学2023-2024学年高二上学期12月月考化学试题含答案
展开1.答题前,考生先将自己的学校、班级、姓名、考生号、座号填写在相应位置。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cr-52
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生产、生活密切相关。下列说法错误的是( )
A.“三元催化器”可以提高汽车尾气转化的效率
B.霓虹灯发光是由于电子从基态跃迁到激发态而产生的
C.加热的方式可以降低“暂时硬水”的硬度
D.农业生产中,氯化铵和草木灰不能一起使用
2.下列描述原子结构的化学用语错误的是( )
A.氧原子核外能量最高的电子云的形状:
B.的价层电子轨道表达式:
C.钛原子结构示意图为:
D.基态铜原子的价层电子排布图:3d104s1
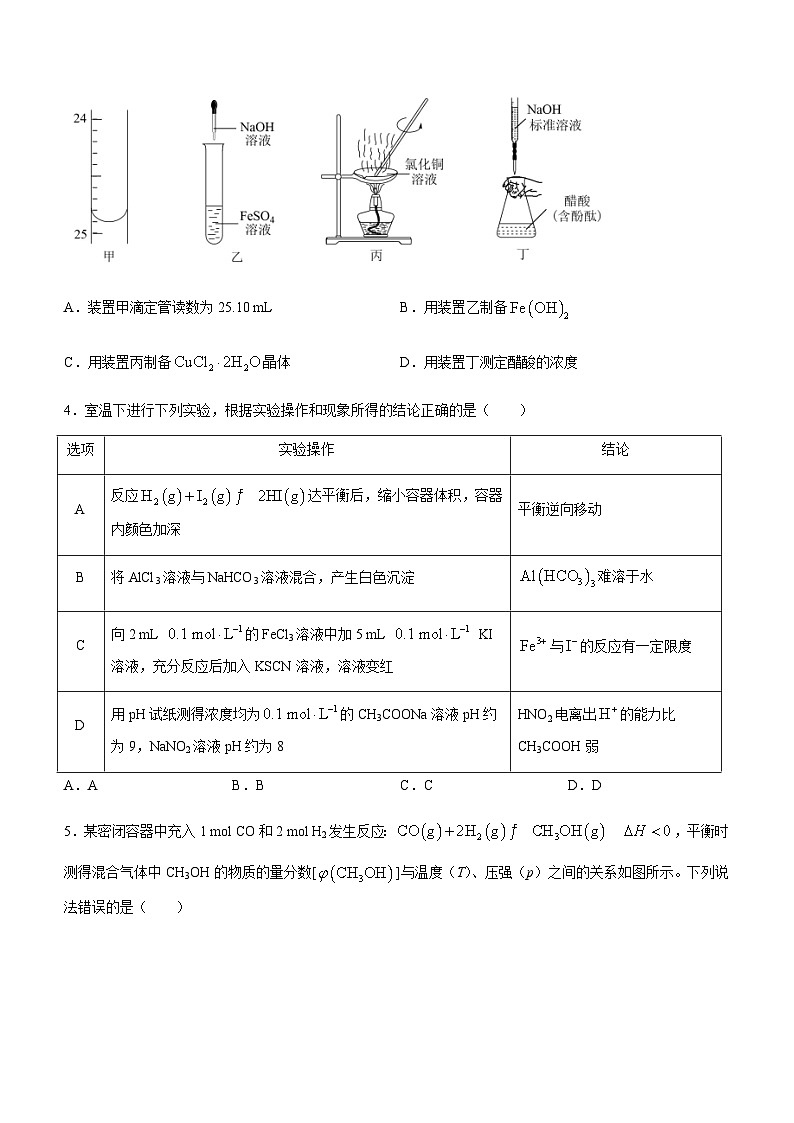
3.下列实验装置设计或操作正确的是( )
A.装置甲滴定管读数为25.10 mLB.用装置乙制备
C.用装置丙制备晶体D.用装置丁测定醋酸的浓度
4.室温下进行下列实验,根据实验操作和现象所得的结论正确的是( )
A.AB.BC.CD.D
5.某密闭容器中充入1 ml CO和2 ml H2发生反应: ,平衡时测得混合气体中CH3OH的物质的量分数[]与温度(T)、压强(p)之间的关系如图所示。下列说法错误的是( )
A.a点和b点对应的平衡常数
B.a点用气体分压(即气体总压强×该气体的体积分数)表示的压强平衡常数
C.若达平衡后,再充入1 ml CO和2 ml H2,CO的转化率减小
D.恒温恒容时,混合气体的平均摩尔质量不随时间变化而变化说明反应达到化学平衡状态
6.原子序数依次增大的X、Y、Z、W四种元素形成化合物,其中X、Y、Z为主族元素。X最外层电子数是内层电子数的两倍,Y的简单气态氢化物能使酚酞溶液变红,的3d轨道电子数为半满。下列说法正确的是( )
A.Z和W一定位于同周期
B.原子半径:Z>X>Y
C.四种元素基态原子中未成对电子数最多的是Y
D.该化合物中含有的化学键类型有:离子键、极性键和非极性键
7.工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5,能溶于水,微溶于乙醇。受潮易分解,露置空气中易氧化成硫酸钠)流程如下:
下列说法错误的是( )
A.反应Ⅰ后得到碳酸氢钠的操作为过滤
B.该流程中,CO2可以循环使用
C.Y溶液直接蒸干可以得到氯化铵晶体
D.焦亚硫酸钠晶体过滤后可以用无水乙醇洗剂,减少产品损失
8.如图是一种新型的光化学电源,当光照射N型半导体时,通入O2和H2S即产生稳定的电流并获得H2O2(H2AQ和AQ是两种有机物)。下列说法正确的是( )
A.甲池中的石墨电极是电池的负极
B.通过全氟磺酸膜从甲池进入乙池
C.甲池中石墨电极上发生的电极反应为
D.总反应为
9.下图是改变密闭容器中某一条件对化学平衡状态的影响曲线(图中T表示温度,n表示物质的量),下列判断错误的是( )
A.若,则正反应一定是吸热反应
B.A2的转化率大小为:b>a>c
C.若,b、d点的反应速率为
D.在和不变时,AB3的物质的量大小为:c>b>a
10.科学工作者结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示,其中吸附在Pt/SiO2催化剂表面上的物种用“”标注,Ts表示过渡态。
下列有关叙述正确的是( )
A.前三步总反应的
B.转化为和为吸热过程
C.催化剂通过参与化学反应,能降低反应的活化能,提高反应物的平衡转化率
D.历程中决速步为
二、选择题:本题共5小题,每题4分,共20分。每小题有一个或两个选项符合题意,全选对得4分,选对但不全的得2分,有选错的得0分。
11.下表中的操作、现象和解释或结论对应都正确的是( )
A.AB.BC.CD.D
12.某温度下用AgNO3溶液分别滴定相同浓度的KCl、K2CrO4溶液,所得的沉淀溶解平衡图像如图所示(不考虑的水解)。下列叙述正确的是( )
A.阴影区域中的点可以同时生成Ag2CrO4沉淀和AgCl沉淀
B.的数量级为
C.上述KCl、K2CrO4溶液等体积混合后滴加AgNO3溶液,先生成AgCl沉淀
D.的平衡常数为
13.热激活电池主要用于导弹、火箭以及应急电子仪器供电,是一种电解质受热熔融即可开始工作的电池。一种热激活电池的结构如图1所示。
已知:①放电后的两极产物分别为Li7Si3和LiMn2O4
②LiCl和KCl混合物的熔点与KCl物质的量分数的关系如图2所示。
下列说法错误的是( )
A.放电时,的移动方向:a极区→b极区
B.放电时,a极的电极反应:
C.调节混合物中KCl的物质的量分数可改变电池的启动温度
D.若放电前两电极质量相等,转移0.1 ml电子后两电极质量相差0.7 g
14.下列说法正确的是( )
A.常温下,将 NH4Cl溶液与 NaOH溶液等体积混合(pH=9.25):
B.pH相等的①NH4Cl ② ③NH4HSO4溶液:大小顺序为①>②>③
C.常温下, NaHA溶液的pH=8,则溶液中:
D.常温下,NaB溶液的pH=8,
15.均苯三甲酸(,用H3T表示)水溶液存在如下平衡:,向 H3T溶液中加入HCl(g)或NaOH(s)时(忽略溶液体积的变化),溶液中各含T微粒的分布系数随溶液pH变化的曲线如图所示:
已知
下列说法错误的是( )
A.若用NaOH(aq)滴定H3T(aq)至恰好生成Na2HT,可选酚酞指示剂
B.M点,
C.的Na2HT溶液中:
D.25℃时HCN的电离平衡常数,则与不能大量共存
三、非选择题:本题共4个小题,共60分。
16.W、X、Y、Z、M是原子序数依次增大的前四周期元素,其元素性质或结构如下:
回答下列问题:
(1)写出X元素的名称______;Y元素的元素符号______。
(2)写出M元素+2价离子的价层电子排布式______。
(3)基态Z元素原子核外电子占据的最高能层包含的原子轨道数为______。
(4)W、X、Z可形成强还原性物质ZXW4,W、X、Z三种元素电负性由大到小的顺序是______(用元素符号表示)。
(5)中国的稀土储量世界第一、稀土元素是周期系ⅢB族中原子序数为21(Sc)、39(Y)和镧系元素共17种化学元素的统称。其中钪(Sc)元素有______种运动状态不同的电子,最高能层符号是______;稀土元素分组方法之一是两分法[轻稀土和重稀土]。两分法分组以Gd(钆)划界的原因是:从Gd之后在4f亚层上新增加电子的自旋方向改变了,则Gd的4f能级价层电子排布图为______。
17.化学实验是研究物质及其转化的基本方法,是科学探究的一种重要途径。
Ⅰ.为探究不同钠盐对FeCl3水解平衡的影响,化学小组设计如下实验。
实验1:常温下,取10.00 mL FeCl3溶液置于烧杯中,加入0.02 ml的NaCl固体,利用pH传感器测得溶液pH与时间的关系如图所示。
实验2:常温下,取10.00 mL FeCl3溶液置于烧杯中,加入0.01 ml的Na2SO4固体,利用pH传感器测得溶液pH与时间的关系如图所示。
已知:①常温下,H2SO4的电离常数为,。
②在强酸弱碱盐溶液中加入强电解质,溶液中的离子总浓度增大,离子之间的相互牵制作用增强,易水解的阳离子的活性会增强或减弱。
(1)FeCl3溶液呈酸性的原因是____________________(写出必要的离子方程式)。
(2)实验1中10 s后溶液的pH下降的主要原因为______。
(3)实验2中20 s后溶液的pH增大的主要原因为______。
实验结论:不同的钠盐对FeCl3溶液水解平衡的影响是不同的。
Ⅱ.葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O3作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
向样品中加入盐酸的目的是将Na2S2O3转化成SO2;滴定过程中发生的反应是:
(4)滴定时,I2溶液应装在______(“酸”或“碱”)式滴定管中,滴定终点的现象为______。
(5)实验消耗标准I2溶液c mL,样品中抗氧化剂的残留量(以游离SO2计算)为______。
(6)下列情形会造成测定结果偏低的是______(填序号)。
a.滴定前平视,滴定后仰视
b.滴定前滴定管尖嘴有气泡,滴定后气泡消失
c.滴定持续时间稍长,溶液中部分HI被空气氧化
d.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗
18.(1)25℃时,亚碲酸(H2TeO3)的,。常温下,NaHTeO3溶液的pH______(填“<”“>”或“=”)7。
(2)已知25℃时,要使溶液中沉淀完全[],则需控制溶液中______。
(3)室温下,测得用氨水吸收CO2时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液pH=10,则溶液中______(已知)。
(4)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数,,的电离常数,则所得的NH4HCO3溶液中______(填“>”“<”或“=”)。
(5)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出SOCl2和H2O反应的化学方程式:____________________。
②利用制备无水AlCl3时,可用SOCl2和混合共热,试解释原因:______。
19.二氧化碳的综合利用是当下研究的重要课题。回答下列问题:
(1)已知下列热化学方程式:
反应Ⅰ:
反应Ⅱ:
则反应 ______。
(2)①向体积均为V L的恒压密闭容器中通入1 ml CO2、3 ml H2,分别在0.1 MPa和1 MPa下发生上述反应Ⅰ和反应Ⅱ,分析温度对平衡体系中CO2、CO、CH4的影响,设这三种气体物质的量分数之和为1,其中CO和CH4的物质的量分数与温度变化关系如图所示。下列叙述能判断反应体系达到平衡的是______(填标号)。
A.CO2的消耗速率和CH4的消耗速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
②图中表示1 MPa时CH4的物质的量分数随温度变化关系的曲线是______(填字母),理由是______;
③在N点所示条件下,t min反应达到平衡,平衡时容器的体积为______L,反应Ⅱ的______。(以分压表示,分压=总压×物质的量分数)
(3)一种从高炉气回收CO2制储氢物质HCOOH的综合利用示意图如图所示:
①某温度下,当吸收池中溶液的pH=8时,此时该溶液中______[已知:该温度下,]。
②利用电化学原理控制反应条件能将CO2电催化还原为HCOOH,电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移3 ml 时,阴极室溶液的质量增加______g。[B的电解效率]。
2023-2024学年高二上学期12月月考
答案
1.B 2.D 3.D 4.C 5.C 6.B 7.C 8.D 9.B 10.D
11.D 12.BC 13.D 14.C 15.AC
16.(1)硼 N (2)3d6 (3)9 (4)H>B>Na (5)21 N
17.(1)FeCl3是强酸弱碱盐,在溶液中发生水解反应呈酸性,水解的离子方程式为
(2)加入NaCl固体后,离子总浓度增大,离子之间的相互牵制作用增强,离子的活性增强,水解程度增大
(3)加入的Na2SO4固体后,溶液中硫酸根离子浓度增大,与结合生成,溶液中浓度减小
(4)酸 滴入最后一滴I2溶液,溶液由无色变为蓝色,且半分钟内不褪色
(5) (6)c
18.(14分)
(1)< (2) (3)1∶2 (4)>
(5)①
②SOCl2和结晶水反应既能消耗水,生成的酸又能抑制AlCl3水解
19.(1)+206.1
(2)①B ②a 反应Ⅰ正反应放热,升高温度,平衡逆向移动(2分),增大压强,反应Ⅰ正向移动,CH4物质的量分数增大(2分) ③0.75V
(3)①4 ②55.2选项
实验操作
结论
A
反应达平衡后,缩小容器体积,容器内颜色加深
平衡逆向移动
B
将AlCl3溶液与NaHCO3溶液混合,产生白色沉淀
难溶于水
C
向2 mL 的FeCl3溶液中加5 mL KI溶液,充分反应后加入KSCN溶液,溶液变红
与的反应有一定限度
D
用pH试纸测得浓度均为的CH3COONa溶液pH约为9,NaNO2溶液pH约为8
HNO2电离出的能力比CH3COOH弱
操作
现象
解释或结论
A
向的HCOOH中加水稀释并测其pH
溶液pH不断增大
HCOOH是弱酸
B
室温下,测定等物质的量浓度的NaNO2、Na2CO3溶液的pH
Na2CO3溶液pH大
HNO2的酸性比H2CO3的强
C
分别测浓度均为的CH3COONH4和NaHCO3溶液的pH
后者大于前者
D
将少量投入NH4Cl溶液中
溶解
和反应生成,使溶解
元素
元素性质或原子结构
W
电子只有一种自旋取向
X
核外只有一个未成对电子,且电子有三种空间运动状态
Y
s轨道电子数比p轨道多一个,且第一电离能大于同周期相邻元素
Z
电负性是短周期中最小的
M
+3价基态离子最高能级处于半满状态
山东省临沂市2023-2024学年高二上学期期末化学试题: 这是一份山东省临沂市2023-2024学年高二上学期期末化学试题,共9页。
山东省临沂市沂水县2023-2024学年高二上学期11月期中学业水平质量检测化学试题含答案: 这是一份山东省临沂市沂水县2023-2024学年高二上学期11月期中学业水平质量检测化学试题含答案,共13页。试卷主要包含了11等内容,欢迎下载使用。
山东省临沂市临沭第一中学2023-2024学年高二上学期12月教学质量监测化学试题含答案: 这是一份山东省临沂市临沭第一中学2023-2024学年高二上学期12月教学质量监测化学试题含答案,共21页。试卷主要包含了12,25 0,6 ②D ③,10等内容,欢迎下载使用。












