
北京市昌平区2023-2024学年九年级上学期期末化学试题
展开
这是一份北京市昌平区2023-2024学年九年级上学期期末化学试题,共8页。试卷主要包含了空气中氧气的体积分数约为,喝牛奶可以补钙,下列属于金属元素的是,下列仪器不能用作反应容器的是,能够闻到远处的花香,其原因是等内容,欢迎下载使用。
2024.1
本试卷共8页,共两部分,38个小题,满分70分。考试时间70分钟。考生务必将答案填涂成书写在答题卡上,在试卷上作答无效。考试结束后,请交回答题卡。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
第一部分
本部分共25题,每题1分,共25分。在每题列出的四个选项中,选出最符合题目要求的一项。
1.空气中氧气的体积分数约为( )
A.78% B.21% % %
2.喝牛奶可以补钙。这里的“钙”指的是( )
A.单质 B.元素 C.分子 D.原子
3.下列属于金属元素的是( )
A.氧 B.碳 C.铁 D.硅
4.下列物质属于纯净物的是( )
A.酱油 B.蒸馏水 C.过氧化氢溶液 D.洁净的空气
5.下列物质在O2中燃烧,火星四射、产生黑色固体的是( )
A.氢气 B.甲烷 C.铁丝 D.红磷
6.下列物质的性质中,属于化学性质的是( )
A.无色无味 B.溶解性 C.可燃性 D.挥发性
7.下列仪器不能用作反应容器的是( )
A.试管 B.量筒 C.烧杯 D.集气瓶
8.能够闻到远处的花香,其原因是( )
A.分子在不断运动 B.分子之间有间隔
C.分子的质量和体积都很小 D.分子是由原子构成的
9.下列物质中,不属于空气污染物的是( )
A.一氧化碳 B.二氧化碳 C.二氧化硫 D.可吸入颗粒物
10.能鉴别空气和氧气两瓶气体的方法是( )
A.看颜色 B.闻气味 C.倒入水 D.伸入带火星的木条
11.下列元素名称与符号不一致的是( )
A.碳C B.氯Cl C.钾K D.铜Ca
12.下列物质中含有氢分子的是( )
A.H2 B.H2O C.H2O2 D.Ca(OH)2
13.下列符号中,表示两个氧原子的是( )
A.O2 B.2O C.2O2- D.2O2
14.下列含氧元素的物质中属于氧化物的是( )
A.O2 B.Al2O3 C.NaOH D.CaCO3
15.下列实验操作正确的是( )
A.读取液体体积 B.点燃酒精灯
C.过滤 D.倾倒液体
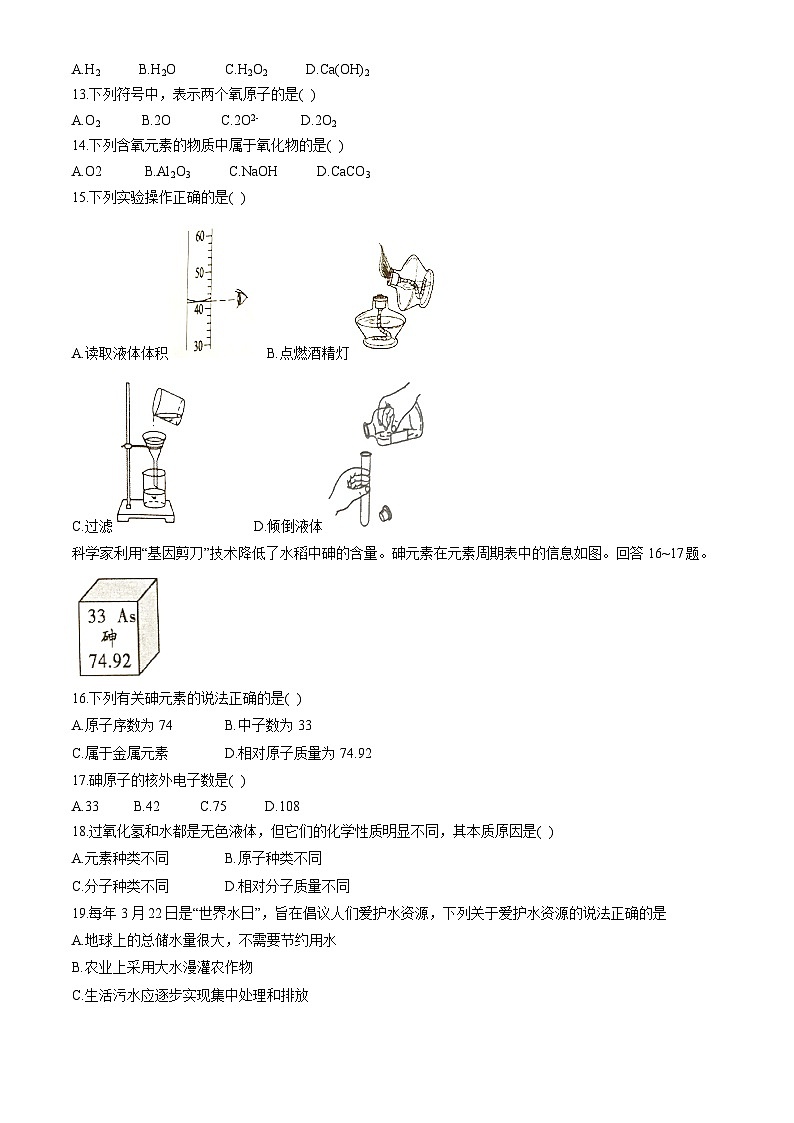
科学家利用“基因剪刀”技术降低了水稻中砷的含量。砷元素在元素周期表中的信息如图。回答16~17题。
16.下列有关砷元素的说法正确的是( )
A.原子序数为74 B.中子数为33
C.属于金属元素 D.相对原子质量为74.92
17.砷原子的核外电子数是( )
A.33 B.42 C.75 D.108
18.过氧化氢和水都是无色液体,但它们的化学性质明显不同,其本质原因是( )
A.元素种类不同 B.原子种类不同
C.分子种类不同 D.相对分子质量不同
19.每年3月22日是“世界水日”,旨在倡议人们爱护水资源,下列关于爱护水资源的说法正确的是
A.地球上的总储水量很大,不需要节约用水
B.农业上采用大水漫灌农作物
C.生活污水应逐步实现集中处理和排放
D.为了防止水体污染,禁止使用化肥和农药
20.某同学制作的试剂标签如下,其中化学式书写不正确的是
A. B. C. D.
21.关于化学反应“2H2S+3O22SO2+2H2O"的叙述中,不正确的是
A.H2S具有可燃性
B.反应前后原子种类、个数不变
C.硫元素的化合价由-2价升高到+2价
D.参加反应的硫化氢与氧气的分子个数比为2:3
22.火药是我国古代四大发明之一,其中涉及的主要反应为:S+3C+2KNO3K2S+N2↑+3X↑,X的化学式为
A.C B.CO C.CO2 D.SO2
大国重器彰显中国实力,化学助力科学成果转化应用。回答23~24题。
23.“中国天眼”射电望远镜使用了碳化硅(SC)。碳元素和硅元素的本质区别是
A.质子数不同 B.相对原子质量不同
C.中子数不同 D.最外层电子数不同
24.歼-20是高态势感知、高机动性的隐形战斗机。其中隐身材料的合成原料之为间苯二胺(C6H8N2)。下列说法不正确的是
A. 间苯二胺属于有机化合物 B.间苯二胺由碳、氢、氮元素组成
C.1个间苯二胺分子由16个原子构成 D. 间苯二胺中碳、氢元素质量比为3:4
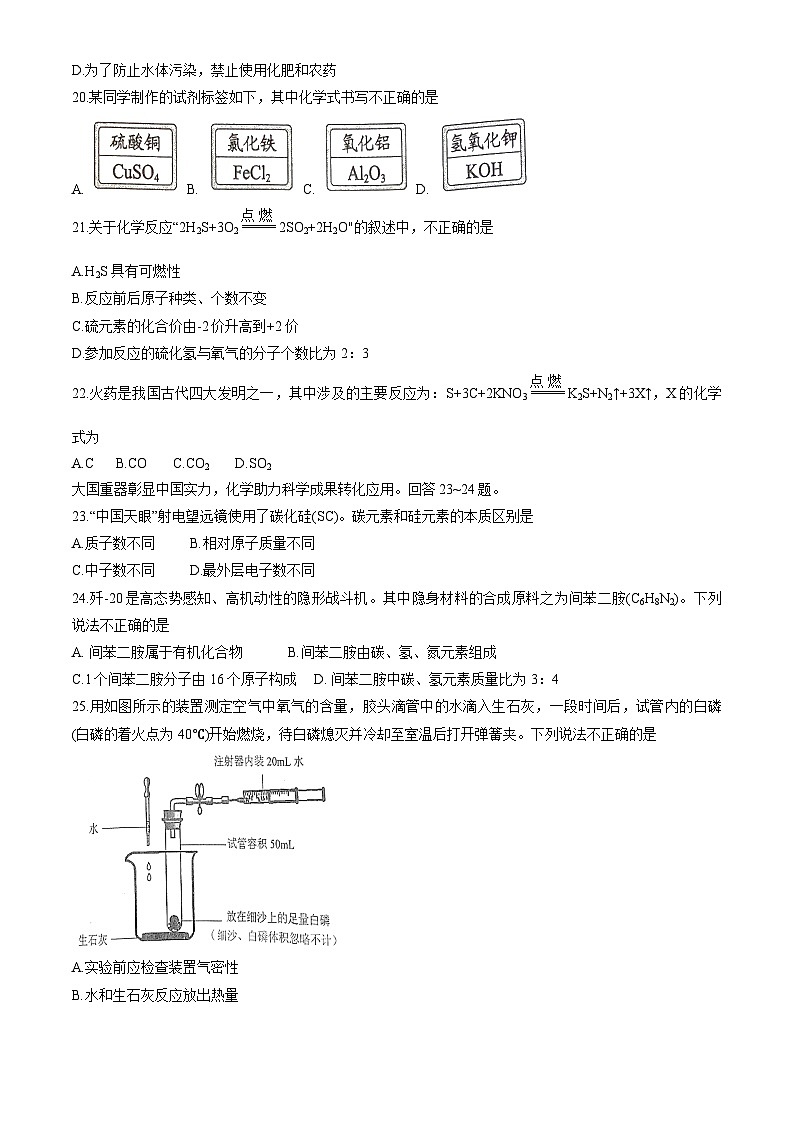
25.用如图所示的装置测定空气中氧气的含量,胶头滴管中的水滴入生石灰,一段时间后,试管内的白磷(白磷的着火点为40℃)开始燃烧,待白磷熄灭并冷却至室温后打开弹簧夹。下列说法不正确的是
A.实验前应检查装置气密性
B.水和生石灰反应放出热量
C.此实验还能验证可燃物燃烧需要温度达到其着火点
D.实验结束后,注射器活塞若停留在12mL处,则证明氧气约占空气体积的
第二部分
本部分共13题,共45分。
【生活现象解释】
26.(2分)填空题。
26-A.把用途和性质用相应的字母填空:
a. 升华吸热 b.化学性质稳定 c.导电性
(1)氮气做保护气_______;
(2)石墨用作电极材料_______;
(3)干冰可用于人工降雨_______;
26-B把事故和处理方法用相应的字母填空:
d.用二氧化碳灭火器扑灭 e.立即盖上锅盖 f.立即关闭阀门并开窗通风
(4)炒菜时油锅着火_______;
(5)厨房煤气管道漏气_______;
(6)图书馆内图书着火_______。
27.(2分)目前人们使用的燃料大多数来自化石燃料。
(1)化石燃料包括天然气、煤、_______。
(2)天然气的主要成分是甲烷,甲烷燃烧的化学方程式为______________。
28.(3分)生活中养鱼,蕴含着丰富的化学知识。
(1)H2O2可作增氧剂,用化学方程式解释其原因______________。
(2)活性炭能去除有害气体和异味,利用其具有的性质是_______。
(3)次氯酸钠(NaClO)可作消毒剂,其中氯元素的质量分数为_______(写出计算式即可)。
【科普阅读理解】
29.(5分)阅读下面科普短文。
甲醇,在干馏木材中首先被发现,故俗称“木醇”或“木精”,甲醇分子的微观示意图如图1所示。
常温常压下,甲醇为液体,具有毒性,误饮后对人体有严重伤害。但作为能源,甲醇具有燃烧高效、排放清洁、可再生等特点。
甲醇被誉为“液态阳光”。“液态阳光”是指利用太阳能等可再生能源分解水制取氢气,氢气再与二氧化碳反应生成的甲醇。甲醇成为太阳能的最佳载体,实现了人类想把太阳能装进瓶子里,随处携带,随时取用的美好梦想。为了这个梦想,人类不断探究CO2与H2合成甲醇反应的影响因素,实验测得CO2的平衡转化率与温度、压强的关系如图2所示。
伴随甲醇产量的增加和所具有的碳中和特点,甲醇正在从原有的基本化工产品角色转向未来燃料能源,将在人类可持续发展中发挥重要作用。
依据文章内容回容下列问题:
(1)甲醇俗称“木醇”或“木精”的原因_____________。
(2)从元素守恒角度分析,甲醇可以分解得到氢气的原因是______________。
(3)判断下列说法是否正确(填“对”或“错”)
①甲醇中C、O原子的质量比为1:1_______。
②生产并使用液态阳光”可在一定程度上缓解当下全球变暖的不利局面_______。
(4)由图2可得出的结论是_______。
【生产实际分析】
30.(5分)由煤转化为氢气和电能的部分工艺流程图如下:
(1)煤在进入煤气化炉之前需要进行粉碎,目的是_______。
(2)分离器中发生的变化是_______变化(填“物理”或“化学”)。
(3)高温条件下,水煤气交换器中发生反应的化学方程式为______________。
(4)燃料电池中发生的反应属于基本反应类型中的_______反应。
(5)汽轮机发电系统的能量转化形式是_______ (写序号)。
a.化学反应的能量转化为电能
b.热能转化为电能
c.光能转化为电能
【基本实验及其原理分析】
31.(5分)根据下图回答问题。
(1)仪器a的名称是_______。
(2)加热高锰酸钾制氧气的化学方程式为______________,选用C装置收集氧气的原因是______________。
(3)实验室制取二氧化碳的化学方程式为__________,选用的发生装置为_______ (写序号)。
32.(3分)用下图实验研究氧气的性质。
(1)实验1,木炭在氧气中燃烧的现象是______________。
(2)实验2,铁丝在氧气中燃烧的化学方程式是___________。集气瓶中水的作用是_______。
33.(2分)利用右图装置探究水的组成。
(1)检验b管中气体的操作为:将带火星的木条放在b管口处,_______,观察现象。
(2)经检验a管产生H2,由此得出关于水的组成的推论是_______。
34.(3分)利用下图所示装置进行实验。
(1)实验A中气球的作用_______。
(2)一段时间后,实验B中指针_______ (填“向左偏转”“向右偏转”或“不偏转”),其原因是_______________。
35.(3分)用右图装置进行实验研究CO2的性质。
(1)倒入CO2,可证明CO2能与水反应的现象是______________,密度比空气大的现象是_______。
(2)将燃着的蜡烛放在a处,倒入CO2,蜡烛熄灭,由此可得出CO2具有的性质是_______。
36.(3分)右图所示实验可用于研究燃烧条件。
已知:白磷和红磷的着火点分别为40℃、240℃。
(1)热水的作用______________。
(2)白磷燃烧的化学方程式为______________。
(3)铜片上的白磷燃烧而水中白磷不燃烧,说明可燃物燃烧的条件之一是_______。
【科学探究】
37.(6分)封闭空间如果不及时采取措施,会出现CO2浓度超标。某化学兴趣小组采用化学吸附法去除CO2,探究吸附剂种类和吸附塔高度对CO2吸收效果的影响。
【进行实验】氢氧化锂,氢氧化钙和钠石灰均采用某化工厂生产的直径3mm,厚度1mm的药片状颗粒,吸附塔内径为110mm利用测定平均反应速率来评价吸附剂对CO2的吸收效果,平均反应速率越大,吸收效果越好。实验记录如下:
【解释与结论】
(1)氢氧化钙吸收CO2的化学方程式为________________。
(2)氢氧化钙吸收塔高为_____mm时,去除CO2效果最好。
(3)实验2的目的是___________。
(4)能说明吸附剂种类对CO2吸收效果有影响,依据的实验是_____(写序号)。
【反思与评价】
(5)通过上述实验可得出,对CO2吸收效果最好的条件是_________。
(6)除吸附塔高度、吸附剂种类外,影响CO2吸收效果的因素还可能有________。
【实际应用定量计算】
38.(3分)过氧化钠(Na2O2)是潜水艇中的换气剂,制备反应的化学方程式为:2Na+O2Na2O2。若要制得78gNa2O2,计算参加反应的O2的质量(写出计算过程及结果)。
实验序号
吸附剂种类
吸附塔高度(mm)
平均反应速率(%/min)
1
1-1
氢氧化钙
30
0.029
1-2
50
0.067
1-3
80
0.053
2
2-1
氢氧化锂
30
0.071
2-2
50
0.045
2-3
80
0.036
3
3-1
钠石灰
30
0.041
3-2
50
0.053
3-3
80
0.071
相关试卷
这是一份北京市昌平区2023-2024初三上学期期末化学试卷及答案,共10页。
这是一份2023-2024学年北京市昌平区初三上学期期末考试化学试题及答案,共10页。
这是一份北京市昌平区2023-2024学年九年级上学期期末质量抽测化学试卷,共21页。试卷主要包含了 空气中氧气的体积分数约为,94%D, 下列属于金属元素的是, 下列物质属于纯净物的是, 能够闻到远处的花香,其原因是, 下列物质不属于空气污染物的是等内容,欢迎下载使用。








