


2024版高考总复习-化学二轮专题(新教材) 大题突破练(2) 化学实验综合题课件PPT
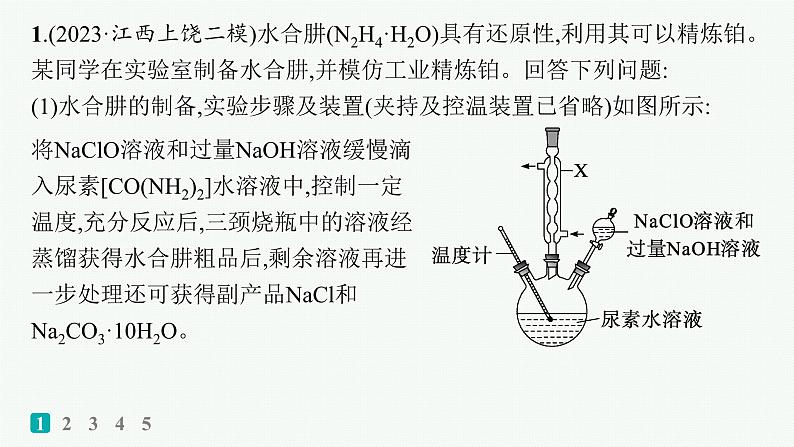
展开1.(2023·江西上饶二模)水合肼(N2H4·H2O)具有还原性,利用其可以精炼铂。某同学在实验室制备水合肼,并模仿工业精炼铂。回答下列问题:(1)水合肼的制备,实验步骤及装置(夹持及控温装置已省略)如图所示:
将NaClO溶液和过量NaOH溶液缓慢滴入尿素[CO(NH2)2]水溶液中,控制一定温度,充分反应后,三颈烧瓶中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品NaCl和Na2CO3·10H2O。
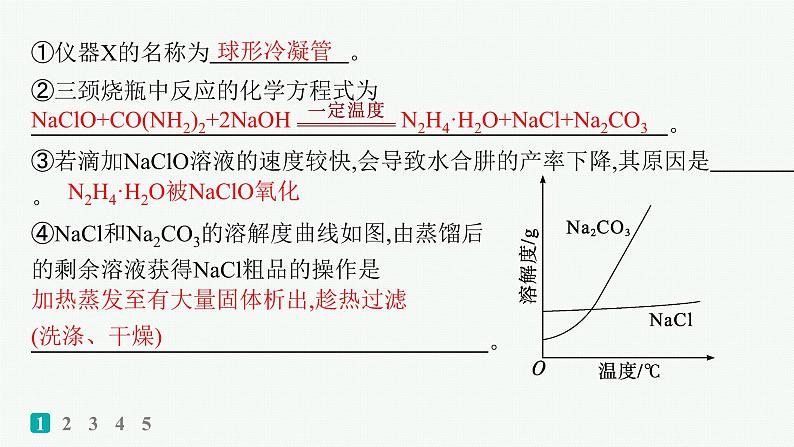
①仪器X的名称为 。 ②三颈烧瓶中反应的化学方程式为 。 ③若滴加NaClO溶液的速度较快,会导致水合肼的产率下降,其原因是 。 ④NaCl和Na2CO3的溶解度曲线如图,由蒸馏后的剩余溶液获得NaCl粗品的操作是 。
NaClO+CO(NH2)2+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O被NaClO氧化
加热蒸发至有大量固体析出,趁热过滤(洗涤、干燥)
(2)水合肼还原精炼法制备铂的流程如下:
①常温下,(NH4)2PtCl6难溶于水,粗(NH4)2PtCl6中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解、过滤后洗涤,洗涤沉淀方法是 。
向漏斗中加水至没过沉淀,待水滤出后重复2~3次
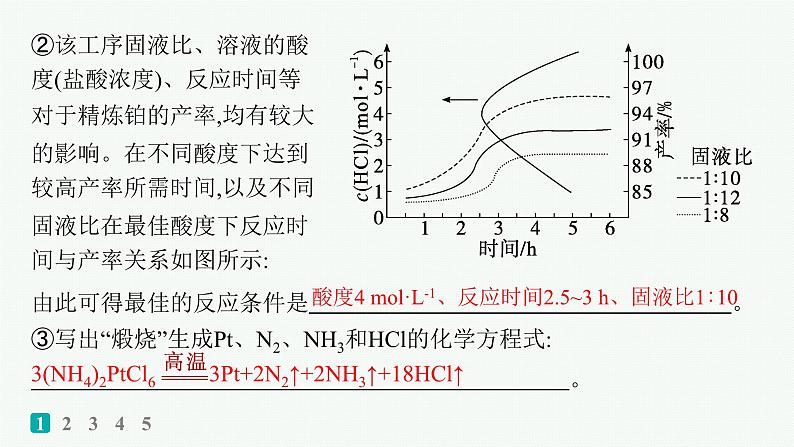
②该工序固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示:
由此可得最佳的反应条件是 。 ③写出“煅烧”生成Pt、N2、NH3和HCl的化学方程式: 。
酸度4 ml·L-1、反应时间2.5~3 h、固液比1∶10
3(NH4)2PtCl6 3Pt+2N2↑+2NH3↑+18HCl↑
解析 (1)②NaClO溶液和过量NaOH溶液、尿素[CO(NH2)2]溶液反应,生成NaCl和Na2CO3、水合肼。③N2H4·H2O具有还原性,NaClO具有氧化性,若滴加NaClO溶液的速度较快,会导致水合肼的产率下降,其原因是N2H4·H2O被NaClO氧化。④结合NaCl和Na2CO3的溶解度曲线,由蒸馏后的剩余溶液获得NaCl粗品的操作是加热蒸发至有大量固体析出,趁热过滤(洗涤、干燥)。(2)②由图可知,最佳的反应条件是酸度4 ml·L-1时反应达到较高产率且耗时较短,反应速率较快;反应时间2.5~3 h时产率较高且基本不再增加,固液比1∶10时产率较高,故最佳反应条件为酸度4 ml·L-1、反应时间2.5~3 h、固液比1∶10。
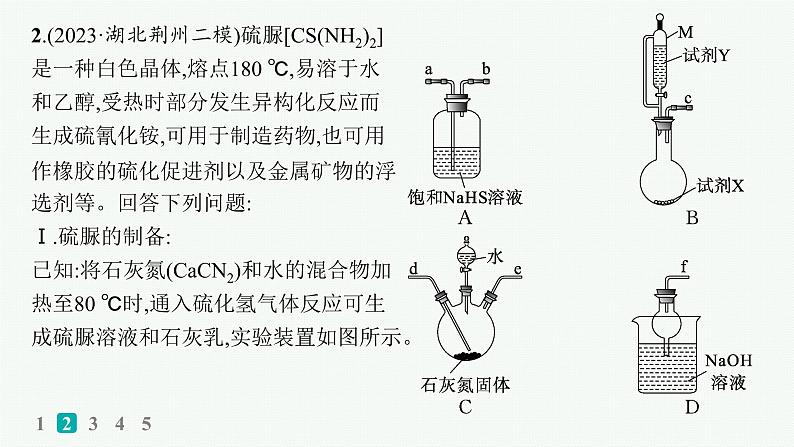
2.(2023·湖北荆州二模)硫脲[CS(NH2)2]是一种白色晶体,熔点180 ℃,易溶于水和乙醇,受热时部分发生异构化反应而生成硫氰化铵,可用于制造药物,也可用作橡胶的硫化促进剂以及金属矿物的浮选剂等。回答下列问题:Ⅰ.硫脲的制备:已知:将石灰氮(CaCN2)和水的混合物加热至80 ℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,实验装置如图所示。
(1)装置B中的试剂X和试剂Y的最佳组合是 (填字母)。 A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸(2)仪器M的名称为 。按(1)中所选试剂组合,按气流从左到右的方向,上述装置的合理连接顺序为c→ (填仪器接口的小写字母)。 (3)装置C中反应温度控制在80 ℃,温度不宜过高或过低的原因是 ,装置C中反应的化学方程式为 。
a→b→d→e→f
温度过高,硫脲会部分发生异构化反应而生成硫氰化铵;温度过低,反应速度缓慢
CaCN2+H2S+2H2O CS(NH2)2+Ca(OH)2
Ⅱ.硫脲的分离及产品含量的测定:(4)装置C反应后的液体过滤后,将滤液减压蒸发浓缩,之后冷却结晶,离心分离,烘干即可得到产品。称取m g产品,加水溶解配成500 mL溶液,量取25 mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用c ml·L-1 KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液V mL。①硫脲[CS(NH2)2]中硫元素的化合价为 价。 ②滴定时,硫脲转化为CO2、N2、 的离子方程式为 。③样品中硫脲的质量分数为 (用含“m、c、V”的式子表示)。
解析 (3)若反应温度过高,硫脲会部分发生异构化反应而生成硫氰化铵;若反应温度过低,反应速度缓慢,故装置C中反应温度控制在80 ℃;装置C中,将石灰氮(CaCN2)和水的混合物加热至80 ℃时,通入硫化氢气体反应可生成硫脲溶液和石灰乳,化学方程式为CaCN2+H2S+2H2O CS(NH2)2+Ca(OH)2。(4)③用c ml·L-1 KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液V mL,消耗KMnO4的物质的量为cV×10-3 ml,根据滴定反应可知,m g产
3.(2023·湖南怀化二模)连二亚硫酸钠(Na2S2O4)广泛用于纺织、印染、造纸等行业,因其使用时对织物的损伤很小,故又称“保险粉”。Ⅰ.Na2S2O4制备锌粉法是最早应用于工业生产连二亚硫酸钠的方法,其制备原理及装置如下:
步骤1:检查装置气密性并加入药品;步骤2:打开仪器a的活塞,向装置C中通入一段时间SO2,发生反应:Zn+2H2SO3 ══ ZnS2O4+2H2O;步骤3:打开仪器c的活塞滴加稍过量的NaOH溶液使装置C中溶液的pH处在8.2~10.5之间,发生反应ZnS2O4+2NaOH ══ Na2S2O4+Zn(OH)2↓;步骤4:过滤,将滤液经“一系列操作”可获得Na2S2O4。已知:①Na2S2O4易溶于水,不溶于乙醇,在碱性介质中较稳定。②Zn(OH)2与Al(OH)3的化学性质相似。
回答下列问题:(1)仪器d的名称为 。 (2)装置B(单向阀)的作用为 。 (3)一系列操作包括盐析、过滤、脱水、洗涤、干燥等操作,其中洗涤所用的试剂为 (填字母)。 A.乙醇B.NaOH溶液C.水D.浓硫酸(4)步骤3需控制溶液的pH在8.2~10.5之间,其原因为 。
pH太小Na2S2O4不能稳定存在(且不能使沉淀完全),pH太大Zn(OH)2会溶解,使得制备的Na2S2O4不纯
Ⅱ.Na2S2O4含量的测定称取2.0 g制得的Na2S2O4产品溶于冷水配成250 mL溶液,取出25.00 mL该溶液于锥形瓶中,用0.10 ml·L-1碱性K3[Fe(CN)6]标准溶液滴定,选择合适指示剂,平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。(5)[Fe(CN)6]3-是一种比较弱的氧化剂,能将 ,自身被还原为[Fe(CN)6]4-,滴定中发生反应的离子方程式为 。
(6)选择指示剂时,指示剂的条件电位要在滴定突跃电位之间,本实验滴定突跃范围为0.01~0.38 V,根据下表,可选择 为指示剂。
(7)样品中Na2S2O4的质量分数为 (杂质不参与反应,计算结果精确到0.1%)。
解析 (4)步骤3需控制溶液的pH在8.2~10.5之间,其原因为pH太小Na2S2O4不能稳定存在(且不能使沉淀完全),pH太大Zn(OH)2会溶解,使得制备的Na2S2O4不纯。
(6)本实验滴定突跃范围为0.01~0.38 V,根据表中信息,亚甲基蓝的条件电位为0.36 V,且由还原态到氧化态颜色由无色变为蓝色,故可选择亚甲基蓝为指示剂。
(7)平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL,第二次误差较大,舍去,则平均消耗体积为20.00 mL,用0.10 ml·L-1碱性K3[Fe(CN)6]标准溶液滴定,其物质的量为0.10 ml·L-1×20.00×10-3 L =2.0×10-3 ml,根据滴定反应可知,2.0 g Na2S2O4产品中Na2S2O4的物质的
4.(2023·北京朝阳区二模)某小组同学探究Na2SO3和不同铜盐溶液的反应,实验如下。实验:向2 mL 0.5 ml·L-1 Na2SO3溶液中加入1 mL 0.25 ml·L-1 CuCl2溶液,立即产生橙黄色沉淀(沉淀A),放置5 min左右,转化为白色沉淀(沉淀B)。
(1)研究沉淀B的成分。向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。①白色沉淀是AgCl,试剂X是 。 ②无色溶液在空气中放置变为深蓝色,反应的离子方程式为 。
足量硝酸和AgNO3溶液
①仅通过上述实验不能证明沉淀A中含有Cl-,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有Cu+的证据是 。 ②无色溶液中含有 ,推测 的产生有两个途径:途径1:实验过程中O2氧化 ;途径2: (将途径补充完整)。 经研究,途径1不合理,途径2合理。③解释Na2SO3和CuCl2溶液反应时,先产生橙黄色沉淀,再转化为白色的原因: 。
(2)经检验,沉淀A不含 。推测沉淀A能转化为沉淀B与Cl-有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
在Cl-的作用下,Cu2+氧化亚硫酸根到硫酸根
CuCl2和Na2SO3溶液生成棕黄色沉淀A反应速率快,生成白色沉淀B的程度大
(3)Na2SO3和CuCl2溶液反应最终生成CuCl沉淀,并检测到有SO2生成,离子方程式是 。用Na2SO3和CuSO4溶液重复上述实验,仅产生橙黄色沉淀,放置72 h后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。 (4)根据上述实验所得结论:_______________________________________ (答出两点)。
Cu2+和 能发生复分解反应和氧化还原
反应,且复分解反应速率更快;在Cl-作用下,Cu2+的氧化性增强
解析 (2)ⅱ.Cu+ Cu2++Cu,向含有亚铜离子的溶液中加入稀硫酸会发生歧化反应,生成铜,故答案为有红色固体析出;溶液中的氧化剂除了氧气之外还有铜离子,当存在氯离子时,铜离子会具有较强的氧化性,会把亚硫酸根氧化,故答案为在Cl-的作用下,Cu2+氧化亚硫酸根到硫酸根;向2 mL 0.5 ml·L-1 Na2SO3溶液中加入1 mL 0.25 ml·L-1 CuCl2溶液,立即产生橙黄色沉淀(沉淀A),说明生成亚硫酸铜沉淀的反应较快,放置5 min左右,转化为白色沉淀(沉淀B),说明生成白色沉淀B的程度大。
(3)Na2SO3和CuCl2溶液反应最终生成CuCl沉淀,该反应未外加酸碱,所以反应物为水,生成物为氢离子,根据电子守恒及电荷守恒可知,该反应的离子
(4)向2 mL 0.5 ml·L-1 Na2SO3溶液中加入1 mL 0.25 ml·L-1 CuCl2溶液,立即产生橙黄色沉淀亚硫酸铜,在NaCl溶液中,亚硫酸铜继续发生氧化还原反应,生成CuCl白色沉淀,根据沉淀颜色的变化快慢可知,复分解反应较快,氧化还原反应较慢。
5.(2023·广东六校联盟联考)某实验小组探究浅黄色草酸亚铁晶体(FeC2O4·2H2O)分解产物的装置如图所示。
回答下列问题:(1)仪器M的名称是 。 (2)点燃酒精灯之前,先通入N2,其目的是 。(3)装置C的作用是 。
检查是否有CO2生成
(4)如果实验中观察到C、H变浑浊,E不变浑浊,可以得出实验结论:A装置中分解的气体产物一定有 (填化学式)。 (5)在300 ℃、500 ℃下进行上述实验,A装置中分别得到甲、乙两种黑色粉末,进行实验并观察到现象如下:
根据上述实验,实验①产生蓝色沉淀的离子方程式为 。乙中的成分可能为 (填化学式)。
K++Fe2++[Fe(CN)6]3- ══ KFe[Fe(CN)6]↓或3Fe2++2[Fe(CN)6]3- ══ Fe3[Fe(CN)6]2↓
Fe和FeO或Fe、FeO和FeC2O4
(6)测定草酸亚铁晶体(FeC2O4·2H2O)纯度。准确称取W g样品于锥形瓶,加入适量的稀硫酸,用c ml·L-1 KMnO4溶液滴定至终点,消耗b mL KMnO4溶液。滴定反应:FeC2O4+ +H+→Fe3++CO2+Mn2++H2O(未配平)。该样品纯度为 %。若滴定管没有用待装液润洗,测得结果 (填“偏高”“偏低”或“无影响”)。
解析 (4)实验中观察到C、H变浑浊,说明都有二氧化碳,E不变浑浊,说明产物中存在CO,故可以得出实验结论:A装置中分解的气体产物一定有CO和CO2。(5)由题干信息可知,将黑色粉末溶于稀硫酸,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明有Fe2+,实验①产生蓝色沉淀的离子方程式为K++Fe2++[Fe(CN)6]3- ══ KFe[Fe(CN)6]↓或3Fe2++2[Fe(CN)6]3- ══ Fe3[Fe(CN)6]2↓;用强磁铁接近乙,吸起部分粉末,将吸起来的粉末投入盐酸中,产生气泡,说明存在Fe,故乙中的成分可能为Fe和FeO或Fe、FeO和FeC2O4。
2024版高考总复习-化学二轮专题(新教材) 大题突破练(4) 有机合成与推断综合题课件PPT: 这是一份2024版高考总复习-化学二轮专题(新教材) 大题突破练(4) 有机合成与推断综合题课件PPT,共46页。PPT课件主要包含了3-丙二醇,酰胺键,加成反应,碳氯键,取代反应,苯乙烯,氯原子,碳碳双键等内容,欢迎下载使用。
2024版高考总复习-化学二轮专题(新教材) 大题突破练(3) 化学反应原理综合题课件PPT: 这是一份2024版高考总复习-化学二轮专题(新教材) 大题突破练(3) 化学反应原理综合题课件PPT,共48页。PPT课件主要包含了H2O,sp3,催化剂的中间产物使,CH3CHO,p1p2p3等内容,欢迎下载使用。
2024版高考总复习-化学二轮专题(新教材) 大题突破练(1) 化学工艺流程题课件PPT: 这是一份2024版高考总复习-化学二轮专题(新教材) 大题突破练(1) 化学工艺流程题课件PPT,共28页。PPT课件主要包含了哑铃形,正四面体形,×10-3,5×1011,加快反应速率,重结晶,+6价,NaHCO3,NH3,Al2O3等内容,欢迎下载使用。













