
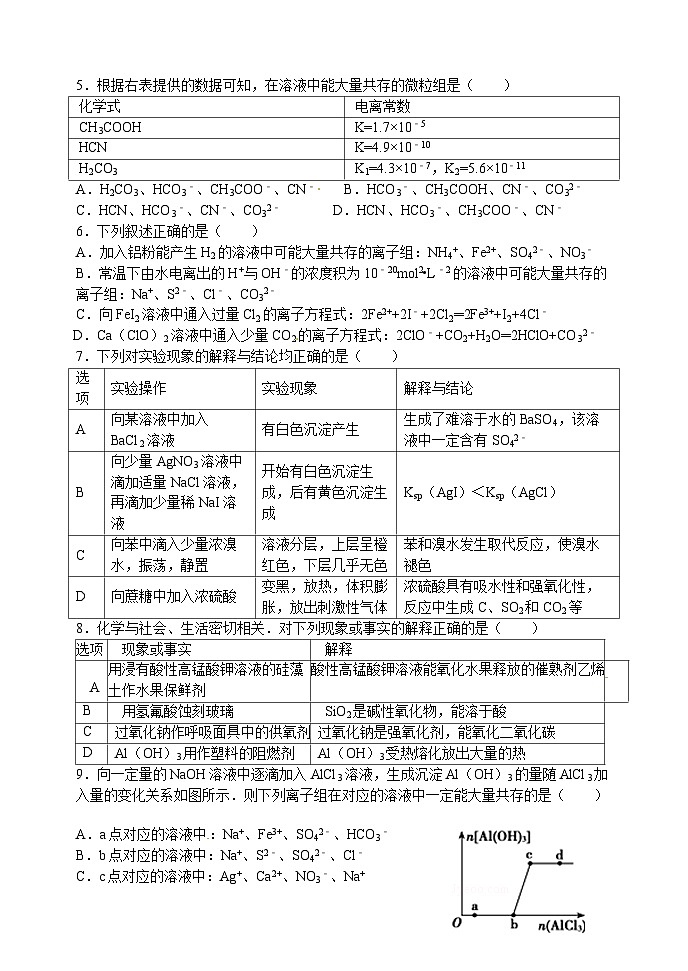
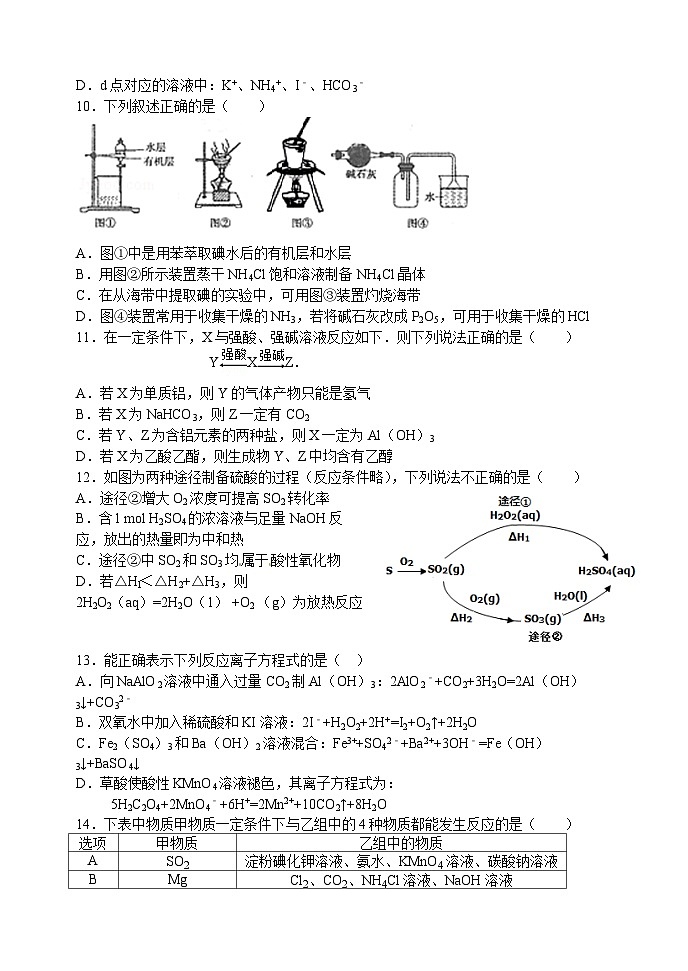
东北育才学校高三二模化学试题及答案
展开答题时间:90分钟 满分:100分
命题人: 张珣 校对人:韩燕
可能用到的相对原子质量 K-39 O-16 Cr-52 Fe-56 C-59 C-12 S-32
Cl-35.5 N-14 Zn-65 Ba-137 Si-28 H-1
一、选择题(每小题只有一个选项符合题意,其中1~10题每小题2分,
11~19题每小题3分,共44分)
1.下列物质与其用途完全符合的是( )
①Na2O2﹣供氧剂 ②晶体Si﹣太阳能电池 ③干冰﹣人工降雨 ④NaCl﹣制纯碱
⑤Al2O3﹣焊接钢轨 ⑥NaClO﹣消毒剂 ⑦Fe2O3﹣红色油漆或涂料 ⑧SO2﹣食品防腐剂 ⑨NH3﹣制冷剂 ⑩水玻璃﹣木材防火剂.
A.①②③④⑥⑦⑨⑩ B.①②③④⑤⑧⑨ C.①②③⑥⑦⑨⑩ D.①②③④⑥⑦⑨
2.科研、生产和生活中的下列做法利用了氧化还原反应的是( )
A.用乙醚从黄花蒿中提取青蒿素
B.由青蒿素()合成双氢青蒿素()的反应
C.空气净化器过滤净化空气 D.消毒柜通电产生臭氧的过程
3.设NA为阿伏加德罗常数的值.下列说法正确的是( )
①50mL12ml/L的盐酸与足量MnO2共热,转移电子数为0.3NA
②2.0gH218O与D216O的混合物中所含中子数为NA
③常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
④常温常压下,6.72 L NO2与水充分反应转移的电子数目为0.2NA
⑤标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA
⑥10g46%的乙醇水溶液中所含氢原子数目为0.6NA
⑦60 g石英晶体中含有的Si﹣O键数目为2NA
⑧25℃时,100mlpH=13的Ba(OH)2溶液中OH﹣的数目为0.02NA
A.①②③⑥⑦⑧ B.②③ C.①②③④⑤ D.②③⑤
4.把少量过氧化钠投入下列溶液中,一定会有白色沉淀生成的是( )
A.1ml/L氢氧化钠 B.饱和碳酸氢钠
C.1ml/L硫酸亚铁 D.饱和碳酸钠
5.根据右表提供的数据可知,在溶液中能大量共存的微粒组是( )
A.H2CO3、HCO3﹣、CH3COO﹣、CN﹣ B.HCO3﹣、CH3COOH、CN﹣、CO32﹣
C.HCN、HCO3﹣、CN﹣、CO32﹣ D.HCN、HCO3﹣、CH3COO﹣、CN﹣
6.下列叙述正确的是( )
A.加入铝粉能产生H2的溶液中可能大量共存的离子组:NH4+、Fe2+、SO42﹣、NO3﹣
B.常温下由水电离出的H+与OH﹣的浓度积为10﹣20ml2•L﹣2的溶液中可能大量共存的离子组:Na+、S2﹣、Cl﹣、CO32﹣新$课$标$第$一$网
C.向FeI2溶液中通入过量Cl2的离子方程式:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
D.Ca(ClO)2溶液中通入少量CO2的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
7.下列对实验现象的解释与结论均正确的是( )
8.化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
9.向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
A.a点对应的溶液中:Na+、Fe3+、SO42﹣、HCO3﹣
B.b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
C.c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
D.d点对应的溶液中:K+、NH4+、I﹣、HCO3﹣
10.下列叙述正确的是( )
A.图①中是用苯萃取碘水后的有机层和水层
B.用图②所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.在从海带中提取碘的实验中,可用图③装置灼烧海带
D.图④装置常用于收集干燥的NH3,若将碱石灰改成P2O5,可用于收集干燥的HCl
11.在一定条件下,X与强酸、强碱溶液反应如下.则下列说法正确的是( )
YXZ.
A.若X为单质铝,则Y的气体产物只能是氢气
B.若X为NaHCO3,则Z一定有CO2
C.若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3
D.若X为乙酸乙酯,则生成物Y、Z中均含有乙醇
12.如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )
A.途径②增大O2浓度可提高SO2转化率
B.含l ml H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中SO2和SO3均属于酸性氧化物
D.若△Hl<△H2+△H3,则
2H2O2(aq)=2H2O(1) +O2 (g)为放热反应
13.能正确表示下列反应离子方程式的是( )
A.向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
B.双氧水中加入稀硫酸和KI溶液:2I﹣+H2O2+2H+=I2+O2↑+2H2O
C.Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42﹣+Ba2++3OH﹣=Fe(OH)3↓+BaSO4↓
D.草酸使酸性KMnO4溶液褪色,其离子方程式为:
5H2C2O4+2MnO4﹣+6H+=2Mn2++10CO2↑+8H2O
14.下表中物质甲物质一定条件下与乙组中的4种物质都能发生反应的是( )
15.2.8g Fe全部溶于一定浓度、200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,下列有关判断正确的是
A.反应后溶液中c(NO3-)=0.85ml/L
B.反应后的溶液最多还能溶解1.4gFe
C.反应后溶液中铁元素可能以Fe2+形式存在
D.1.12L气体可能是NO、NO2的混合气体
16.将一定量的SO2通入FeCl3溶液中,取混合溶液,分别进行下列实验,能证明SO2与FeCl3溶液发生氧化还原反应的是( )
A.②④ B.④ C.②③④ D.①②③④
17.下列有关叙述正确的是( )
A.“歼﹣20”飞机上大量使用的碳纤维是一种新型的有机高分子材料
B.铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝
C.酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化
D.金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火
18.常温下,将一定量的氯气通入100mL 4ml/L的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
A.当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA
B.当溶液中Na+为0.4 NA时,溶液中的Cl﹣为0.2 NA
C.当电子转移数目为0.2 NA时,溶液质量增加7.1 g
D.当溶液质量增加7.1 g时,溶液中ClO﹣约为0.1 NA
二、填空及简答题(共56分)
(提示:请将答案写于答题卷上!)
19.某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是 .能证明该阴离子是否存在的简单实验操作为____ __.
(2)用离子方程表达下列反应:
①中生成气体A: .②中生成溶液H: .
(3)若②中所用氢氧化钠浓度为2ml/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03ml,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025ml且保持不变,则原溶液中c(Fe2+)
为 ml/L、c(Fe3+)为 ml/L、c(Cl﹣)为 ml/L.(若有些离子不存在,请填0ml/L)
20.(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为 .
(2)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中(约1550℃)下通过下面两个反应共熔得到.
①2Ca3(PO4)2(s)+5C(s)═6CaO(s)+P4(s)+5CO2(g)△H1=+Q1kJ•ml﹣1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣Q2kJ•ml﹣1
写出电炉中发生总反应的热化学方程式 .
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10 10C+P4O10=P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有 .
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2ml NH4Al(SO4)2的溶液,右边充满含3ml Ba(OH)2的溶液,当有2ml SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 .
(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 .
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 .
21.(15分)实验室用如图所示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4.
已知:K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定.
【制备KClO及K2FeO4】
(1)装置C中三颈瓶置于冰水浴中的目的是 .
(2)C中得到足量KClO后将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 .再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品.
(3)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 ml/L KOH溶液中,
② ,③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,用乙醇洗涤的理由____________________ .
⑤在真空干燥箱中干燥.
【测定产品纯度】
(4)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,发生的反应为:Cr(OH)4﹣+FeO42﹣═Fe(OH)3↓+CrO42﹣+OH﹣;过滤后再加稀硫酸调节溶液呈强酸性,此时反应的离子方程式为: .
(5)将(4)反应后的溶液配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 ml/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL.滴定时发生的离子反应为: .
计算该K2FeO4样品的纯度为 .
22.草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为C2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4•2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、C2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)浸出过程中加入Na2SO3的目的是 .
(2)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀.试用离子方程式和必要的文字简述其原理:__________________ .
(3)萃取剂对金属离子的萃取率与pH的关系如右图1.萃取剂的作用是 ;其使用的适宜pH范围是 .
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液= .
(5)已知:NH3•H2O⇌NH4++OH﹣ Kb=1.8×10﹣5;
H2C2O4⇌H++HC2O4﹣ Ka1=5.4×10﹣2;HC2O4﹣⇌H+C2O42﹣ Ka2=5.4×10﹣5
则该流程中所用(NH4)2C2O4溶液的pH 7(填“>”或“<”或“=”)
(6)CC2O4•2H2O热分解质量变化过程如图2所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是______________________________
化学参考答案
1A 2B 3B 4D 5D 6B 7B 8A 9B 10C (每题2分)
11D 12B 13D 14C 15A 16B 17C 18D(每题3分)
第二卷共56分
19.(共14分)(1)Fe3+、Cl﹣ ; 取少量废水试样,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl﹣,若无白色沉淀产生,则不存在 )
(2)① 3Fe2++4H++NO3﹣=3Fe3++NO↑+2H2O ② Al3++4OH﹣=AlO2﹣+2H2O .
(3) 0.15 ; 0.1 ; 0.4
20.(共13分)(Ⅰ)(1) (1分)
(2) (2)2Ca3(PO4)2(s)+6SiO2(s)+5C(s)6CaSiO3(s)+P4(s)+5CO2(g))△H=(Ql﹣6Q2 )kJ•ml﹣1; (3)SiO2 P4O10
(Ⅱ)溶液由浅绿色变红色; 2:3;
(Ⅲ)(1)SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O; (2)Cl﹣、OH﹣、AlO2﹣.
21.(共16分)(1)防止Cl2与KOH反应生成KClO3;
(2)3ClO﹣+2Fe3++10OH﹣═2FeO42﹣+3Cl﹣+5H2O;
(或3ClO﹣+2Fe(OH)3+4 OH﹣═2FeO42﹣+3Cl﹣+5H2O也给分)
(3)过滤; 将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;
K2FeO4易溶于水,防止用水洗涤时晶体损失;
(4)CrO42﹣+2H+⇌H2O+Cr2O72﹣;
(5)Cr2O72﹣+6Fe2++14H+═6Fe3++2Cr3++7H2O; 94.3%.
22.(共13)(1) 还原Fe3+、C3+为Fe2+、C2+ .
(2) 加入的碳酸钠(或CO32﹣)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O⇌R(OH)3+3H+,向右移动,而产生氢氧化物沉淀(直接用用双水解解释也给分)
(3) 除去溶液中的Mn2+ ; B (1分)(4) 0.7 (5) <
(6) C3O4(或CO•C2O3)
(除特殊标注的每空为1分外,其余均为每空2分)
不用注册,免费下载!
化学式
电离常数
CH3COOH
K=1.7×10﹣5
HCN
K=4.9×10﹣10
H2CO3
K1=4.3×10﹣7,K2=5.6×10﹣11
选项
实验操作
实验现象
解释与结论
A
向某溶液中加入BaCl2溶液
有白色沉淀产生
生成了难溶于水的BaSO4,该溶液中一定含有SO42﹣
B
向少量AgNO3溶液中滴加适量NaCl溶液,再滴加少量稀NaI溶液
开始有白色沉淀生成,后有黄色沉淀生成
Ksp(AgI)<Ksp(AgCl)
C
向苯中滴入少量浓溴水,振荡,静置
溶液分层,上层呈橙红色,下层几乎无色
苯和溴水发生取代反应,使溴水褪色
D
向蔗糖中加入浓硫酸
变黑,放热,体积膨胀,放出刺激性气体
浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等
选项
现象或事实
解释
A
用浸有酸性高锰酸钾溶液的硅藻
土作水果保鲜剂
酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯
B
用氢氟酸蚀刻玻璃
SiO2是碱性氧化物,能溶于酸
C
过氧化钠作呼吸面具中的供氧剂
过氧化钠是强氧化剂,能氧化二氧化碳
D
Al(OH)3用作塑料的阻燃剂
Al(OH)3受热熔化放出大量的热
选项
甲物质
乙组中的物质
A
SO2
淀粉碘化钾溶液、氨水、KMnO4溶液、碳酸钠溶液
B
Mg
Cl2、CO2、NH4Cl溶液、NaOH溶液
C
SiO2
碳、NaOH溶液、氢氟酸、Na2CO3
D
稀硫酸
Al(OH)3、碳、Cu2(OH)2CO3、Cu
操作
现象
①
加入NaOH溶液
有红褐色沉淀
②
加入Ba(NO3)2溶液
有白色沉淀
③
加入酸性KMnO4溶液
紫色褪去
④
加入K3[Fe(CN)6](铁氰化钾)溶液
有蓝色沉淀
沉淀物
Fe(OH)3
Al(OH)3
C(OH)2
Fe(OH)2
Mn(OH)2
完全沉淀的pH
3.7
5.2
9.2
9.6
9.8
东北育才学校高三一模化学试题及答案: 这是一份东北育才学校高三一模化学试题及答案,共9页。试卷主要包含了0g草酸中共用电子对数目为0,48 L HF,则转移0,89%等内容,欢迎下载使用。
东北育才学校高三上第一次模拟化学试题及答案: 这是一份东北育才学校高三上第一次模拟化学试题及答案,共6页。试卷主要包含了下列关于胶体的说法不正确的是,4L氨水含有NA个NH3分子等内容,欢迎下载使用。
2024届辽宁省东北育才学校高三上学期二模化学试题: 这是一份2024届辽宁省东北育才学校高三上学期二模化学试题,共11页。











