



浙江省A9协作体2023-2024学年高二上学期期中联考化学试题
展开高二化学试题
考生须知:
1.本卷满分100分,考试时间90分钟;
2.答题时,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填写相应数字;
3.所有答案必须写在答题卷上,写在试卷上无效;
4.考试结束后,只需上交答题卷。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 S:32
选择题部分
一、选择题(本大题共25小题,每小题只有一个正确选项,其中1-20题每小题2分,21-25题每小题3分,共55分)
1.下列物质溶于水促进水的电离且使溶液显酸性的是
A.KHSO3 B.AlCl3 C.NaHSO4 D.H2SO4
2.下列关于化学反应方向的说法正确的是
A.水结冰的过程不能自发进行的原因是熵减的过程,改变条件也不可能自发进行
B.一定条件下,使用催化剂可以使非自发反应变成自发反应
C.反应NH3(g) + HCl(g) ═ NH4Cl(s)在低温下能自发进行,说明该反应的ΔH<0
D.能自发进行的反应一定能迅速发生
3.下列说法正确的是
A.活化分子间所发生的碰撞即为有效碰撞
B.能够发生有效碰撞的分子叫做活化分子,活化分子具有的平均能量叫活化能
C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大
D.升高温度能使化学反应速率增大,是因为增加了反应物中活化分子的百分数
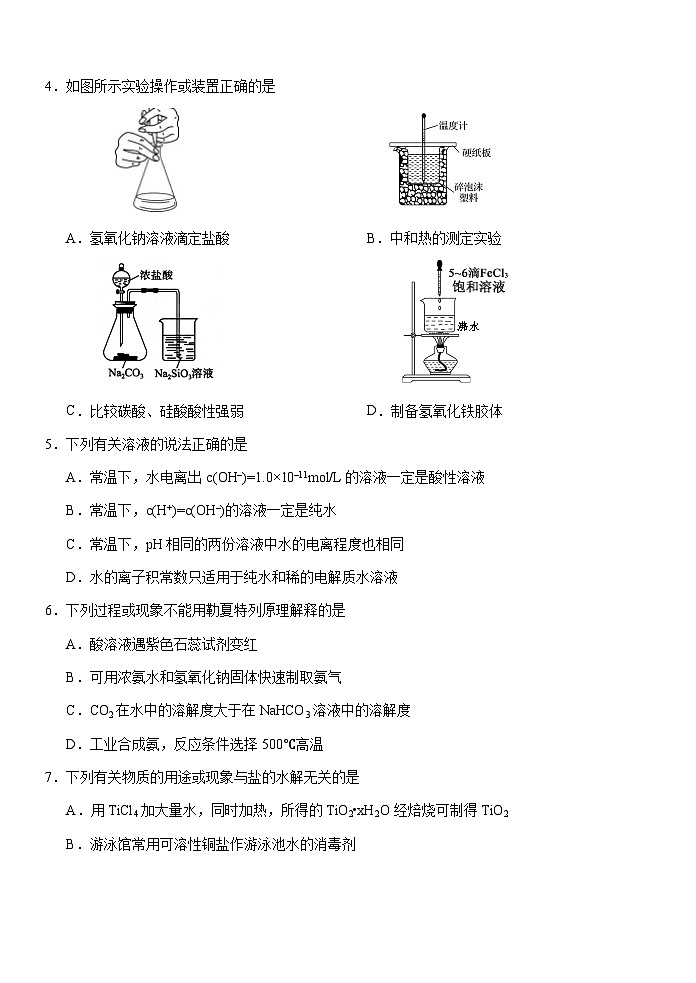
4.如图所示实验操作或装置正确的是
A.氢氧化钠溶液滴定盐酸 B.中和热的测定实验
沸水
C.比较碳酸、硅酸酸性强弱 D.制备氢氧化铁胶体
5.下列有关溶液的说法正确的是
A.常温下,水电离出c(OH–)=1.0×10–11ml/L的溶液一定是酸性溶液
B.常温下,c(H+)=c(OH–)的溶液一定是纯水
C.常温下,pH相同的两份溶液中水的电离程度也相同
D.水的离子积常数只适用于纯水和稀的电解质水溶液
6.下列过程或现象不能用勒夏特列原理解释的是
A.酸溶液遇紫色石蕊试剂变红
B.可用浓氨水和氢氧化钠固体快速制取氨气
C.CO2在水中的溶解度大于在NaHCO3溶液中的溶解度
D.工业合成氨,反应条件选择500℃高温
7.下列有关物质的用途或现象与盐的水解无关的是
A.用TiCl4加大量水,同时加热,所得的TiO2•xH2O经焙烧可制得TiO2
B.游泳馆常用可溶性铜盐作游泳池水的消毒剂
C.实验室中NH4F溶液不能存放于玻璃试剂瓶中
D.氯化铵溶液可做金属焊接中的除锈剂
8.用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,实验过程如图所示,图中各段时间间隔相同,下列说法不正确的是
A.t1~t2段收集的CO2最多,化学反应速率最快
B.用CO2表示t2~t3段的反应速率为v= QUOTE V3–V2t3–t2 L/min
C.t4收集到的气体体积不再增加说明碳酸钙消耗完全
D.从图象中可以推测该反应为放热反应
9.在一个绝热的恒容密闭容器中,发生可逆反应2A(g) + B(g) ⇌ 3C(g) + D(s):①A、B、C、D在容器中共存;②2v正(A)=3v正(C);③体系的气体密度不再改变;④体系的压强不再改变;⑤ΔH不再改变。一定可以作为反应达到平衡状态标志的是
A.①②③⑤B.②④⑤ C.③④ D.③
10.下列有关化学实验的说法不正确的是
A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次
B.中和热测定实验中测量反应混合液的温度时要随时读取温度,记录下最高温度
C.探究温度对Na2S2O3溶液与H2SO4反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,导致所测反应速率偏低
D.将pH试纸置于表面皿上,用玻璃棒蘸取溶液点在pH试纸的中部,与标准比色卡比较测定溶液pH
11.I–可以作为H2O2分解的催化剂,催化机理是:i.H2O2+ I– = H2O + IO–;ii. 。分解反应过程中能量变化如图所示,下列判断正确的是
A.使用催化剂能降低反应活化能,改变反应历程
B.反应速率与I–的浓度无关
C.反应ii为H2O2+IO– ═ H2O+O2↑+I–,反应ⅰ和ⅱ均为放热过程
D.该反应中反应物的总键能大于生成物的总键能
12.下列说法与相关方程式书写均正确的是
A.NaHCO3溶于水会水解:HCO3−+ H2O ⇌ H3O+ + CO32−
B.一定条件下的密闭容器中0.5mlN2与过量H2充分反应,测得放出热量akJ:
N2(g) + 3H2(g) ⇌ 2NH3(g) ΔH= –2akJ·ml-1(a>0)
C.HClO溶液显酸性:HClO + H2O ⇌ ClO– + H3O+
D.硫的燃烧热ΔH=– 315kJ·ml-1,硫燃烧的热化学方程式:
S(g) + QUOTE 32 O2(g) = SO3(g) ΔH= – 315kJ·ml-1
13.25℃时,四种弱电解质的电离平衡常数如下表所示,下列说法正确的是
A.盐酸的导电能力一定比醋酸溶液强
B.次氯酸钠溶液中通入过量的CO2可发生反应2ClO– + CO2 + H2O ═ CO32− + 2HClO
C.体积相同、等pH的CH3COOH、HClO溶液与NaOH溶液中和时两者消耗NaOH的物质的量HClO更多
D.用CH3COOH标准液滴定未知浓度的NaOH溶液选择甲基橙作指示剂,会导致所测c(NaOH)偏小
14.设NA为阿伏加德罗常数的值,下列说法正确的是
A.1.0 L 1.0 ml·L−1 AlCl3溶液中阳离子的数目大于NA
pH=4的醋酸溶液1L,n(H+)<10−4NA
C.100g质量分数为46%的C2H5OH水溶液中含有NA个氧原子
D.1LpH=1的H2SO4溶液中含有H+的数目为0.2NA
15.类比法是化学上研究物质的重要方法之一,下列类比结果正确的是
A.碳酸钙的分解反应是吸热反应,过氧化氢的分解反应也为吸热反应
B.Al3+和S2−混合可以产生氢氧化铝沉淀和硫化氢气体,则Fe3+和S2−混合可以产生氢氧化铁沉淀和硫化氢气体
C.稀硫酸溶液和氢氧化钠溶液完全中和生成1ml水放热57.3kJ,稀硫酸和氢氧化钡溶液完全中和生成1ml水也放热57.3kJ
D.将AlCl3溶液蒸干灼烧后得到Al2O3,则将FeCl3溶液蒸干灼烧后得到Fe2O3固体
16.如图所示为NH4Cl的热循环过程,结合数据计算可得ΔH6(kJ·ml-1)为
A.–2332B.+248C.+876D.–1704
17.已知2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH<0,T℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6mlSO2和3mlO2,乙容器恒温恒容,充入6mlSO3,丙容器恒温恒压,充入6mlSO3,充分反应达到平衡,下列说法正确的是
A.乙中SO3的体积分数大于丙
B.转化率:α甲(SO2)+α乙(SO3)>1
C.乙和丙中的SO2的生成速率:v乙<v丙
D.甲和丙中反应的化学平衡常数:K甲>K丙
18.25℃时,相同体积和pH的CH3COONa、NaCN两种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如图所示,已知:K(CH3COOH)>K(HCN)。下列说法正确的是
A.图中曲线NaY代表的是NaCN溶液
B.上述两种盐原溶液中水电离度大小是NaCN>CH3COONa
C.上述两种盐原溶液中存在:c(CH3COOH)+c(CH3COO–)=c(HCN)+c(CN–)
D.在0.2ml·L-1 NaX溶液中加入等体积0.1ml·L-1的盐酸,所得混合液中存在c(H+)+c(HX)=c(OH-)+c(Cl-)
19.已知颜色深浅(I)与有色物质浓度(c)和观察深度(L)的乘积成正比,在注射器中存在NO2与N2O4的混合物,气体呈棕色,现将注射器的针筒慢慢往外拉,保持温度不变,此时混合物的颜色为
A.从视线1方向观察,气体颜色变深B.从视线2方向观察,气体颜色变深
C.从视线1方向观察,气体颜色没有变化 D.从视线2方向观察,气体颜色变浅
20.温度为T℃时,向体积不等的恒容密闭容器中均充入1ml气体X,发生反应:X(g)⇌Y(g)+Z(g) ΔH,反应相同时间,测得各容器中X的转化率与容器体积的关系如图所示。下列说法正确的是
A.a点对应X的平衡转化率大于40%
B.b、c两点V2:V3=5:9
C.d点有v正=v逆
D.正反应速率v(b)=v(d)
21.下列说法正确的是
A.25℃时,10ml/L的NaOH溶液的pH=15
B.25℃时,pH=10的CH3COONa溶液浓度大于 pH=9的CH3COONa溶液浓度的10倍
C.25℃时,NaX和HX以物质的量之比1:2溶于水得到的溶液pH=7,此时溶液中c(X–):c(HX)≠1:2
D.25℃时,一定浓度的醋酸加水稀释,
c(CH3COO–)c(CH3COOH)的比值和c(CH3COO–)c(H+)的比值均增大
22.已知CO(g) +H2O(g) ⇌ CO2(g) +H2(g) ΔH=– 41.1kJ·ml-1是目前催化制氢的重要方法之一,在T1℃时,将一定量CO与H2O充入恒容密闭的容器中,由实验数据计算得到v正~x(CO)和v逆~x(H2)的关系可用如图表示。下列说法不正确的是
A.若温度升高到某一温度时,再次达到平衡时相应点分别为E、B
B.Kp为以分压表示的平衡常数,分压=总压×物质的量分数,则该反应的Kp约0.075
C.若改变的条件是增大压强,再次达到平衡时相应点与改变条件前相同
D.若改变的条件是使用催化剂,再次达到平衡时相应点与改变条件前不同
23.一定条件下CO与NO反应可实现汽车尾气净化,所涉及的三段反应历程及各物质的相对能量如图所示(TS代表过渡态,IM表示反应过程中的复杂中间产物,每段历程的反应物相对总能量定义为0)。下列说法正确的是
–307.6
A.由反应历程图可判断过渡态的相对能量:TS1>TS3>TS2
B.采用对反应③选择性高的催化剂可以避免尾气中出现N2O
C.反应历程中反应②决定尾气转化的快慢
D.2NO(g) + 2CO(g) ⇌ N2(g) + 2CO2(g) ΔH= – 621.9kJ·ml-1
24.柠檬酸三钠(Na3A)是一种常用食品添加剂。用0.01ml/L盐酸滴定10mL0.01ml/L的柠檬酸三钠溶液,测得溶液电导率与滴加盐酸体积V的关系如图所示,已知:柠檬酸H3A属于三元弱酸,25℃其电离平衡常数的pKa=﹣1gKa,pKa1=3.14,pKa2=4.77,pKa3=6.39。
下列说法正确的是
A.a点代表正盐溶液,c(H+)的数量级为10-9
B.b点溶液显碱性
C.相同浓度的H+与Na+电导率相差不大
D.曲线上任意一点满足:c(Cl–)+ c(H3A)+ c(H2A–)+ c(HA2–)+ c(A3–)= 0.01ml/L
25.下列实验探究方案不能达到探究目的的是
非选择题部分
二、非选择题(本大题共4小题,共45分)
26.(10分)按要求填空:
(1)电解液态水制备1mlO2(g),电解反应的ΔH =+572kJ·ml-1。请写出表示氢气燃烧热的热化学方程式 ▲
(2)有机物M经过太阳光光照可转化成N,转化过程为:
ΔH = +88.6kJ·ml-1。则M、N相比,较稳定的是 ▲ (填“M”或“N”),此反应逆反应活化能E逆=a kJ·ml-1,则正反应活化能为 ▲ (填含a的代数式)kJ·ml-1
(3)K2Cr2O7溶液可通过调节pH改变颜色,原因 ▲ (用离子方程式表示)
(4)已知H3PO2是一种一元酸,写出它的正盐水解的离子方程式 ▲
27.(16分)研究碳、氮及其化合物气体的相关反应对治理大气污染、建设生态文明具有重要意义。请根据化学反应原理回答下列问题:
Ⅰ.在一定条件下焦炭可以还原NO2,反应为:2NO2(g)+2C(s) ⇌ N2(g)+2CO2(g)。
(1)已知:一定条件下,由最稳定的单质生成1ml纯物质的热效应,称为该物质的生成焓(ΔH)。
则2NO2(g)+2C(s) ⇌ N2(g)+2CO2(g) ΔH = ▲ kJ·ml-1,提高NO2平衡转化率可采取的措施是 ▲ (答出两种即可)。
(2)在恒温条件下,1mlNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示(不考虑2NO2 ⇌ N2O4):
①关于该反应,下列有关说法正确的是 ▲
A.使用更高效的催化剂可进一步提高原料的平衡转化率
B.从平衡混合气体中分离出CO2,逆反应速率先减小后增大
C.恒容下平衡后再加入少量NO2气体,平衡正向移动,NO2的转化率增大
D.恒压下平衡后,通入稀有气体平衡不移动
②a、b两点的反应速率关系为v(a) ▲ v(b)(填“>”、“<”或“=”);a、c两点的浓度平衡常数关系:Kc(a) ▲ Kc(c)(填“<”、“>”或“=”);a、b、c三点中NO2的转化率最高的是 ▲ (填“a”、“b”或“c”)点。
③计算c点时该反应的压强平衡常数Kp = ▲ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.治理汽车尾气中NO和CO污染的一种方法是将其转化为无害的CO2和N2,反应如下:
2NO(g) +2CO(g) ⇌ N2(g) + 2CO2(g)。一定温度下将2 ml NO、1 ml CO充入1 L固定容积的容器中,反应过程中各物质浓度变化如图所示。若保持温度不变,20 min时再向容器中迅速充入CO、N2各0.6 ml,请在图中画出第20min~30min图中三种物质浓度随时间的变化曲线,并标注气体名称。
28.(11分)某化学学习小组为测定草酸晶体的纯度,用托盘天平称取草酸晶体(H2C2O4•2H2O)样品wg;配制成250mL溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10ml/L酸性高锰酸钾溶液滴定;滴定实验重复操作2-3次.已知:①MnO4−在酸性环境下的还原产物是Mn2+;②草酸是二元弱酸。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程式为 ▲
(2)滴定时,将酸性KMnO4标准液装在如图中的 ▲ (填“甲”或“乙”)滴定管中;若滴定开始和结束时,滴定管中的液面如图所示,则所用酸性KMnO4标准液的体积为 ▲ 。
滴定终点的现象为 ▲
若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为 ▲ (用含w、V的表达式表示)
(5)下列操作中可能使所测草酸晶体纯度偏低的是 ▲ (填字母)。
A.滴定管未用标准液润洗就直接注入KMnO4标准液
B.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
C.滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
29.(8分)平衡思想是化学研究的一个重要观念,电解质水溶液中存在电离平衡、水解平衡、溶解平衡。常温下,向1 L 0.1 ml/L H2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图:
(1)在0.1ml·L-1的Na2A溶液中,下列粒子浓度关系式正确的是 ▲ ;(2分)
A.c(A2–)+c(HA–)+c(H2A)=0.1ml·L-1
B.c(Na+)>c(A2–)>c(HA–)>c(OH–)>c(H+)
C.c(Na+)+c(H+)=c(OH–)+c(HA–)+2c(A2–)
D.c(Na+)=2c(A2–)+2c(HA–)
(2)已知0.1ml·L-1NaHA溶液的pH=2,则0.1ml·L-1H2A溶液中氢离子的物质的量浓度可能是 ▲ 0.11ml·L-1(填“<”“>”或“=”),理由是 ▲ 。
(3)25℃时,将a ml·L-1的氨水与0.01 ml·L-1的盐酸等体积混合,若混合后溶液的pH=7,
用含的代数式表示NH3·H2O的电离常数Kb= ▲ 。化学式
H2CO3
CH3COOH
HClO
电离平衡常数
Ka1=4.5×10–7
Ka2=4.7×10–11
1.75×10–5
4.0×10–8
实验
实验探究方案
探究目的
A
甲、乙两支试管中分别加入10mL0.01ml/LFeCl3溶液,向甲试管中加入少量FeCl3晶体,观察溶液颜色变化
反应物浓度对水解平衡的影响
B
向NaHCO3溶液中加入NaAlO2溶液,观察现象
比较AlO2–和CO32–结合H+的能力
C
向滴有酚酞的Na2CO3溶液中,加入少量BaCl2固体,观察溶液颜色变化
验证Na2CO3溶液中存在水解平衡
D
用pH计测量相同浓度NaClO溶液与CH3COONa的pH,比较两溶液的pH大小
比较次氯酸和醋酸酸性强弱
物质
N2(g)
CO2(g)
NO2(g)
生成焓(ΔH)/kJ·ml-1
0
–393.5
+33.2
浙江省A9协作体2023-2024学年高一上学期期中联考化学试题(Word版附解析): 这是一份浙江省A9协作体2023-2024学年高一上学期期中联考化学试题(Word版附解析),共17页。试卷主要包含了考试结束后,只需上交答题卷,可能用到的相对原子质量,5NA, 下列离子方程式正确的是等内容,欢迎下载使用。
浙江省A9协作体2023-2024学年高二上学期期中联考化学试题(Word版附答案): 这是一份浙江省A9协作体2023-2024学年高二上学期期中联考化学试题(Word版附答案),共10页。试卷主要包含了考试结束后,只需上交答题卷,下列有关溶液的说法正确的是等内容,欢迎下载使用。
2024浙江省A9协作体高二上学期期中联考化学试题含答案: 这是一份2024浙江省A9协作体高二上学期期中联考化学试题含答案,文件包含浙江省A9协作体2023-2024学年高二上学期期中联考化学试题docx、浙江省A9协作体2023-2024学年高二上学期期中联考化学答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。












