



新高考化学一轮复习精品课件 第6章 第30讲 原子结构 核外电子排布规律 (含解析)
展开考点一 原子结构、核素、同位素
考点二 核外电子运动状态与排布原理
真题演练 明确考向
原子结构、核素、同位素
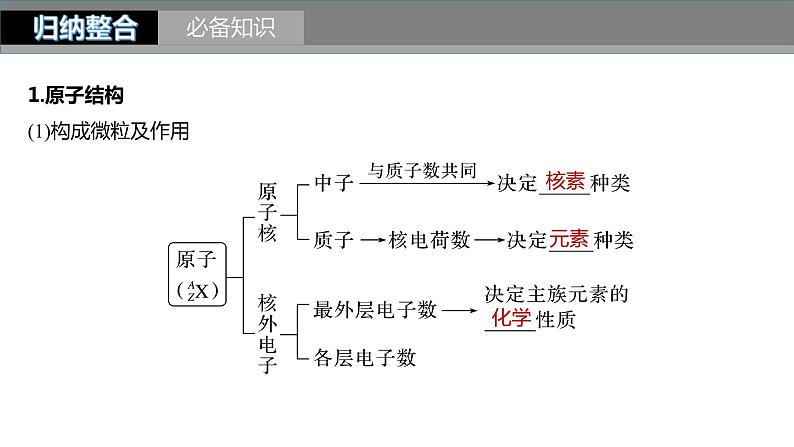
1.原子结构(1)构成微粒及作用
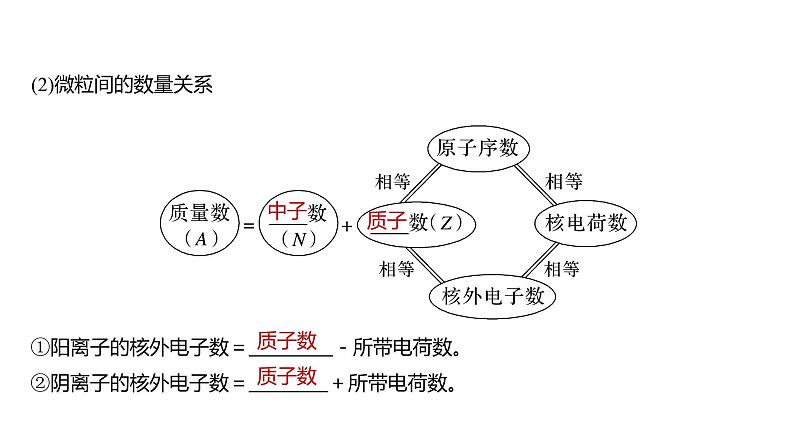
(2)微粒间的数量关系
①阳离子的核外电子数= -所带电荷数。②阴离子的核外电子数= +所带电荷数。
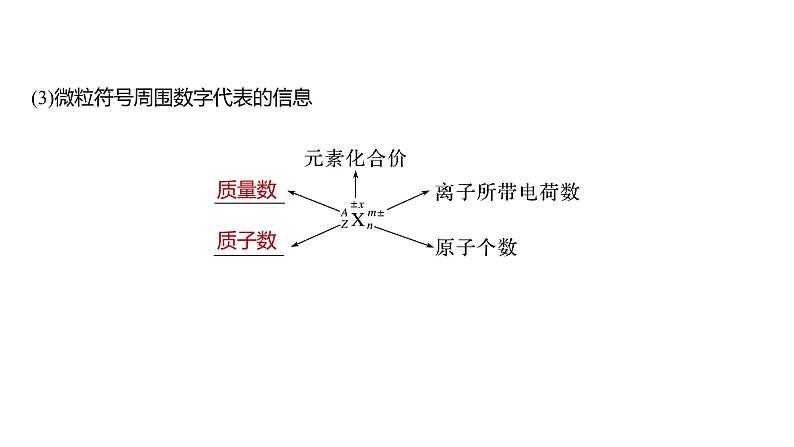
(3)微粒符号周围数字代表的信息
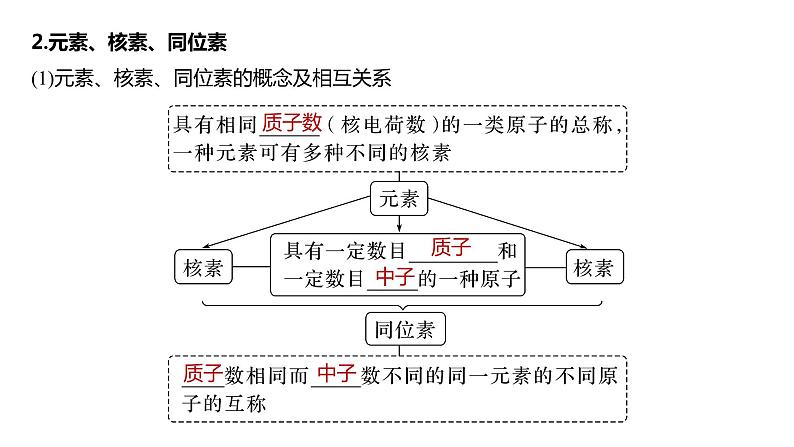
2.元素、核素、同位素(1)元素、核素、同位素的概念及相互关系
(2)同位素的特征①同一元素的各种核素的 不同, 相同,化学性质 ,物理性质 。②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
(3)氢元素的三种核素 :名称为 ,不含中子; :用字母 表示,名称为 或重氢; :用字母 表示,名称为_____或超重氢。
(4)几种重要核素的用途
1.一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子( )2.所有原子核内一定都有中子( )3.质量数就是元素的相对原子质量( )4.质子数相同的微粒一定属于同一种元素( )5.核外电子数相同的微粒,其质子数一定相同( )6.核聚变如 ,因为有新微粒生成,所以该变化是化学变化( )7.氢的三种核素形成的单质有6种,它们物理性质有所不同,但化学性质几乎完全相同( )
一、微粒中“粒子数”的确定
不能确定核素的原子百分含量,因此不能计算氦元素的近似相对原子质量,B错误;
(2)已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则w g R原子完全转化为R2-时,含有电子的物质的量是__________________。
二、元素、核素、同位素的概念辨析
(2)互为同素异形体的微粒是___________。
(4)上述9种微粒中有________种核素,含有________种元素。
核外电子运动状态与排布原理
1.核外电子运动状态核外电子按能量不同分成能层,同一能层的电子,还被分成不同能级。量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道。
回答下列问题:(1)填写下表,熟悉原子核外能层、能级、原子轨道之间的关系。
(2)常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向。s电子云轮廓图呈____形、p电子云轮廓图呈______形。p电子云有____种伸展方向。(3)预测第五电子层上原子轨道总数是多少?最多能容纳的电子数是多少?
(4)比较下列基态原子能级或原子轨道的能量高低。①1s、2s、2p、3s、3p、3d ②2s、2px、2py、2pz
答案 ①1s<2s<2p<3s<3p<3d ②2s<2px=2py=2pz
2.基态与激发态 原子光谱(1)基态原子:处于 的原子。激发态原子:基态原子吸收能量,它的电子会 到较高能级,变为激发态原子。(2)原子光谱不同元素原子的电子发生跃迁时会 或 不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱上的特征谱线可以鉴定元素,称为光谱分析。
3.原子核外电子排布的规范书写(1)排布原则① :在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
② :在一个原子轨道里,最多只能容纳 个电子,它们的自旋 。如2s轨道上的电子排布为 ,不能表示为 。
③ :基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。 如2p3的电子排布为_____________,不能表示为 或 。
注意 当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如基态24Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,而不是1s22s22p63s23p63d44s2。
(2)填充顺序——构造原理
(3)基态原子核外电子排布表示方法(以硫原子为例)
1.p能级能量不一定比s能级的能量高( )2.Fe的基态原子的电子排布式为1s22s22p63s23p64s23d6( )3.22Ti的电子排布式1s22s22p63s23p10违反了能量最低原理( )4. 表示的原子能量处于最低状态( )5.1s22s12p1表示的是激发态原子的电子排布( )6.某些金属及其化合物在燃烧时会产生特殊的颜色,是由于电子跃迁时能量以一定频率的光释放出来( )
1.完成下列各小题:(1)基态硅原子最外层电子的轨道表示式为___________________。(2)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__________(填离子符号)。(3)铜或铜盐的焰色试验为绿色,该光谱是___________(填“吸收光谱”或“发射光谱”)。
一、核外电子的运动状态及排布式的书写
2.下列Li原子轨道表示式表示的状态中,能量最低和最高的分别为________、________(填字母)。A. B. C. D.
根据核外电子排布规律可知Li的基态原子核外电子排布式为1s22s1,则D中能量最低;选项C中有2个电子处于2p能级上,能量最高。
3.钾发生焰色试验的原因是_____________________________________________________________________________。
电子由较高能量的激发态跃迁到较低能量的激发态或基
态时,以光的形式释放能量
(1)在书写基态原子的轨道表示式时,常出现以下错误:① (违反能量最低原理);② (违反泡利原理);③ (违反洪特规则);④ (违反洪特规则)。(2)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2,而失电子时,却先失4s轨道上的电子,如Fe3+:1s22s22p63s23p63d5。
4.判断电子的运动状态按要求填空:(1)基态F原子核外电子的运动状态有______种。
二、核外电子排布规律的应用
基态F原子共有9个核外电子,则每个电子都有对应的轨道和自旋状态,所以核外电子的运动状态有9种。
(2)基态钛原子的价层电子排布式为________,其原子核外电子的空间运动状态有________种,共有________种运动状态不同的电子。
基态Ti原子核外电子排布式为1s22s22p63s23p63d24s2,价层电子排布式为3d24s2;s轨道有一种空间运动状态,p轨道有三种空间运动状态,d轨道有五种空间运动状态,3d轨道只有两个电子,有两种空间运动状态,因此基态Ti原子的核外电子的空间运动状态有12种;核外有22个电子,就有22种运动状态。
(3)基态Si原子价层电子的运动状态有______种,若其电子排布式表示为违背了__________。(4)基态Cu原子核外电子的空间运动状态有_____种。
基态Cu原子核外电子排布式为[Ar]3d104s1,基态Cu原子核外有几个轨道,其核外电子就有几种空间运动状态,则基态Cu原子核外电子的空间运动状态有1+1+3+1+3+5+1=15种。
核外电子运动状态的判断
电子的运动状态与原子核外电子数目相等;空间运动状态与核外电子填充原子轨道的数目相等。
5.判断原子中未成对电子数目按要求填空:(1)基态Ti3+中未成对电子数有_____个;与Ti同族相邻的元素Zr的基态原子价层电子排布式为________。与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有____种。
Ti位于第四周期,Ti基态原子未成对电子数是2,与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有Ni、Ge、Se。
(2)血红蛋白中的铁处于基态时,其最高能级中的单电子数为______。(3)Cr与Ni的基态原子核外未成对电子数之比为________。
基态铬原子价层电子排布式为3d54s1,核外有6个未成对电子,基态镍原子价层电子排布式为3d84s2,核外有2个未成对电子,则铬与镍的基态原子核外未成对电子数之比为3∶1。
(4)第四周期中未成对电子数最多的基态原子的价层电子轨道表示式为_________________________________。(5)2020年12月17日,“嫦娥五号”首次成功实现地外天体采样返回,标志着我国航天向前迈出了一大步。其制作材料中包含了Al、Cr、Cu、C、N、O、Si等多种元素。上述元素中基态原子未成对电子数与Al相同的有________。
Al的核外电子排布式为1s22s22p63s23p1,有1个未成对电子,Cr、Cu、C、N、O、Si中只有Cu(价层电子排布:3d104s1)基态原子未成对电子数与Al相同。
(6)氨硼烷(NH3BH3)的制备是当今科学研究的重要课题,可用反应B(OCH3)3+NH4Cl+LiAlH4===NH3BH3+Al(OCH3)3+LiCl+H2↑进行制备。反应中涉及元素的基态原子中含1个未成对电子的有_____种。
6.元素推断(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________;其基态原子价层电子的轨道表示式为___________________。(2)E元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子,E的元素符号为________,其基态原子的核外电子排布式为______________________________________。(3)元素D的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的核外电子排布式为_________________________________。
1s22s22p63s23p63d104s1
(或[Ar]3d104s1)
1s22s22p63s23p63d64s2(或[Ar]3d64s2)
2.(2021·辽宁,2)下列化学用语使用正确的是A.基态C原子价层电子排布图: B.Cl-结构示意图: C.KCl形成过程:
基态C原子价层电子排布图为 ,A错误;Cl-结构示意图为 ,B错误;KCl形成过程为 ,C错误。
3.(2020·山东等级模拟考,4)某元素基态原子4s轨道上有1个电子,则该基态原子价层电子排布不可能是A.3p64s1 B.4s1 C.3d54s1 D.3d104s1
基态原子4s轨道上有1个电子,在s区价层电子排布式为4s1,在d区价层电子排布式为3d54s1,在ds区价层电子排布式为3d104s1,在p区不存在4s轨道上有1个电子,故A符合题意。
5.按要求解答下列问题。(1)[2020·全国卷Ⅱ,35(1)]基态Ti原子的核外电子排布式为____________________________________。(2)[2019·全国卷Ⅰ,35(1)]下列状态的镁中,电离最外层一个电子所需能量最大的是_____(填字母)。A.[Ne] B.[Ne] C.[Ne] D.[Ne]
(3)[2020·全国卷Ⅰ,35(1)]基态Fe2+与Fe3+离子中未成对的电子数之比为________。
1s22s22p63s23p63d24s2
(或[Ar]3d24s2)
1.三星堆见证了中华文明起源的多样性,通过“14C测定法”初步确定其年代区间。下列有关说法正确的是A.14C与12C互为同位素B.14C的核外电子数是14C.14C可由中子轰击14N产生,14C与14N的化学性质相同D.青铜器皿、骨头、纺织品、灰烬等都可作为检测的样品
2.钍是一种放射性金属元素,有钢灰色光泽,质地柔软,化学性质较活泼,广泛分布在地壳中。230Th和232Th是钍的两种同位素,232Th可以转化成233U,因此它是潜在的核燃料。下列有关Th的说法正确的是A.Th元素的质量数是232B.Th元素的相对原子质量是231C.232Th转换成233U是化学变化D.230Th和232Th的化学性质相同
Th有质量数为230、232的两种核素,不能说Th元素的质量数为232,A项错误;元素的相对原子质量是由各种同位素的相对原子质量与其在自然界中的百分含量求得的平均值,B项错误;232Th转换成233U,不是化学变化,C项错误;同位素的物理性质差异较大,但化学性质几乎完全相同,D项正确。
3.在宾馆、办公楼等公共场所,常使用一种电离式烟雾报警器,其主体是一个放有镅-241( )放射源的电离室。 原子核内中子数与核外电子数之差是A.241 B.146 C.95 D.51
的质子数为95,质量数为241,中子数=241-95=146,核外电子数=质子数=95,中子数与核外电子数之差为146-95=51。
4.某元素的一种核素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,a g HmX中所含质子的物质的量是
5.下列有关构造原理的说法错误的是A.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3dB.某基态原子部分核外电子的排布式为3d64s2C.所有基态原子的核外电子排布都遵循构造原理D.构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序
绝大多数基态原子的核外电子排布都遵循构造原理,但也有少数例外,如Cu,故C错误;构造原理中电子填入能级的顺序即各能级能量由低到高的顺序,故D正确。
6.下列关于原子结构、原子轨道的说法正确的是A.N能层中有4s、4p、4d、4f四个能级,共16个轨道,可容纳32种运动状态的电子B.在K能层中,有自旋相反的两条轨道C.s电子绕核运动,其轨道为球面,而p电子在哑铃形曲面上运动D.电子云通常是用小黑点来表示电子的多少
N能层中有4s、4p、4d、4f四个能级,各具有1、3、5、7个轨道,每个轨道最多可容纳2个电子,故可容纳32个电子,所以有32种运动状态,A正确;在K能层中,只有1个轨道,能容纳自旋相反的2个电子,B不正确;电子云通常是用小黑点来表示电子出现的机会多少,但小黑点不表示电子,D不正确。
7.第四周期元素中基态原子核外有3个未成对电子的共有A.2种 B.3种 C.4种 D.5种
第四周期元素中基态原子核外有3个未成对电子的共有3种,分别是V(3d34s2)、C(3d74s2)、As(4s24p3),故选B。
8.下列轨道表示式所表示的元素原子中,其能量处于最低状态的是
A. B. C. D.
原子处于基态时能量最低,A项,Be原子的2s轨道未排满电子,2p轨道排布1个电子,应为激发态,错误;B项,N原子核外电子排布不符合洪特规则,错误;C项,B原子的2s轨道未排满电子,2p轨道排布2个电子,应为激发态,错误;D项,碳原子的1s和2s轨道全部排满电子后,2p轨道排布2个电子,核外电子排布符合能量最低原理,应是基态碳原子,正确。
9.下列说法正确的是A.最外层电子排布式为ns2的基态原子所对应元素一定位于第ⅡA族B.d区元素的原子一定都有d轨道电子C.最外层电子排布式为ns1的基态原子所对应元素一定是金属元素D.基态原子价层电子排布式为nsnnpn的元素一定是金属元素
最外层电子排布式为ns2的基态原子所对应元素不一定位于第ⅡA族,可能位于副族或0族,如副族的Zn或0族的He,故A错误;d区元素的基态原子都含有d轨道电子,故B正确;最外层电子排布式为ns1的基态原子所对应元素不一定是金属元素,如H,故C错误;基态原子价层电子排布式为nsnnpn的元素,s能级上最多排列2个电子,则n=2,所以该原子价层电子排布式为2s22p2,为C元素,是非金属元素,故D错误。
10.人们通常将在同一原子轨道上运动、自旋相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是
1s22s22p63s23p6中未成对电子数为0;1s22s22p63s23p63d54s2中未成对电子数为5;1s22s22p63s23p63d54s1中未成对电子数为6;1s22s22p63s23p63d104s1中未成对电子数为1。
B.X、Y均可形成三氯化物C.X的质子数大于Y的D.Y仅有一种含氧酸
由守恒关系可知元素X的质量数为27,X与Y最外层电子数之和为8,质子数相差2,且X为金属元素,可推知X为Al元素,Y为P元素,二者都有+3价,都可以形成三氯化物,A项错误,B项正确;Al原子质子数为13,P原子质子数为15,故质子数:X
由题意知:A元素原子的L层比B元素原子的L层少3个电子,A原子核外电子总数比B原子核外电子总数少5,那么肯定是B原子M层上多了2个电子,而且A元素原子的L层未排满,所以得两者的原子结构示意图,A: 、B: ,即A为N,B为Mg,A、B构成Mg3N2,即B3A2。
13.在短周期元素中,元素的基态原子核外未成对电子数等于能层序数的元素有a种,元素的基态原子最外层电子数是未成对电子数2倍的元素有b种,则 的值为A.1 B.2 C.3 D.4
第一周期中原子核外未成对电子数为1的元素有H,第二周期中原子核外未成对电子数为2的元素有C和O,第三周期中原子核外未成对电子数为3的元素有P,符合条件的元素共有4种,即a=4。符合基态原子最外层电子数是未成对电子数2倍的元素,其基态原子的最外层电子数是2、4、6或8,若最外层电子数为2,则是He、Be或Mg,但这三种元素无未成对电子,不符合题意;若最外层电子数为4,则是C、Si,符合题意;若最外层电子数为6,则是O、S,最外层有2个未成对电子,最外层电子数是未成对电子数的3倍,不符合题意;若最外层电子数为8,则是Ne、Ar,但这两种元素均无未成对电子,不符合题意,则符合题意的元素共有2种,即b=2。
14.现有部分元素的原子结构特点如下表所示:
(1)画出G原子结构示意图: _________。(2)元素X与元素Z相比,非金属性较强的是______(填元素名称),写出一个能表示X、Z非金属性强弱关系的化学方程式: ______________________________________。
2H2S+O2===2H2O+2S↓(答案合理即可)
(3)X、Y、Z、G四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为___________。
X元素原子的L层电子数是K层电子数的3倍,根据核外电子排布规律,可知L层为6个电子,所以X为氧元素;Y元素原子的核外电子层数等于原子序数,Y只能是氢元素;Z元素原子的L层电子数是K层和M层电子数之和,L层有8个电子,K层有2个电子,则其M层电子数为6,所以Z是硫元素;G元素原子的最外层电子数是次外层电子数的2.5倍,其次外层只能是K层,有2个电子,所以G为氮元素。H、N、O、S四种非金属元素形成的离子化合物只能是铵盐,其水溶液显强酸性,则应是强酸的酸式盐,故应为NH4HSO4。
(4)元素X和元素Y以原子个数比为1∶1形成的化合物Q,元素G和元素Y化合形成的化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的,且在自然界中稳定存在的物质,写出该反应的化学方程式:__________________________________。
H和O按原子个数比1∶1形成的化合物为H2O2,共有18个电子,则H和N形成的18电子微粒只能是N2H4,根据信息写出化学方程式即可。
15.(1)①基态Cu原子有______种不同能级的电子。②N原子中最高能级的电子的电子云轮廓图为_________。③在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是__________________________________________________________________________________________________。
电子排布式为3d6,而Fe3+的价层电子排布式为3d5,为半充满稳定结构,故FeO稳定性小于Fe2O3
(2)元素X位于第四周期,其基态原子有4个未成对电子,基态X2+的价层电子排布式是_____;X3+的价层电子排布式为________。
第四周期元素中,未成对电子数为4的元素为Fe。
2024届高考化学一轮复习原子结构 核外电子排布规律课件: 这是一份2024届高考化学一轮复习原子结构 核外电子排布规律课件,共60页。PPT课件主要包含了专项突破,归纳整合,p轨道,d轨道,f轨道,为什么等内容,欢迎下载使用。
第28讲 原子结构 核外电子排布规律-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第28讲 原子结构 核外电子排布规律-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共47页。PPT课件主要包含了复习目标,同位素,考点一,易错辨析,考点二,真题演练等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第5章 第26讲 原子结构 核外电子排布规律: 这是一份2024年高考化学一轮复习课件(鲁科版)第5章 第26讲 原子结构 核外电子排布规律,文件包含第5章第26讲原子结构核外电子排布规律pptx、第5章第26练原子结构核外电子排布规律docx、第5章第26讲原子结构核外电子排布规律docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












