



新高考化学一轮复习精品课件 第3章 第10讲 仪器的组合与创新使用 (含解析)
展开考点一 一器多用与多器一用
考点二 实验中常见仪器或装置的创新设计
答题规范(2) 装置的气密性检查
真题演练 明确考向
考点三 气体体积的测定
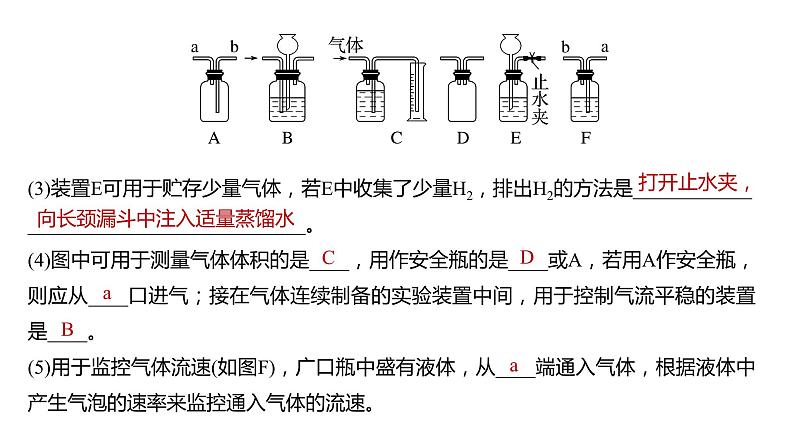
1.用途多变的广口瓶回答下列问题:
(1)收集气体:可选用装置____(填装置字母,下同),若用排空气法收集CO2,则应从___口进气;若收集氢气,则应从___口进气;若瓶中装满饱和食盐水,从___口进气,可收集Cl2。(2)洗气除杂或干燥:可选装置____,比如除去Cl2中的少量HCl,则广口瓶中盛放___________,应从____口进气。
(3)装置E可用于贮存少量气体,若E中收集了少量H2,排出H2的方法是________________________________________。(4)图中可用于测量气体体积的是____,用作安全瓶的是____或A,若用A作安全瓶,则应从____口进气;接在气体连续制备的实验装置中间,用于控制气流平稳的装置是____。(5)用于监控气体流速(如图F),广口瓶中盛有液体,从____端通入气体,根据液体中产生气泡的速率来监控通入气体的流速。
向长颈漏斗中注入适量蒸馏水
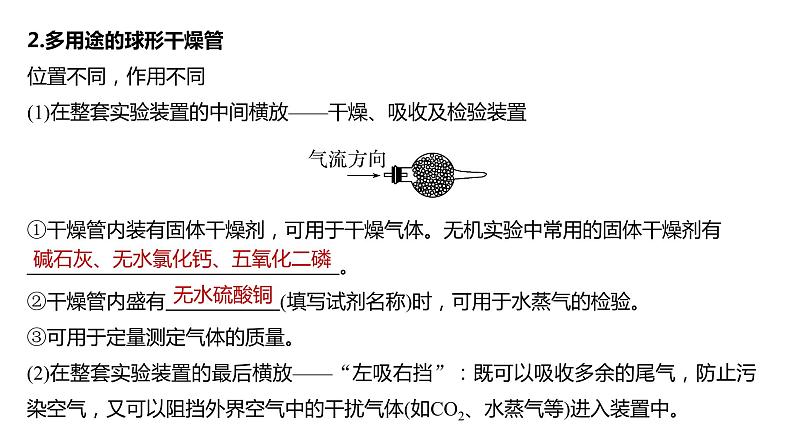
2.多用途的球形干燥管位置不同,作用不同(1)在整套实验装置的中间横放——干燥、吸收及检验装置
①干燥管内装有固体干燥剂,可用于干燥气体。无机实验中常用的固体干燥剂有 。②干燥管内盛有 (填写试剂名称)时,可用于水蒸气的检验。③可用于定量测定气体的质量。(2)在整套实验装置的最后横放——“左吸右挡”:既可以吸收多余的尾气,防止污染空气,又可以阻挡外界空气中的干扰气体(如CO2、水蒸气等)进入装置中。
碱石灰、无水氯化钙、五氧化二磷
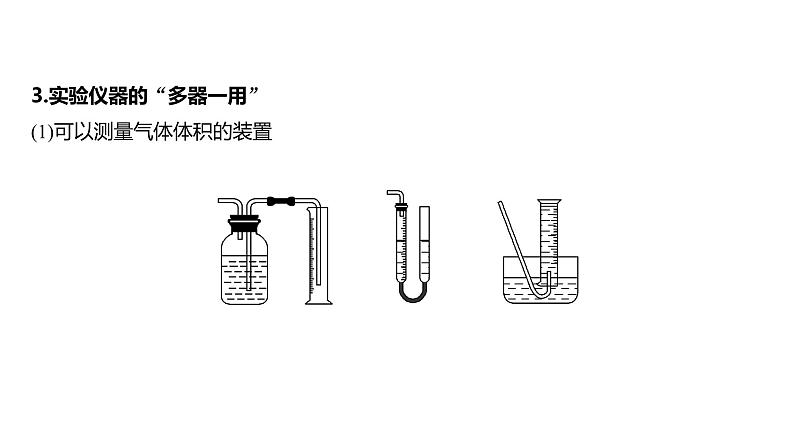
3.实验仪器的“多器一用”(1)可以测量气体体积的装置
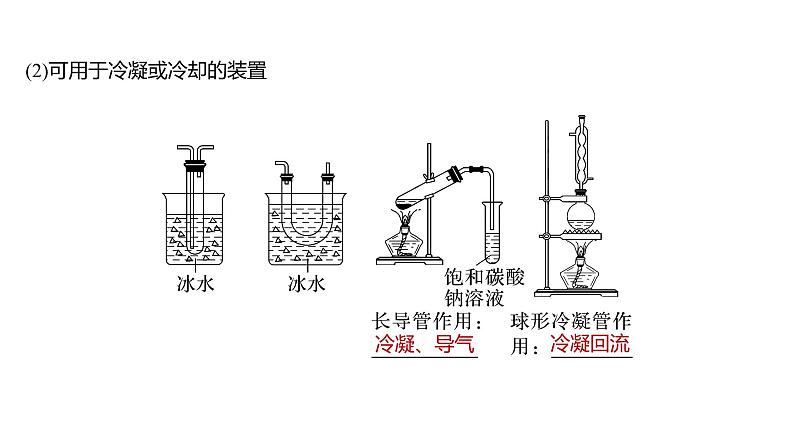
(2)可用于冷凝或冷却的装置
(3)可用于气体干燥或除杂的装置
1.用如图所示装置进行下列实验,能达到实验目的的是A.瓶中盛有适量浓硫酸,从A口进气来干燥NH3B.从B口进气,用排空气法收集CO2C.瓶中装满水,从B口进气,用排水法收集NO2D.瓶中装满水,A口连接导管并伸入量筒中,从B口进气,用排水法测量生成H2的 体积
A项,NH3能与浓硫酸反应,不能用浓硫酸干燥NH3;B项,用向上排空气法收集CO2时,应从A口进气;C项,NO2与H2O反应,不能用排水法收集;D项,H2难溶于水,从B口通入H2,能将瓶中的水压入量筒中,进入量筒中水的体积即为H2的体积。
2.过氧化钙(CaO2)是一种白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,溶于酸。利用反应Ca2++H2O2+2NH3+8H2O===CaO2·8H2O↓+ 制备过氧化钙,装置如图所示。
按要求回答问题。(1)W的作用是_________,写出反应的化学方程式:____________________________________________。(2)仪器X的名称为__________,其作用是__________________________。(3)温水浴可以加快反应速率,但在实验中为什么采取冰水浴?______________。
+2NH3↑+2H2O
导气,并防止发生倒吸现象
实验中常见仪器或装置的创新设计
A.该装置中的干燥管可用于 ,原理类似于倒置在水中的 。B.简易的 装置,如净化天然水。C.简易的启普发生器,其优点为 。
可控制反应的发生和停止
①已知有以下几种气体发生原理a.CaCO3+2HCl===CaCl2+H2O+CO2↑b.Na2CO3+2HCl===2NaCl+H2O+CO2↑
d.Zn+H2SO4===ZnSO4+H2↑
2.多种仪器的创新使用(1)控制反应发生和停止的装置
可利用甲、乙装置来制备的气体发生原理有 (填字母)。以甲为例叙述此类装置控制反应发生和停止的原理:_______________________________________________________________________________________________________________________________________________________________________________________________。②对于丙装置,若想反应发生,可采取的操作是 ,若想停止反应,可采取的操作是 。
当需要反应发生时,打开止水夹,
向长颈漏斗内注入液体试剂而与多孔隔板上块状固体药品接触,反应开始;当需要停止反应时,关闭止水夹,液体在气压作用下被压回到长颈漏斗内,固液分离,反应停止
将Cu丝上提,使之与浓硝酸分离
橡胶管a的作用是 ,在定量测量气体体积时还可以 ,支管b也具备平衡气压的作用。
平衡气压,便于液体顺利流下
①简述装置乙防倒吸的原理:_____________________________________________ 。②能否用苯代替CCl4: (填“能”或“否”)。
HCl不溶于CCl4,会从CCl4层中逸出被水层吸收,
导管口附近气压不会减小,不会引起倒吸
①实验室制取Cl2时,尾气的处理可采用b装置。②制取CO时,尾气处理可采用a、c装置。③制取H2时,尾气处理可采用a、c装置。
1.草酸晶体(H2C2O4·2H2O)100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)
试管口向上倾斜,水倒流进试管,会使试管底炸裂,故A错误;加热固体来制取气体,应选择试管,不能选择锥形瓶,故B错误;草酸熔点低,在分解之前就熔化,C装置熔化的草酸会流到试管口,而酒精加热部位在试管底部,会使样品无法继续受热分解,故C错误;该装置解决了受热过程中产生水以及样品熔化流动的这两个问题,草酸晶体100 ℃开始失水,试管口应略向下倾斜,故D正确。
2.已知HCl难溶于CCl4,则如下图所示装置中,不适宜用于HCl气体尾气吸收的是
3.用分液漏斗和烧杯可以组装成一套简易的、能随开随用、随关随停的气体发生装置,如图所示。能用此装置制备的气体有________(填字母)。a.用锌粒与稀硫酸反应制取H2b.用过氧化钠与水反应制取O2c.用二氧化锰与浓盐酸反应制取Cl2d.用铜片与浓硝酸反应制取NO2
4.下图给出了干燥管的不同应用,请回答下列问题:
(1)图甲所示的干燥管可作为气体干燥装置,下列组合中气体a和固体R均正确的是_____(填字母)。
甲作为干燥装置,固体R必须能吸收水,且不与气体a发生反应。B中浓硫酸为液体干燥剂;C中的高锰酸钾不仅不易吸收水,还与乙烯反应;D中的碱石灰虽然能吸收水,但也能与Cl2反应。
(2)甲装置还可以作为特殊情况下的气体发生装置。例如,在常温下可用此装置来制备空气中的某种单质气体,此时气体a为______,固体R为_______。
甲作为制气装置,要求反应原理是在常温下某气体与固体反应产生气体,中学阶段熟悉的反应是二氧化碳与过氧化钠反应制取氧气。
(3)若按图乙来组装,可用NaOH浓溶液吸收Cl2,制“84”消毒液,此时干燥管的作用是__________。
气体体积的测定既可通过测量气体排出的液体体积来确定(二者体积值相等),也可直接测量收集的气体体积。测量气体体积的常用方法:
(1)直接测量法。如图A、B、C、D、E均是直接测量气体体积的装置。A装置测量前可先通过调整左右两管的高度使左管(有刻度)充满液体,且两管液面相平。C装置则是直接将一种反应物置于倒置的漏斗中,另一反应物置于水槽中,二者反应产生的气体可以直接测量。D装置用于测量混合气体中被吸收(或不被吸收)的气体的体积。读数时,球形容器和量气管液面相平,量气管内增加的水的体积等于被反应管吸收后剩余气体的体积。
解答该量气装置读数时的答题模板:①将××××恢复至室温。②调节×××与×××两端液面相平。③视线与×××在同一水平线上。E装置直接测量固液反应产生气体的体积,注意应恢复至室温后,读取注射器中气体的体积(一般适合滴加液体量比较少的气体体积的测量)。(2)间接测量法。如F装置是通过测量气体排出的液体体积来确定气体体积。
1.用镁带和稀硫酸反应产生氢气来测定氢气的气体摩尔体积,所用的步骤有①冷却至室温;②调节使水准管和量气管液面持平;③读数。正确的顺序是A.①②③ B.①③②C.③①② D.③②①
因为生成气体的体积需要用排出的水的体积衡量,而镁带和稀硫酸的反应是放热反应,反应前后量气管的温度不同,因此,反应后应先将待测体系恢复到室温,再将量气管上下移动以调节量气管内的液面与水准管一致,此时量气管内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为①②③。
2.欲测定金属镁的相对原子质量,请利用下图给定的仪器组成一套实验装置(每个仪器只能使用一次,假设气体的体积可看作标准状况下的体积)。
回答下列问题(气流从左到右):(1)各种仪器连接的先后顺序是____接____、____接____、____接____、____接____(用小写字母表示)。
根据实验目的及各装置的特点分析可知:利用装置A中的水压将E中稀盐酸压至B中,产生的气体通过将D中的水排入C中测量其体积,所以连接顺序为a→h→g→b→c→f→e→d。
(2)连接好仪器后,要进行的操作有以下几步,其先后顺序是____________(填序号)。①待仪器B中的温度恢复至室温时,测得量筒C中水的体积为Va mL;②擦掉镁条表面的氧化膜,将其置于天平上称量,得质量为m g,并将其投入试管B中的多孔塑料板上;③检查装置的气密性;④旋开装置A上分液漏斗的活塞,使其中的水顺利流下,当镁完全溶解时再关闭这个活塞,这时A中共放入水Vb mL。
(3)根据实验数据可算出金属镁的相对原子质量,其数学表达式为______________。
由题意知:Mg ~ H2M 22.4 LM (Va-Vb)×10-3 L
(4)若试管B的温度未冷却至室温,就读出量筒C中水的体积,这将会使所测定镁的相对原子质量数据_______(填“偏大”“偏小”或“无影响”)。
由于试管B未冷却至室温,会导致Va变大,所以使Mg的相对原子质量偏小。
装置的气密性检查必须在放入药品之前进行。(1)气密性检查的基本思路使装置内外压强不等,观察气泡或液面变化。(2)气密性检查的答题规范简答题应注意答题规范,对装置的气密性检查可按如下文字进行答题:①装置形成封闭体系→操作(微热、手捂、热毛巾捂、加水等)→描述现象→得出结论。②微热法检查的关键词是封闭、微热、气泡、水柱。③液差(封)法的关键词是封闭、液差。④答题时易忽略的关键性的文字叙述:a.将导管末端浸入水中;b.关闭或者开启某些气体通道的活塞或弹簧夹;c.加水至“将长颈漏斗下口浸没”。
1.观察下面a~f六种装置,补充完整检查气密性的操作和现象:
(1)微热法:如图a。用手捂热或用酒精灯微热试管,导管口__________,松开手或停止加热后导管内______________,证明装置不漏气。
(2)液差法:如图b、c。连接好仪器,b中夹紧弹簧夹,从长颈漏斗中注入适量水,使b中长颈漏斗中的液面______锥形瓶中的液面,静置,若__________________,证明装置不漏气。c中从乙管加入适量水,使乙管液面_______甲管液面,静置,若液面______________,证明装置不漏气。(3)滴液法:如图d。向分液漏斗中注入适量水,关闭弹簧夹,打开分液漏斗活塞,水在下端形成一段水柱,如果________________________________,则证明装置气密性良好。
一段时间后,水柱的水位不会下降
(4)抽气(吹气)法:如图e、f。e中关闭分液漏斗的活塞,轻轻向外拉动或向里推动注射器的活塞,一段时间后,活塞__________________,证明装置的气密性良好。f中打开弹簧夹,向导管口吹气,如果长颈漏斗中的液面________,且停止吹气后,夹上弹簧夹,长颈漏斗液面__________,则证明装置的气密性良好(液差法的拓展)。
2.为了检查如图所示某有机合成装置的气密性,甲、乙两位同学进行以下操作和方案设计。(1)甲同学认为,用微热法便可检查装置气密性是否良好。经检验方案可行,则甲同学检查装置气密性的操作方法、现象和结论是____________________________________________________________________________________________________________________________________________。
将e导管下端管口浸入盛水的烧杯中,关闭b的活塞,打开a处止水夹,微热d,若e导管口有气泡冒出,冷却至室温后,又有一段水柱上升,证明气密性良好
(2)乙同学认为只需关闭a处止水夹,打开b的玻璃活塞,观察液体能否顺利滴下便可检查其气密性是否良好,该同学的方案可行吗?________(填“可行”或“不可行”),并解释原因:__________________________________________。
无论气密性是否良好,b中的液体均能顺利滴下
1.(2022·湖北,6)下列实验装置(部分夹持装置略)或现象错误的是
碳酸钠和碳酸氢钠都会因水解而使溶液显碱性,碳酸钠的碱性强于碳酸氢钠,滴入酚酞溶液后,碳酸钠溶液呈红色,碳酸氢钠溶液呈浅红色,A正确;食盐水为中性,铁钉发生吸氧腐蚀,试管中的气体减少,导管中形成一段水柱,B正确;钠燃烧温度在400 ℃以上,玻璃表面皿不耐高温,故钠燃烧通常用坩埚或者燃烧匙,C错误。
2.(2020·江苏,5)实验室以CaCO3为原料,制备CO2并获得CaCl2·6H2O晶体。下列图示装置和原理不能达到实验目的的是
A对,碳酸钙与稀盐酸反应可制备CO2,且为固液常温型反应,装置也正确;B对,CO2密度比空气大,可以用向上排空气法收集;C对,分离固体与液体,可采用过滤的方法;D错,CaCl2·6H2O晶体可以通过蒸发浓缩、冷却结晶、过滤的方法制得,采用蒸发结晶法易导致CaCl2·6H2O失去结晶水。
3.(2021·天津,15)某化学小组同学利用一定浓度的H2O2溶液制备O2,再用O2氧化C2H5OH,并检验氧化产物。Ⅰ.制备O2该小组同学设计了如下气体发生装置(夹持装置省略)
(1)甲装置中主要仪器的名称为__________________。(2)乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1,经长颈漏斗向试管中缓慢加入3% H2O2溶液至___________________。欲使反应停止,关闭活塞K1即可,此时装置中的现象是_________________________________________________。
试管内的H2O2溶液被压入
长颈漏斗中,与MnO2分离
(3)丙装置可用于制备较多O2,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是______________。
(4)丙装置的特点是______(填序号)。a.可以控制制备反应的开始和结束b.可通过调节催化剂与液体接触的面积来控制反应的速率c.与乙装置相比,产物中的O2含量高、杂质种类少
用双氧水和催化剂制取氧气。制得的氧气经干燥后进入盛有乙醇的圆底烧瓶中,和热的乙醇一起进入硬质玻璃管中,在铜的催化作用下发生乙醇的催化氧化反应生成乙醛。生成的乙醛进入试管中,被冷凝收集。
催化剂铂丝可上下移动,可以控制制备反应的开始和结束,a正确;催化剂与液体接触的面积越大,反应速率越快,b正确;
丙装置用圆底烧瓶盛装H2O2溶液,与乙装置相比,可用于制备较多O2,但产物中的O2含量和杂质种类和乙中没有区别,c错误。
Ⅱ.氧化C2H5OH该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)(5)在图中方框内补全干燥装置和干燥剂。
氧气可以用浓硫酸干燥,所以可以用一个洗气瓶,里面盛装浓硫酸干燥氧气,如图 。
Ⅲ.检验产物(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
实验①~③中的结论不合理的是_____(填序号),原因是__________________________________。
乙醇也能使酸性KMnO4
实验①不合理,因为乙醇有挥发性,会混入生成的乙醛中,乙醇也能使酸性高锰酸钾溶液褪色。
1.广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种功能的装置。下列装置能用作防倒吸安全瓶的是
A项,该装置是排液量气装置,错误;B项,该装置可作为防倒吸安全瓶,因为进气管较短(刚漏出瓶塞),若发生倒吸,倒吸液会被盛装在广口瓶中,不会再倒流到前一装置,从而防止倒吸,正确;C项,该装置是混气装置,进入瓶中的两气体在瓶中充分混合,错误;D项,该装置是洗气装置,错误。
2.按如图装置通入X气体,并在管口P处点燃,实验结果是澄清石灰水变浑浊,则X、Y可能是A.H2和Fe2O3B.CO和CuOC.H2和Na2CO3D.CO和Na2CO3
澄清石灰水变浑浊,说明X气体与Y反应后的产物之一为二氧化碳,结合示意图分析得出B项符合题意。
3.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
A.甲装置:可用来证明碳酸的酸性比硅酸强B.乙装置:橡胶管的作用是使盐酸顺利流下C.丙装置:不能用来测定NH3的体积D.丁装置:从①口进气,可收集二氧化碳,从②口进气,可收集氢气
植物油能隔离氨气与水,可以将水排出,可以测定氨气的体积,C错误;导管长进短出可收集密度比空气大的气体,导管短进长出可收集密度比空气小的气体,则从①口进气,可收集二氧化碳,从②口进气,可收集氢气,D正确。
4.下述实验设计能够达到实验目的的是
该装置可用于吸收易溶于碱溶液的气体,并可防倒吸,A项正确;酸碱中和滴定需用酸碱指示剂确定滴定终点,且NaOH溶液应用碱式滴定管盛放,B项错误;NO2易溶于水且与水反应生成NO,不能用排水法收集NO2,C项错误;蒸干溶液不能使用坩埚,且FeCl2在加热条件下水解生成Fe(OH)2,且Fe2+在空气中易被氧化成Fe3+,蒸发灼烧最后得到Fe2O3,不能得到无水FeCl2,D项错误。
5.用下列装置进行实验(部分夹持仪器已省略),不能达到实验目的的是
A.用甲装置制备并收集NH3B.用乙装置进行NH3的喷泉实验C.用丙装置制取少量乙酸乙酯D.用丁装置制取氢氧化亚铁
氯化铵受热分解生成氨气和HCl,但在试管口两者会反应生成氯化铵,因此不能达到实验目的,故A符合题意;氨气极易溶于水,胶头滴管中的水挤出,烧瓶中压强急速减小,打开止水夹,烧杯中的水进入到烧瓶中形成喷泉,能达到实验目的,故B不符合题意;
乙酸和乙醇在浓硫酸、加热条件下反应生成乙酸乙酯,再用饱和碳酸钠溶液接收,因此丙装置能制取少量乙酸乙酯,故C不符合题意;先打开止水夹K,产生的氢气排出装置内的空气,右边抽滤瓶中收集到的氢气纯净后,夹紧止水夹,左边压强增大,液体会压入到右边反应生成氢氧化亚铁,能达到实验目的,故D不符合题意。
6.下列装置能达到实验目的的是
A项,除杂质时应从长管进气且应用NaOH等强碱性溶液;D项,会产生倒吸现象。
7.用如图所示实验装置进行相应的实验,能达到实验目的的是
A.用甲装置进行已知浓度的NaOH溶液滴定未知浓度的硫酸B.用乙装置收集NO2气体C.用丙装置制备气体并对生成的气体体积进行测量,可以减小误差D.用丁装置构成铜锌原电池
NaOH溶液应该装在碱式滴定管中,故A错误;NO2气体的密度大于空气,则应从长导管进气,故B错误;橡胶管可以平衡气压,便于液体顺利流下,对生成的气体体积进行测量可以减小误差,故C正确;丁装置中Zn电极直接与硫酸铜发生反应,不能构成原电池,锌电极区应为硫酸锌溶液,铜电极区应为硫酸铜溶液,故D错误。
8.用如图装置(加热及夹持仪器已略去)进行的实验,不能达到相应实验目的的是
A.装置①中分液漏斗内的液体可顺利滴入蒸馏烧瓶B.装置②可实现制取CO2实验中“即关即止,即开即用”的作用C.利用装置③制取SO2,并验证其还原性D.利用装置④验证KHCO3和K2CO3的热稳定性,X中应放的物质是K2CO3
装置①中橡胶管能使烧瓶内压强与分液漏斗上部的压强相等,从而使液体顺利滴下,故A不符合题意;装置②关闭止水夹时,产生的CO2将盐酸压入左侧,大理石与盐酸分离,反应停止,打开止水夹时,CO2气体排出,压强减小,盐酸又流回右侧与大理石反应产生CO2,故B不符合题意;
装置③大试管中Cu与浓硫酸反应生成SO2气体,若小试管中酸性KMnO4溶液褪色,则证明SO2具有还原性,故C不符合题意;装置④中KHCO3受热不稳定,X中应放的物质是KHCO3,故D符合题意。
9.Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是A.玻璃管的作用是连通大气,使空气中的氧气进入 广口瓶,参与反应B.c、d两根导管都必须插入BaCl2溶液中接近洗气瓶 底部的位置,保证气体与Ba2+充分接触C.Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀D.e、f两管中的试剂可以分别是浓氨水和NaOH固体
该实验的目的是探究SO2与BaCl2溶液反应生成BaSO3沉淀的条件,根据“强酸制弱酸”原理,若两种物质直接混合,不能得到BaSO3沉淀,若溶液显碱性,SO2转化为 ,则可得到
BaSO3沉淀。因为装置甲和乙都产生气体,会使试剂瓶内的压强增大,玻璃管的作用是使试剂瓶内的压强保持和外界压强相等,A错误;若装置乙产生NH3,NH3极易溶于水,直接插入溶液中易引起倒吸,B错误;
装置乙中装入浓氨水和氢氧化钠固体可产生NH3,可使SO2与BaCl2反应生成BaSO3,D正确。
10.关于下列各装置图的叙述不正确的是
A.装置①可验证HCl气体在水中的溶解性B.装置②可用于收集H2、NH3、Cl2、HCl、NO2、NO等C.装置③中X为四氯化碳,可用于吸收氨气或氯化氢D.装置④可用于干燥、收集氨气,并吸收多余的氨气
装置①中HCl易溶于水,滴入水后气球膨胀,A项正确;装置②中,左边长导管进气,可收集密度比空气大的气体,如Cl2、HCl、NO2等,右边短导管进气,可收集密度比空气小的气体,如H2、NH3等,但NO不能用排空气法收集,B项不正确;
四氯化碳的密度比水大,四氯化碳在下层,氨气或氯化氢不溶于四氯化碳,可以防止倒吸,C项正确;氨气的密度比空气小,可用向下排空气法收集,也可用碱石灰干燥,且多余的氨气可通过倒扣的漏斗用水吸收,D项正确。
11.用下列实验装置进行相关实验,能达到实验目的的是
A.用甲装置接收石油分馏实验中所得的馏分B.用乙装置测量H2O2的分解速率C.用丙装置制取并观察Fe(OH)2沉淀D.用丁装置测量用MnO2和浓盐酸共热制得Cl2的体积
甲装置为密闭装置,蒸馏时气体压强增大,可能引起爆炸等事故,故A错误;用乙装置进行实验时,反应产生的氧气会从长颈漏斗中逸出,故B错误;丙装置无法使生成的硫酸亚铁溶液与氢氧化钠溶液混合,不能制取氢氧化亚铁沉淀,故C错误;
氯气在饱和食盐水中的溶解度小,丁装置可以根据排出液体的量测量生成氯气的体积,故D正确。
12.某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如下装置(含试剂)进行实验。下列说法不正确的是A.必须在②③间添加吸收HCl的装置B.④的作用是防止空气中的气体影响实验 的精确度C.通入空气的作用是保证②中产生的气体 完全转移到③中D.称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度
氢氧化钡足量,挥发出的HCl先被吸收,不会影响BaCO3沉淀的生成和测定,无需单独添加吸收HCl的装置,故A项错误;碱石灰可与二氧化碳反应,可吸收水分,可防止空气中的气体影响实验的精确度,故B项正确;
根据③中沉淀的质量计算碳酸钠的纯度,故需要通入空气,保证②中产生的二氧化碳完全转移到③中被充分吸收,减小实验误差,故C项正确;
③中产生的沉淀为碳酸钡,根据碳酸钡的质量可计算生成二氧化碳的质量,再根据生成二氧化碳的质量计算样品中碳酸钠的质量,根据称取样品的质量即可求算碳酸钠固体的纯度,故D项正确。
13.下列装置中,不添加其他仪器无法检查气密性的是
B项,利用液差法:夹紧止水夹,从长颈漏斗中向试管内加水,长颈漏斗中会形成一段液柱,停止加水后,通过观察液柱高度是否变化即可检查;C项,利用加热(手捂)法:用酒精灯微热(或用手捂热)试管,通过观察烧杯中导管口有无气泡以及导管中液柱是否变化即可检查;D项,利用抽气法:向外轻轻拉动注射器的活塞,通过观察浸没在液体中的导管口是否有气泡冒出即可检查。
14.(2022·天津河东区模拟)FeCl2可用作净水剂、还原剂等,回答下列问题:制备FeCl2:装置如图所示(加持装置省略);已知FeCl2极易水解。
(1)仪器a的名称是__________。
(2)装置二中制备FeCl2的化学方程式是_____________________________;装置三的作用①_____________________;②____________________________________________。
吸收装置二产生的HCl
防止空气中的水蒸气进入装置二引起
装置一中产生了H2,故装置二中制备FeCl2的化学方程式是2FeCl3+H2 2FeCl2+2HCl。
(3)该装置存在一定的缺陷,可在_____位置(填“A”“B”或“C”)增加如下装置。如下装置中气体从_____(填“a”或“b”)流入;洗气瓶中盛装的是________。
该装置的缺陷为生成的H2会带出来水蒸气进入装置二造成FeCl2水解,应在A位置加一个干燥装置,如装有浓硫酸的洗气瓶。
15.ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应:2NaClO2+Cl2===2ClO2+2NaCl。下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中F中盛有CCl4液体(用于除去ClO2中未反应的Cl2)。解答下列相关问题:(1)装置A中导管a的作用是____________________________。
2024年高考化学一轮复习化学仪器的创新使用课件: 这是一份2024年高考化学一轮复习化学仪器的创新使用课件,共22页。
2024年高考化学一轮复习课件(鲁科版)第10章 第63讲 仪器的组合与创新使用: 这是一份2024年高考化学一轮复习课件(鲁科版)第10章 第63讲 仪器的组合与创新使用,文件包含第10章第63讲仪器的组合与创新使用pptx、第10章第63练仪器的组合与创新使用docx、第10章第63讲仪器的组合与创新使用docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮复习(新高考版) 第3章 第10讲 仪器的组合与创新使用: 这是一份2024年高考化学一轮复习(新高考版) 第3章 第10讲 仪器的组合与创新使用,文件包含2024年高考化学一轮复习新高考版第3章第10讲仪器的组合与创新使用pptx、2024年高考化学一轮复习新高考版第3章第10讲仪器的组合与创新使用docx、第3章第10讲仪器的组合与创新使用docx、第3章第10练仪器的组合与创新使用docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












