





鲁科版 (2019)第3节 氧化还原反应教学课件ppt
展开1.认识有化合价变化的反应是氧化还原反应,了解氧化还原反应的本质是电子转移。2.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
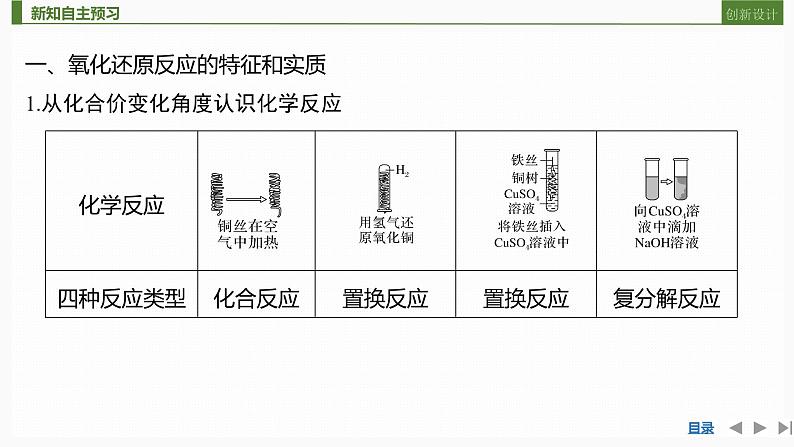
一、氧化还原反应的特征和实质1.从化合价变化角度认识化学反应
2.氧化还原反应的特征
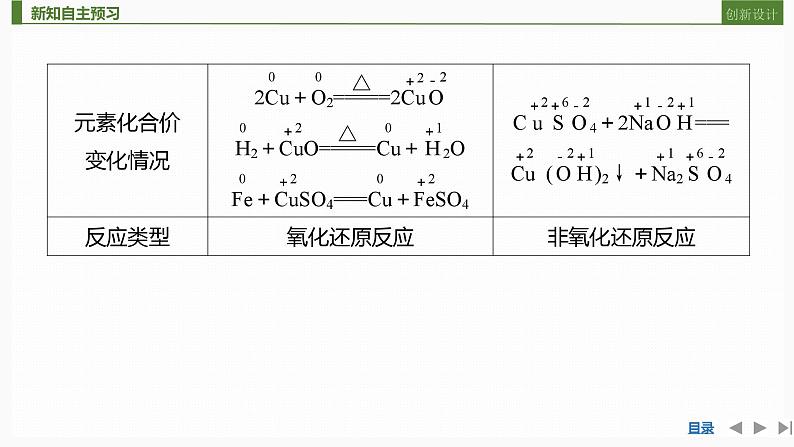
CuO失去氧变成了铜,铜元素化合价______,发生了______反应,H2得到氧生成H2O,氢元素化合价______,发生了______反应。(1)氧化还原反应:在反应过程中有元素化合价变化的化学反应。(2)氧化还原反应的特征:反应中物质所含____________发生变化。
(3)氧化反应与还原反应:①氧化反应:在氧化还原反应中,反应物所含某种(或某些)元素化合价______的反应。②还原反应:在氧化还原反应中,反应物所含某种(或某些)元素化合价______的反应。
3.氧化还原反应的实质
(2)以Fe+CuSO4===Cu+FeSO4为例。
【微自测】1.下列描述中,正确的打“√”,错误的打“×”。
(1)CaO+H2O===Ca(OH)2属于氧化还原反应( )(2)Na和H2O的反应是氧化还原反应( )(3)氧化还原反应的特征是元素化合价发生变化( )(4)只要是氧化还原反应,一定存在电子的转移( )
二、氧化还原反应中电子转移的表示方法
1.双线桥法:表示同种元素的原子在反应前后转移电子的情况。例如:
2.单线桥法:表示反应过程中电子在反应物之间的转移情况。例如:
【微自测】2.下列描述中,正确的打“√”,错误的打“×”。
二、双线桥表示法与单线桥表示法
一、氧化还原反应的相关概念
1.氧化还原反应相关概念的关系
2.氧化还原反应的实质与特征
3.氧化还原反应中对立统一的关系
(1)化合价有升高和降低。(2)电子有得到和失去。(3)有氧化反应和还原反应。
4.氧化还原反应与四种基本反应类型之间的关系
元素由化合态转变为游离态不一定被氧化,也可能被还原。如HCl转化为Cl2,氯元素被氧化,CuO转化为Cu,铜元素被还原。
1.(2021·云南丽江高一月考)下列关于氧化还原反应的说法中正确的是( )
A.化合反应都是氧化还原反应B.有元素化合价升降的反应是氧化还原反应C.复分解反应一定是氧化还原反应D.有氯气参加的反应,氯气只能发生氧化反应
解析 在化合反应中不一定有元素化合价的变化,故不一定是氧化还原反应,故A错误;在复分解反应中一定没有元素化合价的变化,一定不是氧化还原反应,故C错误;有氯气参加的反应,氯气既可发生氧化反应又可发生还原反应,如Cl2溶于NaOH溶液时发生的反应中,氯气既发生了氧化反应又发生了还原反应,故D错误。
2.(2021·河北保定高一月考)下列反应进行分类时,既属于氧化还原反应,又属于化合反应的是( )
答案 A C D E B、C、D D、E
解析 A项,属于化合反应,无单质参加反应,故属于非氧化还原反应;B项,不属于四种基本反应类型,有元素化合价变化,属于氧化还原反应;C项,属于分解反应,有单质生成,故属于氧化还原反应;D项,属于置换反应,故属于氧化还原反应也属于离子反应;E项,属于复分解反应,属于非氧化还原反应,属于离子反应。
1.双线桥表示法(1)书写的基本步骤
(2)注意事项①箭头、箭尾必须对应化合价变化的同种元素的原子;②必须注明“得到”或“失去”;③被还原的物质和被氧化的物质得、失电子数守恒。
(3)巧记口诀先标化合价,再看价变化;起止同元素,桥上标变化。
2.单线桥表示法(1)书写的基本步骤
(2)注意事项①不需要标明“得到”或“失去”,只标明电子转移数目;②要用箭头标明电子转移的方向;③箭头由反应物中失电子元素原子指向得电子元素原子。如
4.下列电子转移的表示方法中正确的是( )
解析 A项Fe2O3被还原、CO被氧化;B项不用“+、-”号表示;正确的应为得到3e-×2,失去2e-×3,D项正确。
5.下列反应中电子转移的方向和数目表示正确的是( )
解析 A、D选项,单线桥上方不用写“失去”或“得到”;B选项,氧元素失电子,锰元素得电子,电子转移的方向表示错误;C选项,箭头的指向及电子转移的总数均正确。
1.我们生活在千变万化的物质世界里。下列变化中,没有发生氧化还原反应的是( )
解析 钢水浇铸是物理变化。
2.下列关于氧化还原反应的说法正确的是( )
A.肯定一种元素被氧化,另一种元素被还原B.某元素从化合态变成游离态,该元素一定被还原C.在反应中不一定所有元素的化合价都发生变化D.在氧化还原反应中非金属单质一定是被还原
解析 氧化还原反应可能发生在同种元素之间,A项错误;元素从化合态变成游离态,化合价可能升高也可能降低,B项错误;只要有元素化合价发生变化,即发生了氧化还原反应,不一定所有元素的化合价都发生变化,C项正确;非金属元素既有正价又有负价,单质反应过程中化合价可能升高也可能降低,不能确定被氧化还是被还原。
3.下列氧化还原反应中,电子转移的方向和数目均正确的是( )
解析 A项中应转移12e-;C项中得到电子、失去电子标反了;D项中得失电子数不相等。
4.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
解析 氧化反应的特征是元素化合价升高。SO2→Na2SO3,硫元素、氧元素的化合价均没有变化,SO2未发生氧化反应,A项错误;CuO→Cu,铜元素的化合价由+2价降低到0价,发生还原反应,B项错误;Fe→FeCl2,铁元素的化合价由0价升高到+2价,发生氧化反应,C项正确;HCl→H2,氢元素的化合价由+1价降低到0价,发生还原反应,D项错误。
5.(1)分析下列反应的化学方程式是否属于氧化还原反应,属于氧化还原反应的用双线桥法标出电子转移的方向和数目。
1.(2021·四川绵阳中高一月考)以下日常生活中许多现象与氧化还原反应有关,下列现象与氧化还原反应无关的是( )
A.轮船底部生锈B.充有H2的“喜羊羊”气球遇明火发生爆炸C.大理石雕像被酸雨腐蚀毁坏D.铜质奖章上出现铜绿[Cu2(OH)2CO3]
解析 轮船底部生锈,铁与氧气发生氧化还原反应,A错误; 充有H2的“喜羊羊”气球遇明火发生爆炸,氢气与氧气发生氧化还原反应,B错误; 大理石雕像被酸雨腐蚀毁坏,碳酸钙与酸发生复分解反应,无化合价变化,C正确; 铜质奖章上出现铜绿[Cu2(OH)2CO3],铜单质与氧气、二氧化碳、水发生氧化还原反应,D错误。
2.下列反应属于氧化还原反应的是( )
3.钛(Ti)被称为铁、铝之后的第三金属,以下是由TiO2制Ti的主要反应:
4.(2021·河北元氏第四中学高一月考)下列关于氧化还原反应与四种基本反应类型的关系,说法正确的是( )
A.化合反应都是氧化还原反应B.有单质生成的分解反应一定是氧化还原反应C.有一些置换反应不是氧化还原反应D.有氧元素参与的复分解反应是氧化还原反应
解析 化合反应不一定为氧化还原反应,如氨气和氯化氢的反应,故A错误;有单质生成的分解反应,元素的化合价一定发生变化,属于氧化还原反应,故B正确;置换反应有单质参与,元素的化合价一定发生变化,属于氧化还原反应,故C错误; 复分解反应元素化合价一定不发生变化,故复分解反应一定不是氧化还原反应,故D错误。
5.(2021·广东揭阳第三中学高一段考)不属于氧化还原反应的是( )
6.(2021·河北元氏第四中学月考) 下列氧化还原反应发生在同种元素之间的是( )
解析 Zn、H元素的化合价变化,故A不选; 只有S元素的化合价变化,则氧化还原反应发生在同种元素之间,故B选; Cu、H元素的化合价变化,故C不选;H、O元素的化合价变化,故D不选;故选B。
7.(2021·北京第四十三中学高一上学期月考)下列反应中属于非氧化还原反应的是( )
8.(2021·山东济宁曲阜市第一中学高一上学期月考)下列单、双线桥的表示方法不正确的是( )
解析 AlN中N元素为-3价,A项正确;Al2O3在反应中元素化合价没有发生变化,B项错误;上述反应中氮的化合价降低,被还原,发生还原反应,C项错误;因为有电子的转移才有元素化合价的变化,而不是有元素化合价的变化才有电子的转移,D项错误。
10.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2;2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中得到电子B.KClO3被氧化C.H2C2O4在反应中被还原D.1个KClO3参加反应有2个电子转移
解析 A.Cl元素的化合价由+5价降低为+4价,故KClO3在反应中得到电子,故A正确;B.Cl元素的化合价由+5价降低为+4价,被还原,故B错误;C.C元素的化合价由+3价升高到+4价,被氧化,则H2C2O4在反应中被氧化,故C错误;D.因反应中Cl元素的化合价由+5价降低为+4价,则1个KClO3参加反应有1个电子转移,故D错误。
11.用双线桥法标出下列氧化还原反应的电子转移情况,并按要求填空。XC
(1)上述反应中,_____元素的化合价升高,则该元素的原子______(填“得到”或“失去”)电子;而______元素的化合价降低,该元素发生______反应。(2)用“双线桥法”表示反应中电子转移的方向和数目。___________________________________。
解析 在上述反应中铝元素由0价变为+3价,化合价升高,失去电子,被氧化;氮元素由+5价变为0价,化合价降低,得到电子,被还原。
13. (双选)下列物质在给定条件下的转化均不涉及氧化还原反应的是( )
解析 四氧化三铁与CO反应生成铁和二氧化碳,铁元素化合价降低、碳元素化合价升高发生氧化还原反应。铁与盐酸反应生成氯化亚铁和氢气,铁元素化合价升高、氢元素化合价降低发生氧化还原反应,均涉及氧化还原反应,A不符合题意; 双氧水受热分解生成水和氧气,氧元素化合价既有升高又有降低,发生氧化还原反应;氧气与氢气反应生成水,氧元素化合价降低、氢元素化合价升高,发生氧化还原反应,均涉及氧化还原反应,B不符合题意; 氢氧化钙与二氧化碳反应生成碳酸钙和水,碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,两反应中均无元素化合价发生变化,均不涉及氧化还原反应,C符合题意; 硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠、氢氧化铜受热分解生成氧化铜和水,两反应中均无元素化合价发生变化,均不涉及氧化还原反应,D符合题意。
14. (双选)下列说法中正确的是( )
A.氧化还原反应必定有氧元素参加反应B.Na2O2与CO2的反应为氧化还原反应C.氧化还原反应过程中所有元素的化合价均有变化D.1 ml Fe参加化学反应时,转移的电子数不一定是3 ml
解析 氧化还原反应过程中必有电子的转移,但不一定有氧元素参加,A项错误;Na2O2与CO2反应生成了O2,氧元素的化合价有变化,该反应是氧化还原反应,B项正确;氧化还原反应过程中不一定所有元素化合价均有变化,C项错误;1 ml Fe参与化学反应时,转移的电子数不一定是3 ml,如Fe+2H+===Fe2++H2↑,1 ml Fe参加反应,转移2 ml电子。
15.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。
制备ClO2有下列两种方法:方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式:_________________________________________;(2)方法二中被氧化的物质是________,若反应中有0.1 ml电子转移,则产生的ClO2气体在标准状况下的体积为________L;在下面的化学方程式上用单线桥标出电子转移的方向和数目:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
鲁科版 (2019)必修 第一册第3节 氧化还原反应教学ppt课件: 这是一份鲁科版 (2019)必修 第一册第3节 氧化还原反应教学ppt课件,共45页。PPT课件主要包含了知识网络,学业基础,3结论,②④⑥⑦⑧⑩,核心素养,①书写步骤,学考评价等内容,欢迎下载使用。
高中鲁科版 (2019)第2章 元素与物质世界第3节 氧化还原反应示范课课件ppt: 这是一份高中鲁科版 (2019)第2章 元素与物质世界第3节 氧化还原反应示范课课件ppt,文件包含4氧化还原反应pptx、1氧化还原反应pptx、3氧化还原反应pptx、2氧化还原反应pptx等4份课件配套教学资源,其中PPT共56页, 欢迎下载使用。
鲁科版必修1综合复习图片ppt课件: 这是一份鲁科版必修1综合复习图片ppt课件,共30页。













