

四川省资阳市乐至中学2023-2024学年高二化学上学期开学考试试题(Word版附解析)
展开四川省资阳市乐至中学2023-2024学年高二上学期入学考试
化学试题
考试时间:75 分钟 试卷满分:100 分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cu-64
一、选择题(本题包括 15 小题,每小题 3 分,共 45 分)
1. 《内经》曰:“五谷为养,五果为助,五畜为益,五菜为充”。合理膳食,能提高免疫力。下列说法正确的是
A. 淀粉和纤维素都属于天然高分子,且两者互为同分异构体
B. 植物油中含有不饱和脂肪酸酯,能使溴的四氯化碳溶液褪色
C. 淀粉通过发酵法制得的乳酸是乙酸的同系物
D. 人体摄入的膳食纤维不仅能促进肠胃蠕动,还能为生命活动提供能量
【答案】B
【解析】
【详解】A.淀粉和纤维素的化学式都是,但n的取值不同,淀粉和纤维素不互为同分异构体,A项错误;
B.油脂的主要成分是高级脂肪酸的甘油酯,植物油是不饱和高级脂肪酸的甘油酯,能与溴的四氯化碳溶液发生加成反应,使溴的四氯化碳溶液褪色,B项正确;
C.乳酸的官能团为羟基和羧基,乙酸的官能团为羧基,两者结构不相似,且分子组成不相差1个或若干个“CH2”,乳酸和乙酸不互为同系物,C项错误;
D.人体内没有纤维素水解酶,纤维素在人体内不能水解成葡萄糖,纤维素不能为生命活动提供能量,D项错误;
答案选B。
2. 下列说法不正确的是
A. 反应产物的总能量大于反应物的总能量时,ΔH>0
B. 反应放热时ΔH<0,反应吸热时ΔH>0
C. 任何条件下,化学反应的焓变都等于化学反应的反应热
D. 在一定条件下,某化学反应是吸热反应还是放热反应,由反应产物的总焓与反应物的总焓之差决定
【答案】C
【解析】
【详解】A.反应产物的总能量大于反应物的总能量的反应为吸热反应,反应的焓变ΔH>0,故A正确;
B.反应放热时,反应的焓变ΔH<0,反应吸热时,反应的焓变ΔH>0,故B正确;
C.在恒压条件下,化学反应的焓变在数值上等于化学反应的反应热,故C错误;
D.任何化学反应都伴随能量变化,在确定的化学反应体系中反应物的总能量与生成物的总能量一定不同,所以在一定条件下,某化学反应是吸热反应还是放热反应,由反应产物的总焓与反应物的总焓之差决定,故D正确;
故选C。
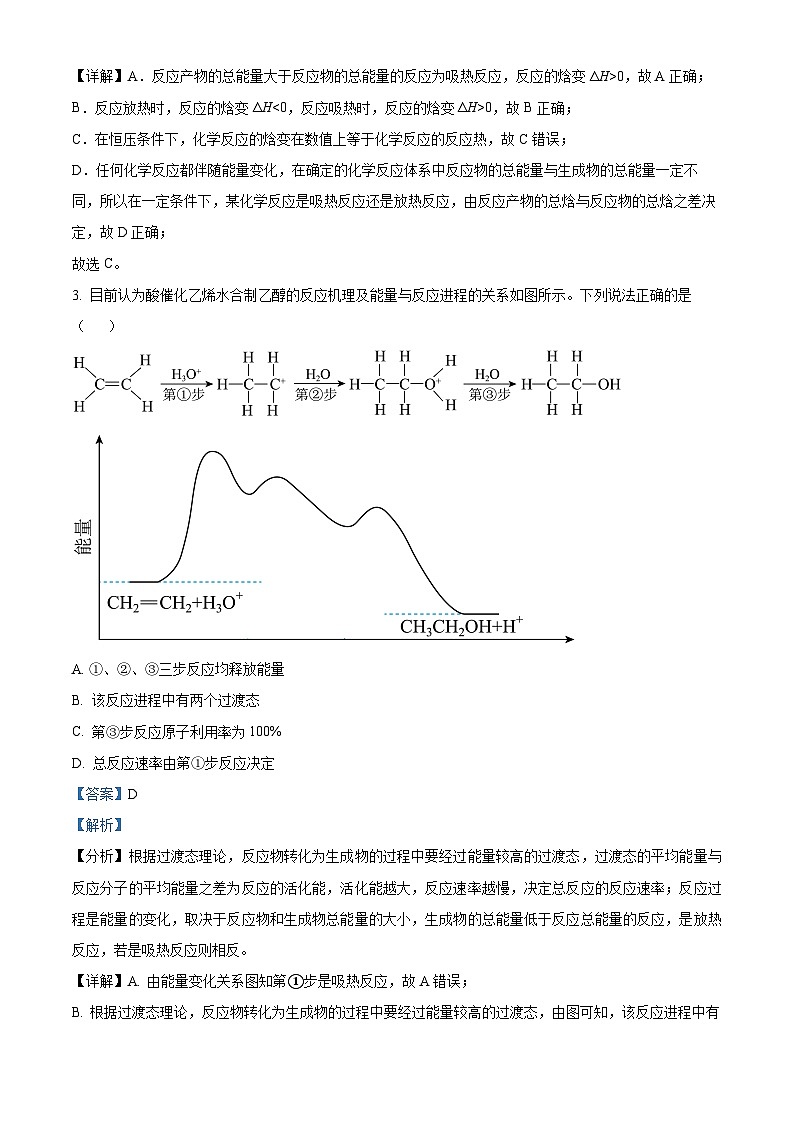
3. 目前认为酸催化乙烯水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列说法正确的是( )
A. ①、②、③三步反应均释放能量
B. 该反应进程中有两个过渡态
C. 第③步反应原子利用率为100%
D. 总反应速率由第①步反应决定
【答案】D
【解析】
【分析】根据过渡态理论,反应物转化为生成物的过程中要经过能量较高的过渡态,过渡态的平均能量与反应分子的平均能量之差为反应的活化能,活化能越大,反应速率越慢,决定总反应的反应速率;反应过程是能量的变化,取决于反应物和生成物总能量的大小,生成物的总能量低于反应总能量的反应,是放热反应,若是吸热反应则相反。
【详解】A. 由能量变化关系图知第①步是吸热反应,故A错误;
B. 根据过渡态理论,反应物转化为生成物的过程中要经过能量较高的过渡态,由图可知,该反应进程中有三个过渡态,故B错误;
C. 由反应机理知,第③步反应还有H+产生,原子利用率不是100%,故C错误;
D. 总反应速率由活化能最大的那步反应即第①步反应决定,故D正确;
故选D。
4. 下列物质中,不能由单质直接化合生成的是
①CuS ②FeS ③SO3 ④H2S ⑤NO2 ⑥Mg3N2 ⑦NH3
A. ①③⑤ B. ①②③⑤ C. ①②④⑤ D. 全部
【答案】A
【解析】
【详解】一定条件下单质硫可以和金属直接化合,并且与变价金属反应生成低价金属硫化物,即与铜化合生成Cu2S,与铁化合生成FeS,故①不能由单质直接化合生成,②能由单质直接化合生成;硫和氧气反应生成的是SO2,而不是SO3,故③不能由单质直接化合生成;一定条件下硫单质可以与氢气化合生成H2S,故④能由单质直接化合生成;氮气和氧化在放电条件下生成NO,而不是NO2,故⑤不能由单质直接化合生成;在燃烧条件下镁可以与氮气直接化合生成Mg3N2,故⑥能由单质直接化合生成;高温高压催化剂条件下氮气和氢气可以直接化合物生成NH3,故⑦能由单质直接化合生成,综上所述,正确选项为A。
5. 下列实验装置或对实验的描述正确的是
A
B
C
D
收集NO2气体
验证NH3极易溶于水
检验CO2
制备SO2
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.NO2密度比空气大,应该用向上排空气法收集,故A错误;
B.烧瓶中滴入水,气球膨胀,证明氨气极易溶于水,故B正确;
C.木炭和浓硫酸反应生成二氧化碳和二氧化硫,二氧化碳、二氧化硫都能使澄清石灰水变浑浊,故C错误;
D.铜和浓硫酸在加热的条件下才能反应生成硫酸铜、二氧化硫和水,故D错误;
选B。
6. 下列反应的离子方程式书写正确的是
A. 铁片投入稀硫酸中:2Fe + 6H+=2Fe3+ + 3H2↑
B. NH4Cl溶液中加入NaOH溶液并加热: + OH- NH3↑ + H2O
C. 氢氧化钡溶液滴入稀硫酸中:Ba2++=BaSO4↓
D. 铜与稀硝酸反应:Cu+4H+ +2=Cu2+ +2NO2↑+2H2O
【答案】B
【解析】
【详解】A.铁片与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,故A错误;
B.氯化铵溶液与氢氧化钠溶液共热反应生成氯化钠、氨气和水,反应的离子方程式为+OH- NH3↑ + H2O,故B正确;
C.氢氧化钡溶液与稀硫酸反应生成硫酸钡沉淀和水,反应的离子方程式为Ba2++2OH-++2H+=BaSO4↓+2H2O,故C错误;
D.铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应离子方程式为3Cu+8H+ +2=3Cu2++2NO↑+4H2O,故D错误;
故选B。
7. 一定温度下,向某恒容密闭容器中充入和,在催化剂作用下发生反应:,下列说法正确的是
A. 使用催化剂可实现的100%转化
B. 以或浓度的变化均可表示反应速率,两者的数值相等
C. 达到平衡状态时,与物质的量之比为
D. 达到平衡状态时,的浓度不再发生变化
【答案】D
【解析】
【详解】A.催化剂不能改变平衡状态,因此使用催化剂不能实现100%转化,A错误;
B.以或浓度的变化均可表示反应速率,速率之比是化学计量数之比,所以根据方程式可判断两者的数值不相等,B错误;
C.达到平衡状态时,由于转化率不确定,所以与物质的量之比不一定为,C错误;
D.达到平衡状态时正逆反应速率相等,因此的浓度不再发生变化,D正确;
答案选D。
8. 下列不能达到“实验目的”的“实验操作及现象”是
选项
实验目的
实验操作及现象
A
证明浓硫酸有脱水性
向蔗糖中滴加浓硫酸,蔗糖变黑
B
证明SO2具有漂白性
向品红溶液中通入SO2,溶液褪色
C
检验某溶液中含有
向某溶液中加入BaCl2溶液,有白色沉淀产生
D
检验NH4Cl溶液中的
向NH4Cl溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.向蔗糖中滴加浓硫酸,蔗糖变黑,证明浓硫酸有脱水性,A正确;
B.向品红溶液中通入SO2,溶液褪色,证明SO2具有漂白性,B正确;
C.溶液中如果有银离子,滴加氯化钡后,也会生成白色沉淀,C错误;
D.向NH4Cl溶液中加入浓NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,说明产生NH3,因此该操作可以检验NH4Cl溶液中的,D正确;
故选C。
9. 下列有关物质的用途的说法不正确的是
A. SiO2可用于制造光导纤维,Si可用于制造计算机芯片
B. 常温下Si的化学性质稳定,在自然界中硅大部分以游离态存在
C. 石英砂、纯碱和石灰石可用于制造普通玻璃
D. 浓HF溶液可用于刻蚀玻璃
【答案】B
【解析】
【详解】A.SiO2具有良好的传输光信号的能力,常用作光导纤维,Si是良好的半导体材料,可用于制造计算机芯片,故A正确;
B.Si为亲氧元素,在自然界中只存在化合态,故B错误;
C.制取普通玻璃的原料为二氧化硅、纯碱和石灰石,故C正确;
D.HF能与玻璃中的二氧化硅反应生成SiF4,常用HF刻蚀玻璃,故D正确;
故选:B
10. 某废水中存在大量的K+、Cl-、Ca2+、Mg2+,欲除去其中的Ca2+和Mg2+并回收KCl固体,设计了如图流程。
下列说法中,不正确的是
A. 加KOH的主要目的是除去Mg2+
B. 加K2CO3主要目的是除去Ca2+
C. 加盐酸的主要目的是除去过量的OH-
D. 蒸发的目的是除去H2O和HCl
【答案】C
【解析】
【分析】加入过量KOH将Mg2+转化成Mg(OH)2沉淀,过量K2CO3将Ca2+转化成CaCO3沉淀,过滤所得溶液中含K+、Cl-、OH-、,加入过量盐酸除去过量的OH-、,最后蒸发得到KCl固体;据此作答。
【详解】A.加入KOH的主要目的是除去Mg2+,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,A项正确;
B.加入K2CO3的主要目的是除去Ca2+,反应的离子方程式为Ca2++=CaCO3↓,B项正确;
C.根据分析,加入盐酸的主要目的是除去过量的OH-和,C项错误;
D.由于盐酸过量,加入过量盐酸后所得溶液中的溶质有KCl、HCl,盐酸具有挥发性,故蒸发的目的是除去H2O和HCl,D项正确;
答案选C。
11. 某有机物的结构简式为,下列有关说法错误的是
A. 该有机物的分子式为C10H10O2
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 该有机物中有两种官能团
D. 该有机物能使酸性高锰酸钾溶液和溴水褪色,其褪色原理相同
【答案】D
【解析】
【详解】A.根据物质结构简式可知该有机物的分子式为C10H10O2,A正确;
B.该有机物分子中含有不饱和的碳碳双键,能发生加成反应、氧化反应;含有羧基,能够发生取代反应,B正确;
C.根据物质结构简式可知:该有机物中有羧基及碳碳双键两种官能团,C正确;
D.该有机物含有不饱和的碳碳双键及苯环上的甲基,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液紫色褪色;含有不饱和的碳碳双键,能够与溴水发生加成反应而使溴水褪色,可见二者的褪色原理不相同,D错误;
故合理选项是D。
12. 以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。下列说法错误的是
A. 该电池工作时能量由化学能转化为电能
B. A极为电池正极,发生氧化反应
C. 负极的电极反应式为CH4+4O2--8e-=CO2+2H2O
D. 该电池的总反应为CH4+2O2=CO2+2H2O
【答案】B
【解析】
【分析】甲烷燃料电池中甲烷发生氧化反应,故B极为负极,A为正极,据此分析。
【详解】A.电池工作时化学能转化为电能,故A正确;
B.A电极通入氧气,化合价降低,发生还原反应,故B错误;
C.B电极通入甲烷,甲烷失去电子和阳离子结合生成二氧化碳和水,其反应式为CH4+4O2−-8e-=CO2+2H2O,故C正确;
D.甲烷燃料电池是化学能转化为电能,不是化学能变为热能,该电池的总反应:CH4+2O2 =CO2+2H2O,故D正确。
故答案为B。
13. 在密闭容器中加入一定量的C(s)和CO2(g),发生反应:C(s)+CO2(g)2CO(g)。下列说法错误的是
A. 增大C(s)的用量,CO(g)的生成速率不变
B. 保持容器体积不变,充入氦气,反应速率不变
C. 保持容器体积不变,将CO2(g)抽离出来,反应速率减慢
D. 提高反应时的温度,可以实现CO2的完全转化
【答案】D
【解析】
【详解】A.固体浓度恒定,故增大C(s)的用量,CO(g)的生成速率不变,A正确;
B.保持容器体积不变,充入氦气,各物质浓度均不改变,反应速率不变,B正确;
C.保持容器体积不变,将CO2(g)抽离出来,反应物浓度降低,反应速率减慢,C正确;
D.该反应为可逆反应,有限度,升高温度反应物也不可能完全转化,D错误;
故选D。
14. 在一定条件下,已知下列物质燃烧的热化学方程式为:
C(s)+O2(g)=CO2(g) ΔH= -393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH= -572kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890kJ。mol-1。
在此条件下,下列叙述正确的是
A. C(s)+2H2(g)=CH4(g) ΔH= +75.5kJ·mol-1
B. 相同质量的H2和C充分燃烧时,H2放出的热量约等于C放出的热量的4.36倍
C. 1molH2(g)和1molCH4(g)燃烧共放热1462kJ
D. CH4(g)+O2(g)=C(s)+2H2O(g) ΔH= -1283.5kJ·mol-1
【答案】B
【解析】
【详解】A.根据盖斯定律,,A项错误;
B.6molH2的质量等于1molC,6molH2充分燃烧放出的热量为572kJ×3=1716kJ,1molC充分燃烧放出的热量为393.5kJ,则H2充分燃烧放出的热量约为等质量C的倍,B项正确;
C.1molH2(g)和1molCH4(g)完全燃烧,共放热,C项错误;
D.根据盖斯定律,CH4(g)+O2(g)=C(s)+2H2O(l) ΔH= -496.5kJ·mol-1,D项错误。
答案选B。
15. 对于如下反应,其反应过程的能量变化示意图如图:
编号
反应
平衡常数
反应热
反应①
A(g)B(g)+C(g)
K1
△H1
反应②
B(g)+C(g)D(g)
K2
△H2
反应③
A(g)D(g)
K3
△H3
下列说法正确的是
A. K3=K1+K2
B. 加催化剂,反应①的反应热降低,反应速率加快
C. △H3=△H1+△H2
D. 增大压强,K1减小,K2增大,K3不变
【答案】C
【解析】
【详解】A.由题意可知,K1= ,K2= ,所以K3=K1K2,故A错误;
B.催化剂能加快反应速率,不能改变反应热,故B错误;
C.①A(g)⇌B(g)+C(g) △H1,②B(g)+C(g)⇌D(g) △H2,根据盖斯定律①+②得A(g)⇌D(g) △H3=△H1+△H2,故C正确;
D.化学平衡常数只与温度有关,增大压强平衡常数不变,故D错误;
故答案为C。
二、填空题(本题包括 4 小题,共 55 分)
16. 回答下列问题:
Ⅰ.已知:298K 时,2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
(1)H2的燃烧热ΔH=___________kJ/mol。
(2)以太阳能为热源分解Fe3O4 ,经热化学铁氧化合物循环分解水制H2 的过程如图。
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
写出过程Ⅱ的热化学方程式___________
Ⅱ.一定温度下,体积为 2L 的密闭容器中,X、Y 间发生反应。各物质的物质的量随时间变化的关系如图所示。请回答下列问题:
(3)该反应的化学方程式可表示为___________;在 0 到 1min 中内用X 表示该反应的速率是___________,该反应达最大限度时 Y 的转化率___________
(4)若 X、Y 均为气体,且 X 为无色气体,Y 为红棕色气体。下列描述能表示反应达平衡状态的是___________。
A. 容器中 X 与 Y 的物质的量相等 B. 容器内气体的颜色不再改变
C. 2v(X)=v(Y) D. 容器内气体的平均相对分子质量不再改变
(5)NO2、O2 和熔融 NaNO3 可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅱ电极上生成氧化物 Y(N2O5),则石墨 I 电极是___________(填“正极”或“负极”),石墨Ⅱ的电极反应式为______________。
【答案】(1)-285.8
(2)
(3) ①. ②. ③. 60% (4)BD
(5) ①. 正极 ②.
【解析】
【小问1详解】
2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ/mol ;H2O(g)=H2O(l) ΔH=-44.0kJ/mol,将第二个方程式减去第一个方程式的一半就得到,因此氢气的燃烧热为285.8 kJ/mol;
【小问2详解】
根据变为,2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol,第一个方程式减去第二个方程式的一半得到过程Ⅱ的热化学方程式为 ;
【小问3详解】
X为生成物,Y 为反应物,它们改变量分别为 0.3mol、0.6mol,根据改变量之比等于方程式计量系数之比,因此该反应的化学方程式可表示为 。在 0到 1min 中内X改变量为 0.2mol,则这段时间内用X表示该反应的速率是,该反应达最大限度时Y 的改变量为0.6mol,则Y的转化率为;
【小问4详解】
A.容器中X与Y 的物质的量相等,不能作为判断平衡标志,只能说物质的量不再改变,故A不符合题意;
B.Y有颜色,正向移动,颜色变浅,当容器内气体的颜色不再改变,作为判断平衡标志,故B符合题意;
C.2v(X)=v(Y),没有正逆反应速率,不能作为判断平衡标志,故C不符合题意;
D.平均摩尔质量等于气体质量除以气体物质的量,气体质量不变正向反应,气体物质的量减小,平均摩尔质量增大,当容器内气体的平均相对分子质量不再改变,可作为判断平衡标志,故 D 符合题意;
故选BD。
【小问5详解】
NO2、O2,和熔融 NaNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨II电极上生成氧化物 Y(N2O5),NO2变为N2O5,失去电子,化合价升高,和硝酸根结合生成 N2O5,作负极,O2化合价降低,作正极,因此石墨I电极是正极,石墨II的电极反应式为。
17. 碳酸锂广泛应用于陶瓷和医药等领域,在水中的溶解度比较小。以锂辉石(主要成分为 Li2O,含有少量 SiO2、Al2O3、Fe2O3)为原料制备 Li2CO3的流程如图:
(1)写出加快“酸溶”速率的一种方法__________; “酸溶”时 Li2O 发生反应的离子方程式:___________。
(2)过滤时用到的玻璃仪器有烧杯、___________。
(3)“除杂”时所用 NaOH 溶液不能过量,原因是___________;“除杂”时检验铁元素已完全除去的方法是___________。
(4)写出“沉淀”时反应的化学方程式:___________。
(5)检验最终所得碳酸锂样品中是否含有 Na2CO3的方法是:___________ 。
【答案】(1) ①. 适当增加硫酸的浓度(或加热或研磨锂辉石) ②.
(2)漏斗、玻璃棒 (3) ①. 若NaOH过量,溶解生成 ②. 静置,取上层清液滴加KSCN溶液,溶液不变红则铁元素全部除去
(4)
(5)用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含碳酸钠,反之则不含;
【解析】
【分析】该流程为以锂辉石(主要成分为 Li2O,含有少量 SiO2、Al2O3、Fe2O3)为原料制备 Li2CO3 ,通过“酸溶”和“过滤”将不溶于稀硫酸SiO2除去,再向滤液中加入氢氧化钠溶液将Al3+和Fe3+转化为Al(OH)3和Fe(OH)3除去,后蒸发浓缩硫酸锂溶液,再加入饱和碳酸钠溶液使锂离子转化为碳酸锂沉淀,最后过滤获得碳酸锂固体。
【小问1详解】
适当增加硫酸的浓度、加热或研磨锂辉石均可加快“酸溶”速率;“酸溶”时 Li2O与稀硫酸发生反应,离子方程式为;
【小问2详解】
过滤时用到的玻璃仪器有烧杯、漏斗、玻璃棒;
【小问3详解】
为两性氢氧化物,能与氢氧化钠反应,若NaOH过量,会溶解生成;“除杂”时铁元素为Fe3+,检验Fe3+已完全除去的方法是静置,取上层清液滴加KSCN溶液,溶液不变红则铁元素全部除去;
【小问4详解】
“沉淀”时饱和碳酸钠溶液与锂离子生成碳酸锂沉淀,反应的化学方程式为;
【小问5详解】
可用焰色反应检验钠盐,方法为用洁净的铁丝(或铂丝)蘸取碳酸锂样品于酒精灯外焰上灼烧,若火焰呈黄色则含碳酸钠,反之则不含。
18. 某学习小组设计实验探究NO与铜粉的反应,并收集反应生成的气体,装置如图,实验开始前应先向装置中通入一段时间的氮气。已知:(棕色)
(1)组装仪器后,应先进行的操作是___________。
(2)仪器a的名称是___________,C中的药品是___________,E的作用是___________。
(3)D中固体逐渐变黑,并生成一种无毒气体,反应的方程式为___________。
(4)通入的作用是___________。
(5)反应前,装置D(硬质玻璃管和铜粉)的质量为,反应后质量为,则该反应生成的气体在标准状况下体积约为___________L(用、表示)
【答案】(1)检查装置的气密性
(2) ①. 分液漏斗 ②. 浓硫酸 ③. 除去未反应的NO
(3)
(4)排除装置内的氧气,防止NO被氧化
(5)
【解析】
【分析】铜和稀硝酸反应生成一氧化氮,实验开始前向装置中通入一段时间的氮气,排净装置内空气,由于硝酸具有挥发性,通过装置B中水吸收挥发出的硝酸,通过C中浓硫酸干燥一氧化氮,NO通过装置D加热反应,铜和NO反应生成氮气和氧化铜,装置E的作用是除去未反应的NO,所盛装试剂为硫酸亚铁溶液,剩余气体进入F,收集主要为氮气,以此解答该题。
【小问1详解】
组装仪器后,应先进行的操作是检查装置气密性,故答案为:检查装置气密性;
【小问2详解】
分析可知,仪器a为分液漏斗, C中药品为浓硫酸,E中硫酸亚铁溶液吸收NO,故答案为:分液漏斗;浓硫酸;除去未反应的NO;
【小问3详解】
D中固体逐渐变黑,并生成一种无毒气体,说明铜粉被氧化,NO的化合价降低,对应的无毒气体为氮气,反应的方程式为:2NO+2CuN2+2CuO;故答案为: 2NO+2CuN2+2CuO;
【小问4详解】
通入N2排除装置内的氧气,防止NO被氧化,故答案为:排除装置内的氧气,防止NO被氧化;
【小问5详解】
铜粉被氧化,NO的化合价降低,对应的无毒气体为氮气,方程式为:2NO+2CuN2+2CuO,玻璃管的质量差为氧元素质量= (m2−m1)g,对应氮气的物质的量为:mol;对应的气体的体积为:×22.4L=0.7(m2−m1)L;故答案为:0.7(m2−m1)。
19. 下图是一些常见有机物的转化关系。A 的产量可以用来衡量一个国家的石油化工发展水平,E 是一种酸。请回答相关问题。
(1)C 官能团名称为___________,E 分子的结构简式为___________。
(2)在催化剂条件下,A 可形成高分子化合物 B,该反应的化学方程式为___________。
(3)反应①~⑤中属于加成反应的有___________(填序号)。
(4)写出反应③的化学方程式___________。
(5)写出 C 与 E 反应的化学方程式:___________。
【答案】(1) ①. 羟基 ②. CH3COOH
(2) (3)①②
(4)
(5)
【解析】
【分析】A 的产量可以用来衡量一个国家的石油化工发展水平,所以A为乙烯,由于E是一种酸,根据A为乙烯,推测E为乙酸,所以B为乙醇,乙醇通过催化氧化生成乙醛,故D为乙醛,由此作答:
【小问1详解】
由上分析,C 是乙醇,其官能团为-OH,名称为轻基,E 是乙酸,其结构简式为CH3COOH;
【小问2详解】
在催化剂条件下,乙烯可形成高分子化合物 B,B 是聚乙烯,该反应的化学方程式为 ;
【小问3详解】
据分析,反应①是乙烯与溴单质加成得到 1,2-二溴乙烷,属于加成反应;反应②是乙烯与水加成得到乙醇,属于加成反应;反应③是乙醇催化氧化得到乙醛,属于氧化反应;反应④是乙醛发生催化氧化生成乙酸,属于氧化反应;反应⑤是乙醇被酸性重铬酸钾溶液氧化为乙酸,属于氧化反应,故符合题意的是①②;
【小问4详解】
反应③是乙醇催化氧化得到乙醛,化学方程式为;
【小问5详解】
根据分析,C与E是乙醇和乙酸的酯化反应,反应的方程式为。
四川省资阳市乐至中学2023-2024学年高二上学期期中考试化学试题含答案: 这是一份四川省资阳市乐至中学2023-2024学年高二上学期期中考试化学试题含答案,共17页。试卷主要包含了单选题,非选择题等内容,欢迎下载使用。
四川省资阳市乐至中学2023-2024学年高二上学期期中考试化学试题(Word版附解析): 这是一份四川省资阳市乐至中学2023-2024学年高二上学期期中考试化学试题(Word版附解析),共20页。试卷主要包含了 下列问题与盐的水解有关的是, NA是阿伏加德罗常数的值,8LNO与22, 下列离子方程式正确的是等内容,欢迎下载使用。
四川省资阳市乐至中学2023-2024学年高一上学期10月月考化学试题(Word版附解析): 这是一份四川省资阳市乐至中学2023-2024学年高一上学期10月月考化学试题(Word版附解析),共15页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。












