

江苏省扬州市2022-2023学年高二下学期开学考试化学试题(含解析)
展开江苏省扬州市2022-2023学年高二下学期开学考试化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.我国力争在2060年前实现碳中和。下列说法不正确的是
A.可利用捕集废气中的
B.鼓励植树造林,吸收过多排放的
C.将转化为,实现的资源化利用
D.研发新型催化剂将分解为C和,并放出热量
2.下列关于水的说法正确的是
A.纯水的一定等于7
B.水比较稳定是由于水分子间存在氢键
C.温度升高,纯水中的和增大
D.等于4的盐酸和溶液中,水的电离程度相同
3.汽车剧烈碰撞后,安全气囊中物质会发生反应:10NaN3+2KNO3 =K2O+5Na2O+ 16N2↑,生成大量气体。下列说法正确的是
A.半径大小:r(N3-)>r(Na+)
B.电负性大小:χ(N)>χ(O)
C.电离能大小:I1(K)>I1(Na)
D.离子键强弱:K2O>Na2O
4.下列钠及其化合物的性质与用途具有对应关系的是
A.Na能与水反应,可用于高压钠灯
B.NaCl熔点较高,可用于制备烧碱
C.NaHCO3能与酸反应,可用于治疗胃酸过多
D.Na2O2受热会分解,可用作呼吸面具中的供氧剂
5.SO2既是大气主要污染物之一,也是重要的工业原料。工业制硫酸时在接触室中以V2O5为催化剂,发生反应2SO2(g) + O2(g) 2SO3(g) ΔH<0,尾气中的SO2在高温下可被CO、H2还原为硫单质,也可被Na2SO3溶液吸收生成NaHSO3溶液。电解NaHSO3溶液时阴极可生成硫单质。硫单质的熔沸点较低。下列说法正确的是
A.V基态原子核外电子排布式为[Ar]3d34s2
B.CO分子中仅含σ键
C.H2S的热稳定性比H2O强
D.硫单质属于共价晶体
6.SO2既是大气主要污染物之一,也是重要的工业原料。工业制硫酸时在接触室中以V2O5为催化剂,发生反应2SO2(g) + O2(g) 2SO3(g) ΔH<0,尾气中的SO2在高温下可被CO、H2还原为硫单质,也可被Na2SO3溶液吸收生成NaHSO3溶液。电解NaHSO3溶液时阴极可生成硫单质。硫单质的熔沸点较低。下列化学反应表示正确的是
A.H2S燃烧生成SO2:H2S + O2 SO2 + H2
B.高温下CO还原SO2:CO + SO2 S + CO2
C.Na2SO3溶液吸收SO2:
D.电解NaHSO3溶液时的阴极反应: −4e-+ 5H+ = S +3H2O
7.下列关于物质制备的说法不正确的是
A.高温条件下用CO还原铁矿石炼铁
B.将Cl2通入澄清石灰水中制漂白粉
C.以粗铜为阳极、纯铜为阴极,电解精炼铜
D.将NH3、CO2通入饱和食盐水中制备NaHCO3
8.恒容容器中发生反应4HCl(g) + O2(g) 2H2O(g) + 2Cl2(g) ΔH<0,下列说法正确的是
A.各物质浓度不再发生变化,表明该反应达到平衡状态
B.催化剂可以改变反应的焓变
C.该反应的平衡常数K=
D.其他条件不变,增大,HCl的平衡转化率增大
9.工业上吸收含氟烟气中的HF并制备Na3AlF6的流程如下:
已知Ka(HF)=6.6×10−4;H2CO3的Ka1=4.3×10−7,Ka2=5.6×10−11。下列说法不正确的是
A.“吸收”时发生反应的离子方程式为HF+=+F-
B.“吸收”时烟气自下而上、吸收液自上而下喷淋,有利于HF的吸收
C.“合成”过程中溶液的碱性减弱
D.“过滤”所得滤液可以返回“吸收”过程,循环使用
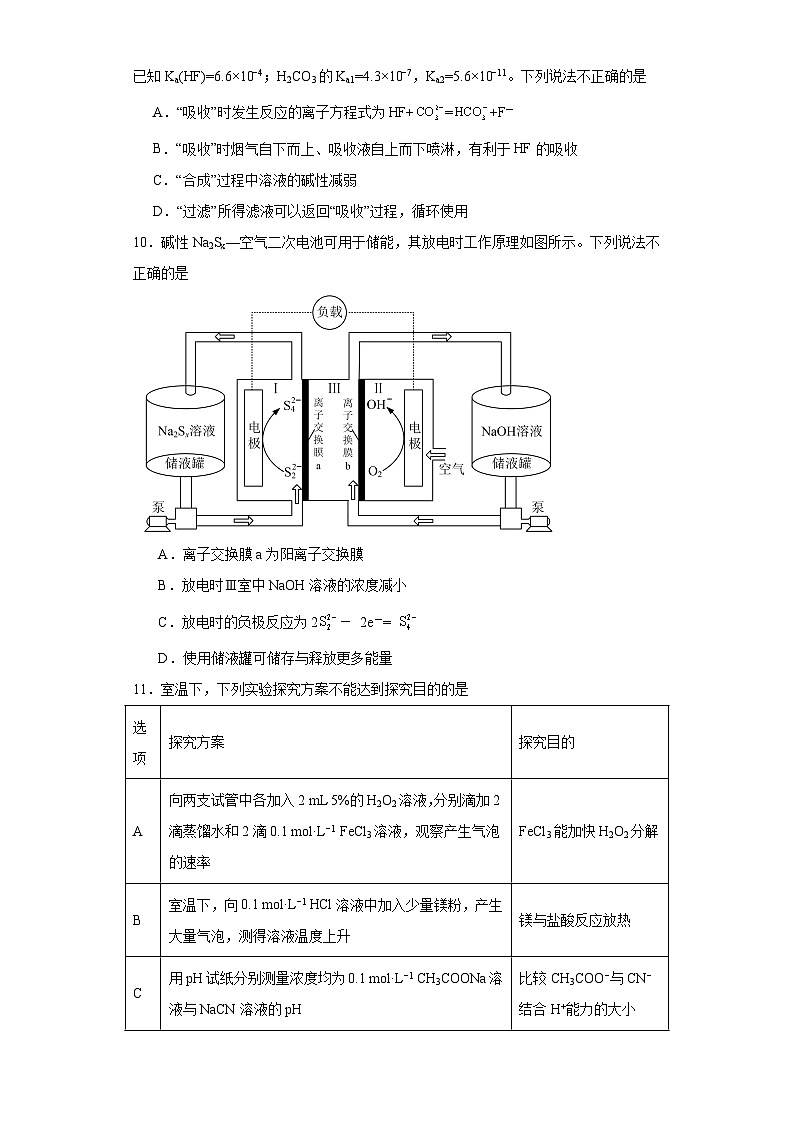
10.碱性Na2Sx—空气二次电池可用于储能,其放电时工作原理如图所示。下列说法不正确的是
A.离子交换膜a为阳离子交换膜
B.放电时Ⅲ室中NaOH溶液的浓度减小
C.放电时的负极反应为2- 2e-=
D.使用储液罐可储存与释放更多能量
11.室温下,下列实验探究方案不能达到探究目的的是
选项
探究方案
探究目的
A
向两支试管中各加入2 mL 5%的H2O2溶液,分别滴加2滴蒸馏水和2滴0.1 mol·L−1 FeCl3溶液,观察产生气泡的速率
FeCl3能加快H2O2分解
B
室温下,向0.1 mol·L−1 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升
镁与盐酸反应放热
C
用pH试纸分别测量浓度均为0.1 mol·L−1 CH3COONa溶液与NaCN溶液的pH
比较CH3COO−与CN−结合H+能力的大小
D
向饱和Na2CO3溶液中加入少量BaSO4粉末,搅拌,过滤;向洗净后的沉淀中滴加稀盐酸,观察是否有气体放出
比较Ksp(BaSO4)与Ksp(BaCO3) 的大小
A.A B.B C.C D.D
12.室温下,H2SO3的Ka1=1.5×10−2,Ka2=1.5×10−7.通过下列实验探究NaHSO3溶液的性质。
实验1:用pH试纸测量0.1 mol·L−1 NaHSO3溶液的pH
实验2:向5 mL 0.1 mol·L−1 NaHSO3溶液中滴加0.1mol·L−1 NaOH溶液至pH为8
实验3:将浓度均为0.01 mol·L−1 NaHSO3和Ba(OH)2溶液等体积混合,产生白色沉淀
实验4:将浓度均为1.0 mol·L−1的 NaHSO3和CuCl2溶液等体积混合,生成CuCl沉淀
下列说法正确的是
A.实验1测得溶液的pH>7 B.实验2所得溶液中c()>c()
C.由实验3可知:Ksp(BaSO3)>2.5×10−5 D.实验4中转化为单质S
13.将TiO2、C、Cl2以一定的物质的量之比加入密闭容器中反应可生成TiCl4。可能发生的反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g)TiCl4(g)+O2(g) ΔH1 =+172 kJ·mol−1
反应Ⅱ:C(s)+O2(g)=CO2(g) ΔH2 =-393.5 kJ·mol−1
反应Ⅲ:2CO2(g)=2CO(g)+O2(g) ΔH3 = +564 kJ·mol−1
平衡时容器中气体的物质的量分数随温度变化如图所示(曲线a、b表示生成的CO2或CO)。下列说法不正确的是
A.曲线a为CO
B.与仅加入TiO2、Cl2相比,碳的加入可提高TiCl4的产率
C.TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH=-51 kJ·mol-1
D.其他条件不变,增大压强,TiCl4的平衡产率增大
二、工业流程题
14.以硫化铜矿(主要成分为CuS,含一定量的Zn2+、Fe2+)为原料制备粗铜的流程如下:
已知:①浸取液中c(Cu2+) 约为0.1 mol·L−1
②几种离子沉淀完全(金属离子浓度≤10-5 mol·L−1)时的pH:
离子
Fe2+
Fe3+
Cu2+
Zn2+
沉淀完全的pH
9.6
3.2
6.7
8.2
(1)“浸取”时,CuS转化为S的离子方程式为 。
(2)已知CuS难溶于硫酸。溶液中存在CuS(s)Cu2+(aq) + S2−(aq)。“浸取”时采用高压O2的原因是 。
(3)“调pH”时需控制的pH范围是 。
(4)“过滤1”所得固体X主要成分是 。
(5)粗铜中铜含量的测定
步骤1:取0.200 g 粗铜,加入一定量浓HNO3、浓HCl,微热至粗铜完全溶解后,控制溶液pH为3~4,加热除去未反应的HNO3,冷却;
步骤2:将步骤1所得溶液加水定容至250 mL,量取25.00 mL置于锥形瓶中,加入过量KI溶液,再加入少量淀粉溶液,用0.01000 mol·L−1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液20.00 mL。
已知:Cu2++ I−-CuI+I2, I2 + -+I−(未配平)
粗铜中铜的质量分数为 (写出计算过程)。
三、实验题
15.某废旧锂电池正极材料中含有LiCoO2、LiMnO2以及有机物、碳粉等,以该正极材料为原料可制备CoCO3和Li2CO3。
已知:Ksp[Co(OH)2]=1.6×10-15,Ksp[CoCO3]=1.4×10-13。
(1)热解。将正极材料加热。LiCoO2的晶胞如图所示,各离子位于晶胞的顶点、棱和体内。晶胞中Co3+的数目是 。
(2)浸出。热解所得产物含Li+、Co3+、Mn3+等,向其中加入H2O2和稀H2SO4,充分反应,过滤,得到含Li+、Co2+、Mn2+的浸出液。H2O2在该过程中的作用为 。
(3)分离。向浸出液中加入有机萃取剂HA,发生反应:Co2++2HACoA2+2H+,将CoA2萃取入有机相中,HA对金属离子的萃取率与pH的关系如图所示。分液后,再从有机相中反萃取得到CoSO4溶液的操作是 。
(4)制备CoCO3.用CoSO4溶液与NH4HCO3−氨水混合溶液反应制备CoCO3,装置如图所示。分液漏斗中盛装的溶液为 ,该反应的离子方程式为 。
(5)制备Li2CO3.已知:常温下,LiOH易溶于水,Li2CO3的溶解度为1.3 g;pH约为10时,Mn(OH)2完全沉淀。请补充完整制取纯度较高的Li2CO3的实验方案:取(3)中萃取、分液后的水层溶液(含少量Mn2+), ,得到纯度较高的Li2CO3。(实验中可使用的试剂:1.0 mol·L−1NaOH溶液、1.0 mol·L−1 H2SO4溶液、稀盐酸、BaCl2溶液、1.0 mol·L−1 Na2CO3溶液)
四、原理综合题
16.以Cu/Zn催化剂作阴极,酸性溶液为介质。用电化学法可将CO2转化为CH3OH,其原理如图所示。
(1)阴极生成CH3OH的电极反应式为 。电解时阴极会产生一种气体副产物,其化学式为 。
(2)目前认为该转化过程可能有两种机理,一种机理会生成中间产物HCOOH(路径A),另一种机理会生成中间产物CO(路径B)。两种机理的部分反应路径如下:
两种反应路径中,H+在铜表面得电子分别形成H和H-。其中形成H-的路径是 (填“A”或“B”)。从电负性的角度说明判断的理由: 。
(3)计算机模拟CO2在Cu/Zn催化剂表面发生路径A和路径B的部分反应历程如图所示(TS表示过渡态,*表示吸附在催化剂表面,图中未显示表面吸附的氢原子)。根据反应历程推测,在Cu/Zn催化剂表面更易发生的是路径 (填“A”或“B”),作出判断的理由是 。
(4)使用Cu/Zn催化剂,改变其他反应条件,可通过路径B在制备CO的同时产生H2,当减小Cu/Zn催化剂中的值,有利于提高产物中CO的比例,原因是 。
17.双温–双催化剂(Fe–TiO2–xHy)法可提升合成氨反应中NH3的产率。将一定比例N2、H2混合气体,匀速通过装有不同催化剂的反应器中发生反应:N2(g) + 3H2(g)2NH3(g) ΔH =-92.4 kJ·mol−1,NH3的平衡浓度随体系温度的变化如图所示。
(1)体系温度为495℃,光照条件下,双催化剂(Fe–TiO2–xHy)会产生温差。分别使用双温–双催化剂以及铁催化剂催化合成氨反应,可能的机理如图所示。
双温–双催化剂法的反应过程可描述为 。从化学反应速率和化学平衡的角度出发,双温–双催化剂法的优点是 。合成氨过程中需要不断分离出氨,原因是 。
(2)利用NH3可消除氮氧化物对环境的污染。NH3和NO在Ag2O催化剂表面反应时,相同时间下,NO生成N2的转化率随温度的变化如图所示。
NH3与NO反应生成N2的化学方程式为 ,当生成1 mol N2时,转移的电子数为 mol。在500~580 K之间,有氧气存在的条件下NO生成N2的转化率明显高于无氧条件,可能的原因是 。
参考答案:
1.D
【详解】A.CaO和CO2反应生成CaCO3,且CaO粉末表面积大,利于捕获CO2,A项正确;
B.植物中叶绿素可将CO2转化为O2,B项正确;
C.CO2和H2在一定条件下反应可生成为CH3OH,从而实现CO2的资源利用,C项正确;
D.CO2分解为C和O2要吸收热量,D项错误。
答案选D。
2.C
【详解】A.纯水的不一定等于7,比如100℃时纯水的pH小于7,故A错误;
B.水比较稳定是由于水中的氢氧键键能大,故B错误;
C.温度升高,纯水的电离平衡正向移动,因此纯水中的和增大,故C正确;
D.等于4的盐酸和溶液中,前者抑制水的电离,后者促进水的电离,因此水的电离程度不相同,故D错误。
综上所述,答案为C。
3.A
【详解】A.N3-、Na+核外电子排布是2、8,二者的电子层结构相同,离子的核电荷数越大,离子半径就越小,所以离子半径大小关系为:r(N3-)>r(Na+),A正确;
B.N、O是同一周期元素,原子序数越大,元素的电负性就越大,所以电负性大小:χ(N)<χ(O),B错误;
C.K、Na是同一主族元素,原子核外最外层电子数相同,原子核外电子层数越多,其第一电离能就越小,所以电离能大小:I1(K)<I1(Na),C错误;
D.K2O、Na2O都是由离子键结合形成的离子化合物,由于离子半径:r(K+)>r(Na+),所以二者分别与O2-形成的离子键的键长:K2O>Na2O,键长越大,键能就越小,故离子键的键能大小关系为K2O<Na2O,D错误;
故合理选项是A。
4.C
【详解】A.高压钠灯发出的黄光射程远,透雾力强,对道路平面的照明度比高压水银灯高几倍,故将钠应用于电光源上,与能与水反应无关,故A不符题意;
B.电解饱和NaCl溶液生成NaOH,与NaCl熔点无关,故B不符合题意;
C.NaHCO3溶液能与酸反应用于治疗胃酸过多,故C符合题意;
D.Na2O2与水和二氧化碳反应能生成氧气,可用作呼吸面具的供氧剂,与受热分解无关,故D不符题意;
故选C。
5.A
【详解】A.V的原子序数为23,位于第四周期第ⅤB族,基态V的核外电子排布式为[Ar]3d34s2,故A正确;
B.CO与氮气互为等电子体,CO存在三键,含有σ键、π键,故B错误;
C.非金属性:O>S,因此H2O的热稳定性强于H2S,故C错误;
D.硫单质的熔沸点较低,因此硫单质属于分子晶体,故D错误;
答案为A。
6.C
【详解】A.H2S燃烧生成SO2和H2O:2H2S + 3O2 2SO2 +2 H2O,故A错误;
B.尾气中的SO2在高温下可被CO还原为硫单质,没有配平,应该为:2CO + SO2 S + 2CO2,故B错误;
C.Na2SO3溶液吸收SO2,被Na2SO3溶液吸收生成NaHSO3溶液:,故C正确;
D.电解NaHSO3溶液时阴极可生成硫单质,则阴极反应是得到电子即 +4e-+ 5H+ = S +3H2O,故D错误。
综上所述,答案为C。
7.B
【详解】A.CO具有还原性,可用于还原铁矿石炼铁,故A正确;
B.因Ca(OH)2溶解度较小,故应将氯气通入石灰乳制取漂白粉,故B错误;
C.电解精炼铜时,应将粗铜作阳极,纯铜作阴极,故C正确;
D.将NH3、CO2通入饱和食盐水发生反应NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,可以制备NaHCO3,故D正确;
故选B。
8.A
【详解】A.各组分的浓度不变时标明反应达到了平衡,故A正确;
B.催化剂只能改变反应的活化能,不能改变反应的焓变,故B错误;
C.该反应的平衡常数K=,故C错误;
D.增大,假设n(O2)不变,n(HCl)增大,HCl的平衡转化率减小,故D错误;
故选A。
9.C
【分析】烟气中的HF和过量碳酸钠溶液反应生成NaF,NaF和偏铝酸钠溶液在合成过程中最后生成Na3AlF6。
【详解】A.由Ka值大小可知,酸性HF>,则“吸收”时发生的离子方程式为HF+=+F-,符合强酸制取弱酸的规律,故A正确;
B.烟气自下而上、吸收液自上而下喷淋,增大了接触面积,有利于HF的吸收,故B正确;
C.“合成”过程中的化学方程式为2CO2+6NaF+NaAlO2=Na3AlF6+2Na2CO3,因此,溶液的碱性增强,故C错误;
D.“过滤”所得溶液为碳酸钠,可以返回“吸收”过程,循环使用,故D正确;
故选C。
10.B
【分析】由图分析可知,放电时,氧气发生还原反应生成氢氧根离子,则右边电极为正极,则左边电极为负极。
【详解】A.放电时,正极发生还原反应,反应为O2+2H2O+ 4e- =4OH-;负极发生氧化反应,反应为2-2e-=;正极区氢氧根离子向左侧运动,离子交换膜b为阴离子交换膜;负极区钠离子向右侧运动,离子交换膜a为阳离子交换膜,中间储液器中NaOH的浓度不断变大,A正确;
B.由A分析可知,中间储液器中NaOH的浓度不断变大,B错误;
C.充电时,负极失去电子发生氧化反应,反应为2-2e-=,C正确;
D.使用储液罐可以储存NaOH和Na2Sx溶液参与循环使用,故可储存与释放更多能量,D正确;
故选B。
11.D
【详解】A.采用控制变量方法,根据产生气泡的快慢研究FeCl3溶液是否对H2O2溶液分解产生影响,A能够达到实验目的,A正确;
B.室温下,向0.1 mol·L−1 HCl溶液中加入少量镁粉,发生置换反应产生MgCl2和H2,因此会看到产生大量气泡,同时测得溶液温度上升,说明该反应是放热反应,放出热量使溶液温度升高,B正确;
C.CH3COONa、NaCN都是强碱弱酸盐,水解使溶液显碱性,等浓度的盐溶液,其形成盐的弱酸越弱,则水解后溶液的碱性就越强,溶液pH就越大,说明弱酸根离子结合水电离产生H+的能力就越强,故能比较CH3COO-与CN-结合H+能力的大小,C正确;
D.向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,BaSO4溶解电离产生Ba2+、,当Qc(BaCO3)>Ksp(BaCO3)时生成BaCO3沉淀,BaCO3可与盐酸反应生成CO2气体,故不能用于比较Ksp(BaSO4)与Ksp(BaCO3) 的大小关系,D错误;
故合理选项是D。
12.B
【详解】A.NaHSO3中亚硫酸氢根离子的水解常数,Kh< Ka2,故此溶液显酸性,A错误;
B.实验2所得溶液为亚硫酸钠和亚硫酸氢钠的混合溶液,的水解常数,其水解常数小于的电离常数,即当亚硫酸根离子和亚硫酸氢根浓度相同时,溶液显酸性,故若溶液显碱性,则c()>c(),B正确;
C.实验2中,c()=0.005mol/L,c()<0.005mol/L,c(Ba2+)=0.005mol/L,则Ksp(BaSO3)=(<0.005)×0.005<2.5×10-5,C错误;
D.NaHSO3和CuCl2溶液等体积混合,生成CuCl沉淀,则铜的化合价降低,硫的化合价升高,故转化为硫酸根,D错误;
故选B。
13.D
【详解】A.CO只有在反应Ⅲ中生成,且该反应为吸热反应,故其物质的量会随温度升高而增大,最终反应达到平衡时达到最大值,而CO2在反应Ⅱ中生成,在反应反应Ⅲ中又会因为反应而消耗,其物质的量不会一直增大,故曲线a表示的为CO,A正确;
B.加入C,能够反应消耗O2,使反应Ⅰ的生成物浓度减小,化学平衡正向移动,有助于生成更多TiCl4,故可以提高TiCl4的产率,B正确;
C.根据盖斯定律,将热化学方程式Ⅰ+Ⅱ×2+Ⅲ,整理可得热化学方程式 TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) ΔH=-51 kJ·mol-1,C正确;
D.反应Ⅰ的热化学方程式为TiO2(s)+2Cl2(g)TiCl4(g)+O2(g) ΔH1 =+172 kJ·mol−1,该反应是反应前后气体体积不变的吸热反应,在其他条件不变时,增大压强,TiCl4的平衡产率不变,D错误;
故合理选项是D。
14.(1)2CuS+O2+4H+=2Cu2++2S+2H2O
(2)增大溶解氧的浓度(或增加O2在溶液中的溶解度),提高O2氧化S2-的速率,使CuS沉淀溶解平衡正向移动
(3)3.2 ~ 4.7
(4)S、Fe(OH)3
(5)64%,n(Na2S2O3)=0.01000 mol·L−1×20.00×10-3 L=2.0×10-4mol,2Cu2+~I2~2Na2S2O3,n(Cu2+)=n(Na2S2O3)=2.0×10-4 moL,0.2000 g粗铜中m(Cu)=×2.0×10-4 moL×64 g/mol=0.128 g,粗铜中铜的质量分数为:× 100% = 64%。
【分析】CuS与酸性条件下被O2氧化产生Cu2+、S、H2O,Fe2+被氧化变为Fe3+,然后通入NH3,调整溶液pH在3.2 ~ 4.7,Fe3+形成Fe(OH)3沉淀,将沉淀过滤除去,然后通入高压H2,可以将Cu2+还原为Cu单质,就得到粗铜。
【详解】(1)在浸取时,CuS、H2SO4、O2发生氧化还原反应产生CuSO4、S、H2O,根据电子守恒、电荷守恒、原子守恒,结合物质的拆分原则,可得反应的离子方程式为2CuS+O2+4H+=2Cu2++2S+2H2O;
(2)已知CuS难溶于硫酸。溶液中存在沉淀溶解平衡:CuS(s)Cu2+(aq) + S2−(aq)。“浸取”时采用高压O2是为了增大溶解氧的浓度(或增加O2在溶液中的溶解度),提高O2氧化S2-的速率,使CuS沉淀溶解平衡正向移动,促进物质的转化;
(3)在浸取时O2可以将Fe2+氧化变为Fe3+,发生反应:4Fe2++4H++O2=4Fe3++2H2O,结合溶液中各种离子沉淀完全时溶液的pH,调整溶液pH在3.2 ~ 4.7,Fe3+形成Fe(OH)3沉淀,而Cu2+及Zn2+仍以离子形式存在于溶液中,故“调pH”时需控制的pH范围是3.2 ~ 4.7;
(4)S难溶于水,以固体形式存在,Fe3+形成Fe(OH)3沉淀,故“过滤1”所得固体X主要成分是S、Fe(OH)3;
(5)根据电子守恒、原子守恒、电荷守恒,可知在滴定过程中发生反应为:2Cu2++4I−=2CuI+I2,I2+2=+2I−,故反应的关系式为:2Cu2+~I2~2Na2S2O3,25.00 mL0.01000 mol/LNa2S2O3溶液中溶质的物质的量n(Na2S2O3)=0.01000 mol·L−1×20.00×10-3 L=2.0×10-4 mol,根据反应转化关系可知反应消耗Cu2+的物质的量n(Cu2+)= n(Na2S2O3)=2.0×10-4 mol,则在0.2000 g粗铜中含有Cu的质量m(Cu)=×2.0×10-4 moL×64 g/mol=0.128 g,故该粗铜中Cu的质量分数为。
15.(1)3
(2)做还原剂
(3)向有机相中加入稀硫酸,调节pH约为2,充分振荡,静置,分液,得到CoSO4溶液
(4) NH4HCO3−氨水溶液 + NH3·H2O + Co2+CoCO3↓ + + H2O或+ Co2+ = CoCO3↓
(5)边搅拌边加入1.0 mol∙L−1 NaOH溶液调节溶液pH约为10,充分反应,过滤,向滤液中加入足量1.0 mol∙L−1 Na2CO3溶液,充分反应,过滤,洗涤2~3次,取少量最后一次洗涤滤液,加入稀盐酸,再加入BaCl2溶液,若无沉淀产生,将所得固体干燥
【分析】某废旧锂电池正极材料中含有LiCoO2、LiMnO2以及有机物、碳粉等,以该正极材料为原料可制备CoCO3和Li2CO3,通过热解、浸出、分离、制备CoCO3,再制备制备Li2CO3;
【详解】(1)Co3+位于晶胞的棱边与体内,一个晶胞含有Co3+的数目为: 4+2= 3,答案为3;
(2)加入硫酸酸化的过氧化氢溶液,Co3+转化为Co2+,钴元素从+3价降低为+2价,被还原,过氧化氢起还原剂的作用,其氧化产物是氧气,答案为做还原剂;
(3)分液后,再从有机相中反萃取得到CoSO4溶液的操作是:向有机相中加入稀硫酸,调节pH约为2,充分振荡,静置,分液,得到CoSO4溶液;
(4)制备CoCO3.用CoSO4溶液与NH4HCO3−氨水混合溶液反应制备CoCO3,一种溶液在三颈烧瓶内,一种溶液在分液漏斗中,考虑到氨水受热易分解,故NH4HCO3−氨水混合溶液应盛装在分液漏斗中,可减少反应物的分解;该反应的离子方程式为+ NH3·H2O + Co2+CoCO3↓ + + H2O或+ Co2+ = CoCO3↓;答案为NH4HCO3−氨水溶液;+ NH3·H2O + Co2+CoCO3↓ + + H2O或+ Co2+ = CoCO3↓;
(5)制取纯度较高的Li2CO3的实验方案:取(3)中萃取、分液后的水层溶液(含少量Mn2+),边搅拌边加入1.0 mol∙L−1 NaOH溶液调节溶液pH约为10,充分反应,过滤,向滤液中加入足量1.0 mol∙L−1 Na2CO3溶液,充分反应,过滤,洗涤2~3次,取少量最后一次洗涤滤液,加入稀盐酸,再加入BaCl2溶液,若无沉淀产生,将所得固体干燥,得到纯度较高的Li2CO3。
16.(1) CO2 + 6e-+ 6H+ = CH3OH + H2O H2
(2) A O的电负性比C强,C略带正电荷,易与带负电荷的H-结合
(3) A 路径A的活化能较低,反应速率更快
(4)从路径B可看出,H+在Cu表面得电子生成H,进而生成H2;CO在Zn表面生成
【详解】(1)电解池中阴极发生还原反应,故在酸性介质中,阴极生成CH3OH的电极反应式为:CO2 + 6e-+ 6H+ = CH3OH + H2O,电解时阴极上的H+可能得到电子,会产生一种气体副产物H2,电极反应为:2H++2e-=H2↑,故答案为:CO2 + 6e-+ 6H+ = CH3OH + H2O;H2;
(2)已知O的电负性比C强,故CO2分子中C略带正电荷,易与带负电荷的H-结合,结合题干图示信息可知,其中形成H-的路径是A,故答案为:A;O的电负性比C强,C略带正电荷,易与带负电荷的H-结合;
(3)由题干图示信息可知,路径A的决速步骤的活化能为:(-0.34eV)-(-1.28eV)=0.94eV,而路径B的决速步骤的活化能为:(0.98eV)-(-0.48eV)=1.46eV,故路径A的活化能较低,反应速率更快,则在Cu/Zn催化剂表面更易发生的是路径A,故答案为:A;路径A的活化能较低,反应速率更快;
(4)由题干图示信息可知,从路径B可看出,H+在Cu表面得电子生成H,进而生成H2;CO在Zn表面生成,用Cu/Zn催化剂,改变其他反应条件,可通过路径B在制备CO的同时产生H2,当减小Cu/Zn催化剂中的值,即增大Zn的含量或减少Cu的含量,则有利于生成CO而不利于产生H2,即有利于提高产物中CO的比例,故答案为:从路径B可看出,H+在Cu表面得电子生成H,进而生成H2;CO在Zn表面生成。
17.(1) N2、H2在温度较高的Fe表面共价键断裂生成N、H,随后N、H在温度较低的TiO2–xHy表面生成NH3 N≡N在温度较高的Fe表面获得更多能量,断裂生成N速率加快,有利于提高合成氨反应速率,合成氨的正反应为放热反应,TiO2–xHy表面较低的温度促使平衡正向移动,有利于提高NH3的平衡产率 有利于平衡正向移动,利于N2、H2循环,提高NH3产率
(2) 6NO+4NH3 5N2+6H2O 2.4 在温度为500∼580K时,有氧条件下NO与O2反应生成NO2,更易与NH3反应,NO转化率明显增加
【详解】(1)根据反应机理可知,双温–双催化剂法的反应过程可描述为N2、H2在温度较高的Fe表面共价键断裂生成N、H,随后N、H在温度较低的TiO2–xHy表面生成NH3;从化学反应速率和化学平衡的角度出发,双温–双催化剂法的优点是:N≡N在温度较高的Fe表面获得更多能量,断裂生成N速率加快,有利于提高合成氨反应速率,合成氨的正反应为放热反应,TiO2–xHy表面较低的温度促使平衡正向移动,有利于提高NH3的平衡产率;合成氨过程中需要不断分离出氨,原因是有利于平衡正向移动,利于N2、H2循环,提高NH3产率;
(2)NH3与NO反应生成N2,同时生成水,反应的化学方程式为6NO+4NH3 5N2+6H2O;
反应中N元素由+2价降为0和从-3价升高为0价, 当生成1 mol N2时,转移的电子数为=2.4mol;在500~580 K之间,有氧气存在的条件下NO生成N2的转化率明显高于无氧条件,可能的原因是在温度为500∼580K时,有氧条件下NO与O2反应生成NO2,更易与NH3反应,NO转化率明显增加。
江苏省扬州市高邮市2023-2024学年高二上学期开学考试化学试题(含答案): 这是一份江苏省扬州市高邮市2023-2024学年高二上学期开学考试化学试题(含答案),共10页。试卷主要包含了5Cr-52,氯水中存在反应等内容,欢迎下载使用。
江苏省扬州市高邮市2023-2024学年高二上学期开学考试化学试题: 这是一份江苏省扬州市高邮市2023-2024学年高二上学期开学考试化学试题,共5页。试卷主要包含了0500 ml·L-1 ×12,0×10-4ml等内容,欢迎下载使用。
江苏省扬州市2022-2023学年高二下学期期末考试化学试题: 这是一份江苏省扬州市2022-2023学年高二下学期期末考试化学试题,文件包含高二化学docx、化学试卷答案pdf等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。












