

查补易混易错02 阿伏加德罗常数的判断-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版)
展开查补易混易错02 阿伏加德罗常数的判断
判断一定量的物质中所含某种粒子数目的多少,是高考命题的热点之一。命题者青睐将阿伏加德罗常数与气体摩尔体积(涉及外界条件、物质状态等)、物质结构(涉及质子数、中子数、电子数、化学键数等)、电离与水解(涉及弱电解质的电离特点及盐类的水解特点、溶液中离子浓度)、氧化还原反应(涉及电子转移数目)、可逆反应等结合。阿伏加德罗常数类试题具有较强的综合性,在复习备考中除了需要注意相关的解题技巧外,还需要对相关知识有比较深入的认识,将知识准确、合理的应用。以阿伏加德罗常数为基础点进行辐射,将相关知识总结归纳,在准确把握各量与阿伏加德罗常数之间关系的前提下,着重关注易错点,并通过练习加强理解掌握,这样才能通过复习切实提高得分率。
易错常设陷阱
物质的状态
气体摩尔体积适用的对象是气体(包括混合气体)
在使用标准状况下气体摩尔体积“22.4 L·mol-1”时,要判断气体是否处于标准状况
在标准状况下物质的状态不是气态,而是液态或固态的有:水、溴单质、苯、SO3、乙醇、四氯化碳、二硫化碳、氯仿、碳原子数大于4小于16的烃为液态(新戊烷除外)、大于或等于16的烃为固态等
粒子个数
确定粒子个数要弄清楚微粒中相关粒子(质子、中子、电子)及离子、化学键之间的数量关系
单原子分子:稀有气体He、Ne等;双原子分子:Cl2、N2、O2、H2等;特殊物质:O3、P4、18O2、D2O、Na2O2、 CO2、甲烷、乙烯、乙炔等
最简式相同的物质,无论以何种质量比混合,原子个数均以最简式计算。如O2和O3、NO2和N2O4、烯烃和环烷烃等
同位素
如D2O、T2O、18O2、14CO2等因物质的摩尔质量发生变化,导致物质的量变化
σ键和π键
有机物分子中单键为σ键,双键中含有1个σ键和1个π键,三键中含有1个σ键和2个π键
溶液的体积
已知溶液的浓度,缺少溶液的体积,是不能计算溶质的物质的量的。
转移电子的数目
如1 mol Na2O2与H2O(或CO2)反应、1 mol Cl2与足量的Fe反应(或NaOH溶液反应)、1 mol Cu与足量的稀硝酸反应等
可逆反应
可逆反应不能进行到底,如2NO2 N2O4,Cl2+H2OHClO+HCl等
水解反应
在水中某些离子能发生水解反应,离子数目发生改变。如0.1 mol FeCl3溶液中的Fe3+数目小于0.1NA 、0.1 mol Na2CO3溶液中含CO32—数小于0.1NA
1.(2022秋·浙江金华·高三校考阶段练习)为阿伏加德罗常数的值,下列说法正确的是
A.25℃,下,氢气中质子的数目为
B.溶液中,的数目为
C.苯甲酸完全燃烧,生成的数目为
D.电解熔融,阴极增重,外电路中通过电子的数目为
2.(2023春·江西宜春·高二校考开学考试)为阿伏加德罗常数的值,下列说法正确的是
A.中含有个阳离子
B.乙烷和丙烯的混合气体中所含碳氢键数为
C.含有中子数为
D.和于密闭容器中充分反应后,分子总数为
3.(2023·陕西咸阳·统考一模)代表阿伏加德罗常数的值。下列说法正确的是
A.含有的中子数为
B.乙烯和乙烷的混合气体中所含的分子数为
C.与在密闭容器中充分反应后的分子数小于
D.在的溶液中,由于水解导致溶液中阴离子总数小于
4.(2020·四川遂宁·四川省遂宁市第二中学校校考三模)设NA为阿伏伽德罗常数的值。下列说法正确的是
A.标准状况下, L的C2H4和C3H6的混合物中含有的碳碳双键数目为NA
B.100 g 质量分数17%H2O2溶液中极性键数目为NA
C.1 L0.1mol K2Cr2O7溶液中含铬的离子总数为0.2NA
D.65 g Zn溶于浓硫酸中得混合气体的分子数为NA
5.(2023秋·湖南株洲·高三株洲市第一中学校考阶段练习)设NA代表阿伏加德罗常量的值。下列说法正确的是
A.100g46%乙醇溶液中含有的氧原子数为4NA
B.标准状况下,11.2L乙烷和乙烯混合物中含有的氢原子数为2.5NA
C.2molNO与1molO2在密闭容器中充分反应后,容器中的分子总数为2NA
D.用铜作电极电解饱和NaCl溶液,当电路上通过0.2mole-时,阴、阳两极产生的气体分子总数为0.2NA
6.(2022秋·重庆九龙坡·高三重庆市育才中学校考期中)为阿伏加德罗常数的值,下列说法正确的是
A.中含有的碳氢键数目不一定为
B.标准状况下,中含有电子数为
C.水溶液中含有的氧原子数为
D.一定条件下,足量的与充分反应,转移电子的数目为
7.(2023春·湖南永州·高三永州市第一中学校考阶段练习)设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值,下列说法正确的是
A.23gC2H5OH中C—H单键的数目为6NA
B.20gND3溶于水形成的氨水溶液中质子数约为10NA
C.常温下,pH=2的磷酸溶液中H+数目为0.01NA
D.2SO2+O2⇌2SO3,则每1mol[2SO2+O2]完全反应转移的电子数等于4NA
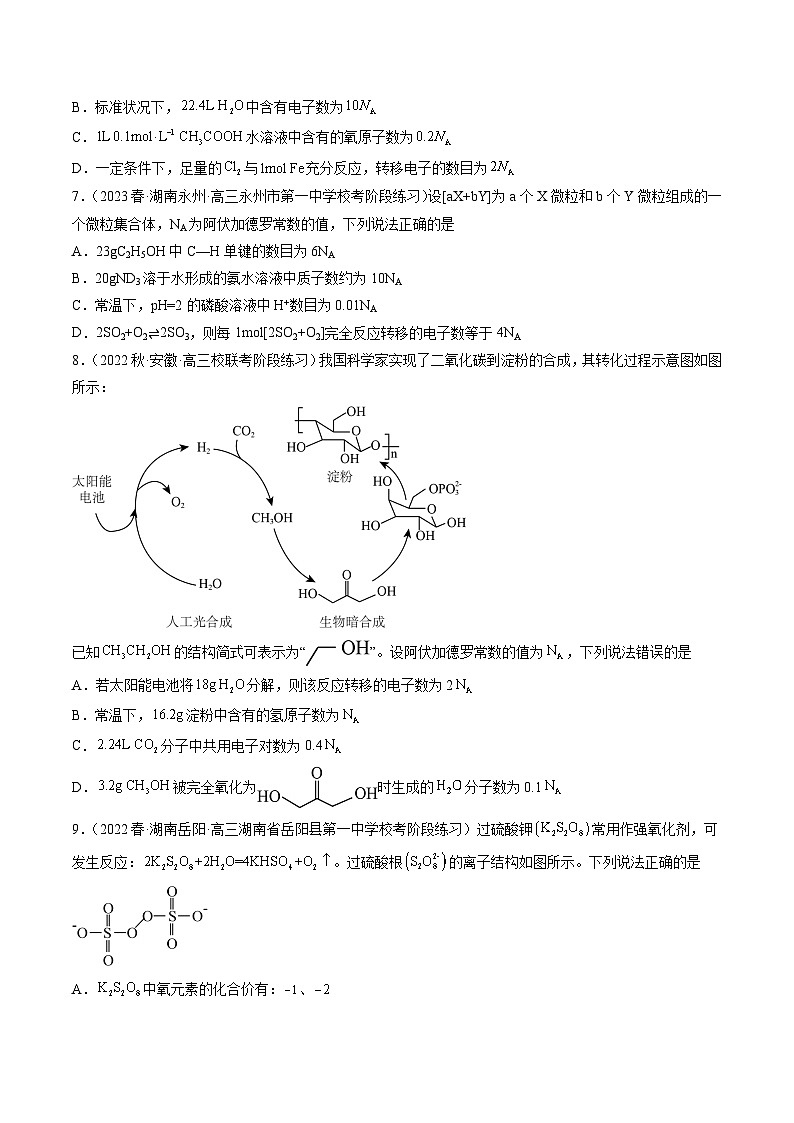
8.(2022秋·安徽·高三校联考阶段练习)我国科学家实现了二氧化碳到淀粉的合成,其转化过程示意图如图所示:
已知的结构简式可表示为“”。设阿伏加德罗常数的值为,下列说法错误的是
A.若太阳能电池将分解,则该反应转移的电子数为2
B.常温下,淀粉中含有的氢原子数为
C.分子中共用电子对数为0.4
D.被完全氧化为时生成的分子数为0.1
9.(2022春·湖南岳阳·高三湖南省岳阳县第一中学校考阶段练习)过硫酸钾常用作强氧化剂,可发生反应:。过硫酸根的离子结构如图所示。下列说法正确的是
A.中氧元素的化合价有:、
B.中含极性共价键
C.固体中阴阳离子总数为
D.和水反应产生
10.(2023·湖北·高三统考专题练习)高效率和高选择性将CO2转化为CH4是CO2资源化利用的途径之一,我国科研工作者开发了一种空腔串联反应器,为电催化还原CO2提供了一种可行的转化方案,其原理如图所示。
设NA为阿伏加德罗常数的值,下列说法正确的是
A.22gCO2中所含共用电子对数目为4NA
B.1molCH4中所含质子数和中子数均为10NA
C.途径2生成标准状况下22.4LCH4,反应转移电子数为8NA
D.途径1所得产物物质的量之比为l:1,形成共价键数目为6NA
11.(2023·河北保定·统考一模)工业合成氨常选择,为阿伏加德罗常数的值,下列说法正确的是
A.1 mol完全反应,转移的电子数为3
B.混合气中物质的沸点由高到低的顺序为
C.物质的量之比为1∶1的和的混合气体所含原子数目为4
D.反应物断裂个σ键同时生成物断裂个σ键,反应达到平衡状态
12.(2023·福建福州·统考模拟预测)设是阿伏加德罗常数的值,催化氧化脱硫的工作原理:,时,。下列说法正确的是
A.水中含有的氢键数为2
B.每生成,失去的电子数为
C.氢氧化铁的悬浊液中,若时,悬浊液中的数目为
D.反应中每产生,消耗数目
13.(2023春·全国·高三统考期中)我国科研团队在人工合成淀粉方面取得突破性进展,通过、制得,进而合成了淀粉。用代表阿伏加德罗常数的值,下列说法正确的是。
A.和混合气体的分子数为
B.通过与制得,转移电子数为
C.标准状况下,中含有的C—H键
D.淀粉中含C原子数为
14.(2023·福建·统考模拟预测)阿伏伽德罗提出阿伏伽德罗定律为人类科学研究提供了重要的理论基础,在现实生活中我们常常利用物质的量来为难以用实际数字描述的数量做了定量解释,下列说法正确的是
A.1.5mol的液态冰醋酸中含s−p σ键0个
B.常温常压下,1mol含有的
C.将0.1mol醋酸钠溶于稀醋酸中使溶液呈中性,溶液中数目小于
D.1L1 mol∙L−1NaCl溶液含有个电子
15.(2022秋·广东汕尾·高三统考期末)中国的酒文化源远流长,酿酒的转化过程如下: 。设 NA为阿伏加德罗常数,则下列说法正确的是
A.淀粉和纤维素互为同分异构体
B.1mol葡萄糖中含碳原子数为6NA
C.医用消毒酒精中乙醇的体积分数为95%
D.标准状况下,11.2LCO2中σ键的数目为2NA
16.(2022秋·河北·高三校联考专题练习)科学家进行如图所示的制备及应用的研究,下列说法不正确的是
A.中C原子的杂化类型为
B.含有约个电子
C.和合成甲醇符合原子利用率100%
D.图中涉及反应包含非极性键的断裂和生成
17.(2022秋·广东·高三校联考阶段练习)催化HCHO氧化为的历程如下图所示,设为阿伏伽德罗常数的值,下列说法正确的是
A.反应②③④中C的化合价均发生了变化
B.若有22.4LHCHO参加反应,转移的电子数为
C.历程中既有非极性键和极性键的断裂,也有极性键的形成
D.16g中所含的电子总数为
18.(2022·全国·高三专题练习)是21世纪理想的能源,工业上制备氢气的常见方法有以下三种:①电解水法制备;②水煤气法制备;③电解饱和食盐水法制备。设NA为阿伏加德罗常数的值,下列说法正确的是
A.方法①中,当阴极产生a mol气体时,转移的电子数为4aNA
B.方法②中,制备22.4L时,断裂的极性键的数目为NA
C.方法③中,每电解117gNaCl时,产生的气体的分子数为NA
D.用这三种方法分别制备1mol,转移的电子数均为2NA
19.(2022春·河北·高三校联考阶段练习)是阿伏加德罗常数的值,下列说法正确的是
A.等质量的和的质子数均为
B.反应中,生成气体时转移个电子
C.已知,等物质的量浓度的溶液和溶液中
D.非环状有机物中碳氢键的数目为
20.(2023·全国·高三专题练习)南京大学科研团队首次发现氨还原过程中的多米诺效应:即一旦完成第①步,将自发完成后续步骤,反应过程示意图如下。NA表示阿伏伽德罗常数的值,下列说法正确的是
A.含有NA个价电子 B.中含有3NA个共价键
C.若参与第②步反应转移电子数为0.1NA D.①②③步反应均为氧化还原反应
参考答案
1.C【详解】A.25℃、101kPa不是标准状况,不能用标况下的气体摩尔体积计算氢气的物质的量,故A错误;
B.Al3+在溶液中会发生水解生成Al(OH)3,因此2.0L 1.0 mol/L的AlCl3溶液中Al3+数目小于2.0NA,故B错误;
C.苯甲酸燃烧的化学方程式为,1mol苯甲酸燃烧生成7molCO2,则0.2mol苯甲酸完全燃烧生成1.4molCO2,数目为1.4NA,故C正确;
D.电解熔融CuCl2时,阳极反应为,阴极反应为,阴极增加的重量为Cu的质量,6.4gCu的物质的量为0.1mol,根据阴极反应可知,外电路中通过电子的物质的量为0.2mol,数目为0.2NA,故D错误;
答案选C。
2.C【详解】A. 由钠离子和硫酸氢根离子构成,其中的阳离子只有钠离子,的物质的量为0.1mol,因此,其中只含有个阳离子,A说法不正确;
B.没有指明气体的温度和压强,无法确定乙烷和丙烯的混合气体的物质的量是多少,因此,无法确定其中所含碳氢键的数目,B说法不正确;
C.分子中有6个中子,的物质的量为0.5mol,因此,含有的中子数为,C说法正确;
D.和发生反应生成,该反应是可逆反应,反应物不能完全转化为生成物,因此,和于密闭容器中充分反应后,分子总数小于,D说法不正确。
综上所述,本题选C。
3.C【详解】A.1个中含有中子数=18-8=10,的物质的量小于1mol,所以含有的中子数小于,A错误;
B.未说明标准状况,无法利用标况下的气体摩尔体积计算器分子数,B错误;
C.与在密闭容器中发生反应,产物的分子数为,但同时存在平衡,所以分子数小于,C正确;
D.溶液中的水解方程式,消耗1mol碳酸根时生成2mol阴离子,故阴离子总数大于,D错误;
答案选C。
4.D【详解】A. C3H6可以是环烷烃,不含碳碳双键,故A错误;
B. H2O2溶液中含有极性键的是H2O2和H2O,100 g 质量分数17%H2O2溶液中含有极性键的物质的量为()mol>1mol,故B错误;
C. K2Cr2O7溶液中存在Cr2O72-+H2O 2 H++2CrO42-,因此溶液中含铬的离子总物质的量不等于0.2mol,故C错误;
D. 锌和浓硫酸反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O,锌和稀硫酸反应:Zn+H2SO4=ZnSO4+H2↑,65 g Zn完全溶于浓硫酸中,无论得到SO2还是H2还是混合气体,得到分子数都为NA,故D正确;
答案:D。
5.A【详解】A.100g46%乙醇溶液中含有乙醇的物质的量为=1mol,含有水的物质的量为=3mol,则含有的氧原子数为NA +3NA =4NA,故A正确;
B.标准状况下,11.2L乙烷和乙烯混合物的物质的量为=0.5mol,由于乙烷和乙烯分子中含有的氢原子数不同,故不能确定0.5mol混合气体中含有的氢原子数,故B错误;
C.2molNO与1molO2在密闭容器中充分反应恰好生成2molNO2,由于存在平衡2NO2N2O4,容器中的分子总数小于2NA,故C错误;
D.用铜作电极电解饱和NaCl溶液,阳极反应为铜失电子,无气体产生,阴极水电离出的氢离子放电生成氢气,根据电路中通过的电子可知产生0.1mol氢气,故D错误;
答案选A。
6.A【详解】A.C2H6O可能是CH3CH2OH,也可能是CH3OCH3,故1molC2H6O中含有的碳氢键数目前者为5NA,后者为6NA,即不一定为,A正确;
B.标准状况下H2O是液体,不能用气体摩尔体积计算其物质的量,则中含有电子数无法计算,B错误;
C.由于水中也含有氧原子,故水溶液中含有的氧原子数远大于,且无法计算,C错误;
D.铁与氯气反应转化为氯化铁,故一定条件下,足量的与充分反应,转移电子的数目为,D错误;
故答案为:A。
7.D【详解】A.23gC2H5OH的物质的量为=0.5mol,一个C2H5OH分子含有5个C-H键,所以23gC2H5OH中C—H单键的数目为2.5 NA,A错误;
B.20gND3的物质的量为=1mol,但溶于水形成的氨水溶液中除了ND3中含有质子外,还有H2O中的质子,所以无法确定质子数,B错误;
C.溶液体积未知,无法确定溶液中的微粒数目,C错误;
D.每1mol[2SO2+O2]完全反应,则有1molO2被还原,转移的电子数等于4NA,D正确;
综上所述答案为D。
8.C【详解】A.分解生成和,为,转移的电子数为,A正确;
B.淀粉的分子式为,,淀粉中含有的氢原子数为,B正确;
C.没有说明的状况,不能确定所含分子数,不能计算共用电子对数,C错误;
D.的分子式为,,为,生成的分子数为,D正确;
故选C。
9.A【详解】A.由结构可知,分子结构的中间存在过氧根,过氧根中氧为-1价氧,与每个硫相连的其它氧为-2价氧, A正确;
B.过氧根中氧氧键为非极性键,1个过硫酸根中含有12个极性共价键,中含极性共价键,B错误;
C.固体中含有K+和HSO两种离子,则固体中阴阳离子总数为,C错误;
D.没有说明是否为标况,不能计算生成氧气的体积,D错误;
故选A。
10.C【详解】A.CO2的结构式为C=O=C,含有4个共用电子对,22gCO2的物质的量为=0.5mol,所含共用电子对数目为2NA,故A错误;
B.CH4中含有10个质子,6个中子,则1molCH4中含有10 NA个质子和6 NA个中子,故B错误;
C.标准状况下22.4LCH4的物质的量为1mol,途径2生成CH4的过程中C元素化合价由+4价下降到-4价,反应转移电子数为8NA,故C正确;
D.未说明所得产物物质的量,无法计算形成共价键数目,故D错误;
故选C。
11.B【详解】A.反应中氮元素化合价由0变为-3,则1 mol完全反应,转移的电子数为6,A错误;
B.氨气分子间存在氢键,导致沸点最高;氮气的相对分子质量大于氢气,其沸点高于氢气,故混合气中物质的沸点由高到低的顺序为,B正确;
C.不确定混合气体的总的物质的量,不能计算和的混合气体中所含原子数目,C错误;
D.单键均为σ键,叁键含有1个σ键2个π键;1个氮气分子含有2个π键和1个σ键,1分子氢气含有1个σ键,1分子氨气含有3个σ键,则反应物断裂个σ键同时生成物断裂个σ键,说明正逆反应速率不同,反应没有达到平衡状态,D错误;
故选B。
12.B【详解】A.1个水分子最多与周围相邻的水分子形成4个氢键,根据均摊原则,1mol水分子成冰时最多形成的氢键数为2,所以液态水形成的氢键数小于2,故A错误;
B.Fe元素化合价由+2升高为+3、S元素化合价由-2价升高为0,每生成,失去的电子数为,故B正确;
C.没有明确溶液体积,不能计算悬浊液中的数目,故C错误;
D.根据反应方程式,反应中每产生,消耗数目,故D错误;
选B。
13.D【详解】A.和混合气体的分子数为0.2mol×NAmol-1=0.2NA,A错误;
B.根据反应方程式:CO2+3H2=CH3OH+H2O可转移电子数目为6e-,通过与制得即=1mol,则转移电子数为,B错误;
C.由于标准状况下CH3OH为液体,则无法计算中含有的C—H键,C错误;
D.淀粉中含C原子数为=,D正确;
故答案为:D。
14.A【详解】A.CH3COOH中C、O经过杂化后与H形成σ键,因此1.5mol的液态冰醋酸中含s−p σ键数目为0,故A正确;
B.常温常压下,1mol含有的,故B错误;
C.将0.1mol醋酸钠溶于稀醋酸中使溶液呈中性,根据电荷守恒得到钠离子数目等于醋酸根离子数目即溶液中数目等于,故C错误;
D.1L1 mol∙L−1NaCl溶液NaCl物质的量为1mol,NaCl含有个电子,但溶液中还有水,水中含有电子,故D错误。
综上所述,答案为A。
15.B【详解】A.纤维素和淀粉都是多糖,分子式都可用(C6H10O5)n表示,但两者的n不同,它们不是同分异构体,A错误;
B.葡萄糖的分子式为C6H12O6,1mol葡萄糖中含碳原子数为6NA,B正确;
C.医用消毒酒精中乙醇的浓度为75%,C错误;
D.标准状况下,11.2LCO2的物质的量为0.5mol,每个CO2分子中σ键的数目为2个,0.5mol CO2中σ键的数目为1NA,D错误;
答案选B。
16.C【详解】A.中C原子形成4个共价键,杂化类型为,A正确;
B.1分子二氧化碳含有22个电子,则含有电子22mol,数目约个电子,B正确;
C.中碳氧原子个数为1:2,甲醇中碳氧原子个数为1:1,故和合成甲醇原子利用率不会是100%,C错误;
D.图中H2参与反应,涉及非极性键的断裂,氯碱工业生成H2和Cl2涉及非极性键的形成,D正确;
故选C。
17.C【详解】A.④中生成CO2过程中C元素的化合价都是+4价,化合价没有变化,故A错误;
B.没有说明标准状况无法计算,故B错误;
C.O2中非极性键断裂,HCHO中C-H极性键断裂,有H2O生成,即有极性键形成,故C正确;
D.16g为0.5mol,每个中含有17个电子,0.5mol中所含的电子总数为,故D错误;
故答案为C。
18.D【详解】A.方法①为电解水法,阴极发生还原反应产生H2,amolH2生成转移电子数为2aNA,A错误;
B.未说明标准状况,气体体积不能进行计算,B错误;
C.电解117gNaCl即2mol将生成1molCl2和1molH2,共2mol气体,C错误;
D.这三种方法对应的三个氧化还原反应中H2O都只作且是唯一的氧化剂,H2O中的H元素得2mol电子生成1molH2,D正确;
答案选D。
19.C【详解】A.未指明质量均为,A错误;
B.未指明状态,无法运用气体摩尔体积计算物质的量,B错误;
C.,等物质的量浓度的和的水解程度相同,故,C正确;
D.非环状有机物可能是,碳氢键的数目不能确定,D错误。
故选C。
20.C【详解】A.的物质的量不确定,无法计算含有的价电子个数,A错误;
B.是离子化合物,只有离子键,B错误;
C.的物质的量是0.1mol,参与第②步反应时化合价从0价升高到+1价,则转移电子数为0.1NA,C正确;
D.第③步反应是氢离子和氨气反应生成铵根,是非氧化还原反应,D错误;
答案选C。
查补易混易错13 化学反应机理-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版): 这是一份查补易混易错13 化学反应机理-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版),共19页。试卷主要包含了水煤气变换反应为 等内容,欢迎下载使用。
查补易混易错10 化学实验基础-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版): 这是一份查补易混易错10 化学实验基础-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版),共27页。试卷主要包含了化学实验操作中的“第一步”,化学实验操作要点,下列实验装置或现象错误的是,下列实验能达到目的的是,为探究的性质,进行了如下实验等内容,欢迎下载使用。
查补易混易错04 离子反应-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版): 这是一份查补易混易错04 离子反应-【查漏补缺】2023年高考化学三轮冲刺过关(全国通用)(解析版),共18页。试卷主要包含了HCOeq \\al等内容,欢迎下载使用。












