

高考化学考前冲刺 考前天天练 六(含答案解析)
展开2020年高考化学考前冲刺 考前天天练 六
1.FeCl3是一种很重要的铁盐,主要用于污水处理,具有效果好、价格便宜等优点。工业上可将铁屑溶于盐酸中,先生成FeCl2,再通入Cl2氧化来制备FeCl3溶液。
(1)将标准状况下的a L氯化氢气体溶于100 g水中,得到盐酸的密度为b g·mL-1,则该盐酸的物质的量浓度是________。
(2)向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为________。
(3)FeCl3溶液可以用来净水,其净水的原理为___________________(用离子方程式表示)。用100 mL 2 mol·L-1的FeCl3溶液净水时,生成具有净水作用的微粒数________(填“大于”“等于”或“小于”)0.2NA。
2.化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:
已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G的分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1 mol的L可与2 mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
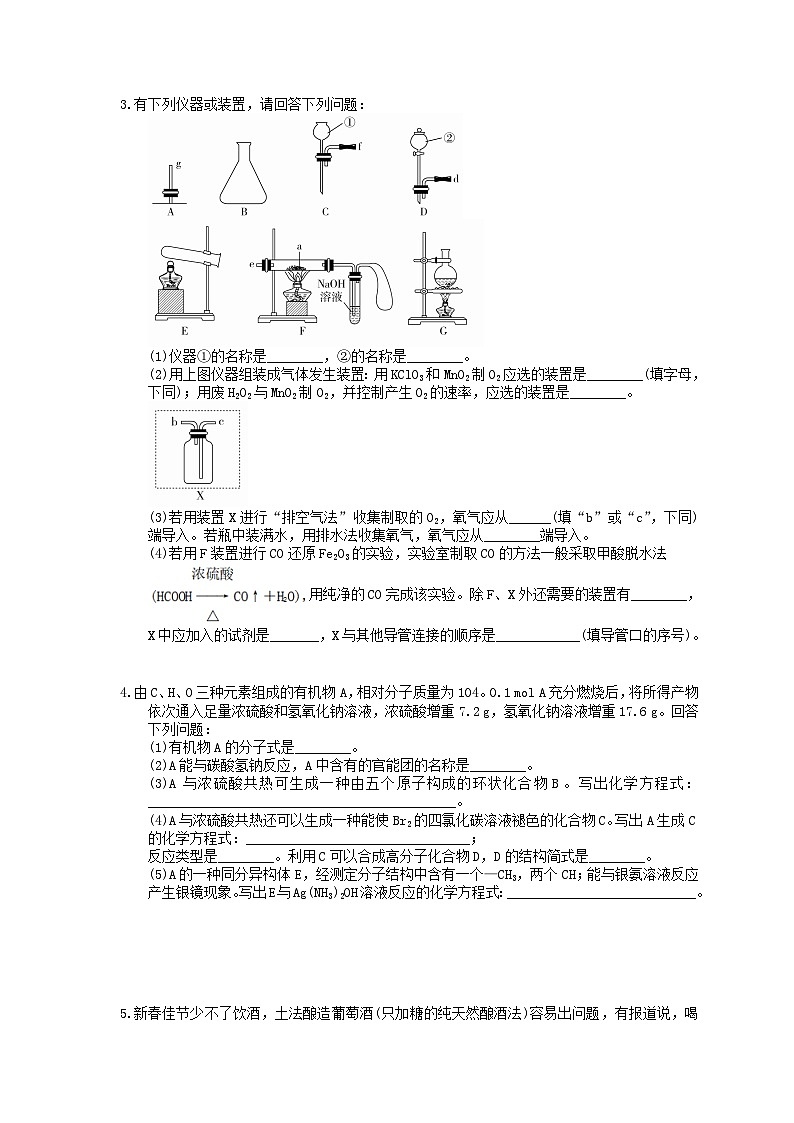
3.有下列仪器或装置,请回答下列问题:
(1)仪器①的名称是________,②的名称是________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母,下同);用废H2O2与MnO2制O2,并控制产生O2的速率,应选的装置是________。
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从______(填“b”或“c”,下同)端导入。若瓶中装满水,用排水法收集氧气,氧气应从________端导入。
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法
用纯净的CO完成该实验。除F、X外还需要的装置有________,
X中应加入的试剂是_______,X与其他导管连接的顺序是____________(填导管口的序号)。
4.由C、H、O三种元素组成的有机物A,相对分子质量为104。0.1 mol A充分燃烧后,将所得产物依次通入足量浓硫酸和氢氧化钠溶液,浓硫酸增重7.2 g,氢氧化钠溶液增重17.6 g。回答下列问题:
(1)有机物A的分子式是________。
(2)A能与碳酸氢钠反应,A中含有的官能团的名称是________。
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B。写出化学方程式:____________________________________________。
(4)A与浓硫酸共热还可以生成一种能使Br2的四氯化碳溶液褪色的化合物C。写出A生成C的化学方程式:________________________________;
反应类型是________。利用C可以合成高分子化合物D,D的结构简式是________。
(5)A的一种同分异构体E,经测定分子结构中含有一个—CH3,两个CH;能与银氨溶液反应产生银镜现象。写出E与Ag(NH3)2OH溶液反应的化学方程式:___________________________。
5.新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B.氧化细菌 C.增酸作用 D.漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:
(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
答案解析
1.答案为:
(1) mol·L-1
(2)2 mol·L-1
(3)Fe3++3H2OFe(OH)3(胶体)+3H+ 小于;
解析:
(1)注意盐酸的体积不是100 g水的体积,要用所得盐酸的质量和密度计算,还应注意单位换算。
(2)根据氧化还原反应的规律,氯气先氧化Fe2+,反应后溶液中Cl-和Br-的物质的量浓度相等,表明溶液中无Fe2+,有FeBr3、FeCl3,n(Cl-)=×2=0.3 mol=n(Br-),根据电荷守恒及原子守恒知,n(Fe3+)=0.2 mol=n(Fe2+),则c(FeBr2)==2 mol·L-1。
(3)Fe3+在水中发生水解:Fe3++3H2OFe(OH)3(胶体)+3H+,生成的Fe(OH)3胶体具有吸附作用,可吸附溶液中的杂质离子。Fe3+的水解是可逆反应,且Fe(OH)3胶体中的胶体粒子是由多个Fe(OH)3组成的集合体,所以生成的Fe(OH)3胶体粒子数目小于0.2NA。
2.答案为:
(1)
(2)2-丙醇(或异丙醇)
(3)
(4)取代反应
(5)C18H31NO4
(6)6
解析:A的化学式为C2H4O,其核磁共振氢谱为单峰,则A为;B的化学式为C3H8O,核磁共振氢谱为三组峰,峰面积比为6∶1∶1,则B的结构简式为CH3CH(OH)CH3;D的化学式为C7H8O2,其苯环上仅有两种不同化学环境的氢,1 mol D可与1 mol NaOH或2 mol Na反应,则苯环上有酚羟基和—CH2OH,且为对位结构,则D的结构简式为。
(1)根据上述分析,A的结构简式为。
(2)根据上述分析B的结构简式为CH3CH(OH)CH3,依据醇的命名,其化学名称为2-丙醇或异丙醇。
(3)HOCH2CH2OCH(CH3)2和发生反应生成E的化学方程式为:
。
(4)的分子式为C3H5OCl,E的分子式为C12H18O3,E与的分子式之和比F的分子式少了一个HCl,则E和发生了取代反应生成F。
(5)根据有机物成键特点,有机物G的分子式为C18H31NO4。
(6)L是的同分异构体,可与FeCl3溶液发生显色反应,说明含有酚羟基,1 mol的L可与2 mol的Na2CO3反应,说明L的分子结构中含有2个酚羟基和一个甲基,当二个酚羟基在邻位时,苯环上甲基的位置有2种,当二个酚羟基在间位时,苯环上甲基的位置有3种,当二个酚羟基在对位时,苯环上甲基的位置有1种,满足条件的L共有6种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为、。
3.答案为:
(1)长颈漏斗'分液漏斗'
(2)AE'BD
(3)c'b
(4)DG'浓硫酸'dcbe
解析:
(2)KClO3和MnO2制O2属于“固+固气体”,因而要选用E装置为气体发生装置;H2O2与MnO2制O2属于“固+液―→气体”且要控制产生气体的速率,只能用分液漏斗控制加入的H2O2的量。
(3)使用X收集氧气时,用“排空气法”,由于O2的密度比空气的大,应从长管进气,用排水法收集气体,应从短管进气。
(4)根据反应原理可知制取CO属于“液+液气体”,用分液漏斗控制加入浓硫酸的量,应选D、G为气体发生装置,X的作用是除去CO中的水蒸气,洗气时气体流向为“长进短出”。
4.答案为:
(1)C4H8O3
(2)羧基
(3)+H2O
(4)CH2=CH—CH2—COOH+H2O 消去反应
(5)+2[Ag(NH3)2]OH+3NH3+2Ag↓+H2O
解析:
(1)0.1 mol A充分燃烧后,将所得产物依次通入足量浓硫酸和氢氧化钠溶液,浓硫酸增重7.2 g,即0.1 mol A充分燃烧后生成水的物质的量为0.4 mol,氢氧化钠溶液增重17.6 g,
即0.1 mol A充分燃烧后生成二氧化碳的物质的量为0.4 mol,可知A分子中有4个碳原子和8个氢原子,由C、H、O三种元素组成的有机物A的相对分子质量为104,
所以A分子中含有氧原子数为=3,据此可以确定A的分子式为C4H8O3。
(3)A与浓硫酸共热可生成一种由五个原子构成的环状化合物B,所以A中含有羟基和羧基,在浓硫酸作用下发生分子内酯化反应形成五元环状酯,所以A为HOCH2CH2CH2COOH。
(4)A与浓硫酸共热还可以生成一种能使Br2的四氯化碳溶液褪色的化合物C,则C为CH2=CHCH2COOH,C发生加聚反应可以合成高分子化合物。
(5)A的一种同分异构体E,经测定分子结构中含有一个—CH3,两个,能与银氨溶液反应产生银镜现象,则E中有醛基,所以E为CH3CH(OH)CH(OH)CHO。
5.答案为:AC 不合理;实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量很低,所以也不能使品红褪色 Na2SO3 +H2SO4 = Na2SO4 + SO2↑+ H2O 4NA 酸性KMnO4 2MnO4— + 5SO2 +2 H2O = 2Mn2+ + 5SO42— + 4H+(或FeCl3溶液,SO2 +2 Fe3+ +2 H2O = 2 Fe 2+ + SO42— + 4H+)
红色溶液变浅或褪色(或溶液由棕黄色变为浅绿色)
解析:
(1)二氧化硫具有较强的还原性,可以防止葡萄酒被氧化,二氧化硫的水溶液显酸性,可以增强葡萄酒的酸性,二氧化硫有漂白性,但二氧化硫的含量很少,没有将葡萄酒漂白,故选AC;
I.
(2)1滴饱和亚硫酸溶液滴入3mL品红溶液中不褪色,而1滴品红溶液滴入3mL饱和亚硫酸溶液中褪色,说明二氧化硫或亚硫酸的含量会影响漂白效果,干白葡萄酒不能使品红溶液褪色,原因为:干白中二氧化硫或亚硫酸含量太少,故答案为:不合理,实验对比说明浓度低的亚硫酸不能使品红褪色,葡萄酒中的SO2含量很低,所以也不能使品红褪色;
Ⅱ.实验方案二:装置A中制备二氧化硫,X干燥二氧化硫,C中检验SO2与Na2O2反应是否有氧气,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置验证二氧化硫的还原性,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,A装置中亚硫酸钠与浓硫酸反应放出二氧化硫,二氧化硫被干燥后与过氧化钠反应生成硫酸钠,反应的方程式为SO2+Na2O2=Na2SO4,根据方程式,每消耗2molNa2O2,转移4mol电子,故答案为:SO2+Na2O2=Na2SO4;4NA;
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂选择酸性KMnO4,高锰酸钾具有强氧化性,被二氧化硫还原褪色,发生反应的离子方程式为2MnO4— + 5SO2 +2 H2O = 2Mn2+ + 5SO42— + 4H+(或FeCl3溶液,SO2 +2 Fe3+ +2 H2O = 2 Fe 2+ + SO42— + 4H+);故答案为:酸性KMnO4;2MnO4— + 5SO2 +2 H2O = 2Mn2+ + 5SO42— + 4H+(或FeCl3溶液,SO2 +2 Fe3+ +2 H2O = 2 Fe 2+ + SO42— + 4H+);红色溶液变浅或褪色(或溶液由棕黄色变为浅绿色)。
高考化学考前冲刺 考前天天练 一(含答案解析): 这是一份高考化学考前冲刺 考前天天练 一(含答案解析),共8页。试卷主要包含了8×10-5),4×10-3,等内容,欢迎下载使用。
高考化学考前冲刺 考前天天练 五(含答案解析): 这是一份高考化学考前冲刺 考前天天练 五(含答案解析),共6页。
高考化学考前冲刺 考前天天练 四(含答案解析): 这是一份高考化学考前冲刺 考前天天练 四(含答案解析),共6页。












