


所属成套资源:【同步讲义】高中化学(苏教版2019)选修第二册-同步讲义
【同步讲义】高中化学(苏教版2019)选修第二册--4.1.2 价层电子对互斥模型 讲义
展开这是一份【同步讲义】高中化学(苏教版2019)选修第二册--4.1.2 价层电子对互斥模型 讲义,文件包含同步讲义高中化学苏教版2019选修第二册--412价层电子对互斥模型学生版docx、同步讲义高中化学苏教版2019选修第二册--412价层电子对互斥模型教师版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
第2课时 价层电子对互斥模型
目标导航
1.了解价层电子对互斥模型,能用价层电子对互斥模型预测简单分子的空间构型。
2.了解等电子原理的内容。
知识精讲
知识点01 价层电子对互斥模型
1.价层电子对互斥模型的基本要点
(1)价电子对:包括孤电子对和成键电子对,即价电子对数=成键电子对数+孤电子对数。
在价层电子对互斥模型中,成键电子对数等于成键数目,不用区别单键还是双键。
(2)价电子对的几何构型:
分子中的价电子对由于相互排斥作用,而趋向于尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
价电子对数分别为2、3、4时,价电子对的几何分布分别为直线形、平面三角形、正四面体结构。
2.ABm型分子的价电子对数的计算方法
对于ABm型分子(A是中心原子,B是配位原子),分子的价电子对数可以通过下式确定:
价电子对数目(n)=
(1)中心原子的价电子数=最外层电子数;
(2)配位原子提供的价电子数:
①卤素原子、氢原子按提供1个价电子数计算。如PCl5中n==5。
②O、S作为配位原子时按不提供价电子计算。
(3)对于复杂离子,在计算价电子对数时,还应加上或减去离子所带的电荷数。如NH中n==4,SO中n==4。
(4)若剩余1个电子,即出现奇数电子,也把这个单电子当作1对电子处理。如NO2中n==3。
3.价电子对数与中心原子的杂化轨道类型
(1)价电子对数相同,中心原子的杂化轨道类型相同,价电子对分布的几何构型相同。即价电子对数=杂化轨道数。
(2)CH4、NH3、H2O分子的价电子对数都是4,中心原子的杂化轨道数目为4,杂化类型为sp3杂化,价电子对分布的几何构型为正四面体。
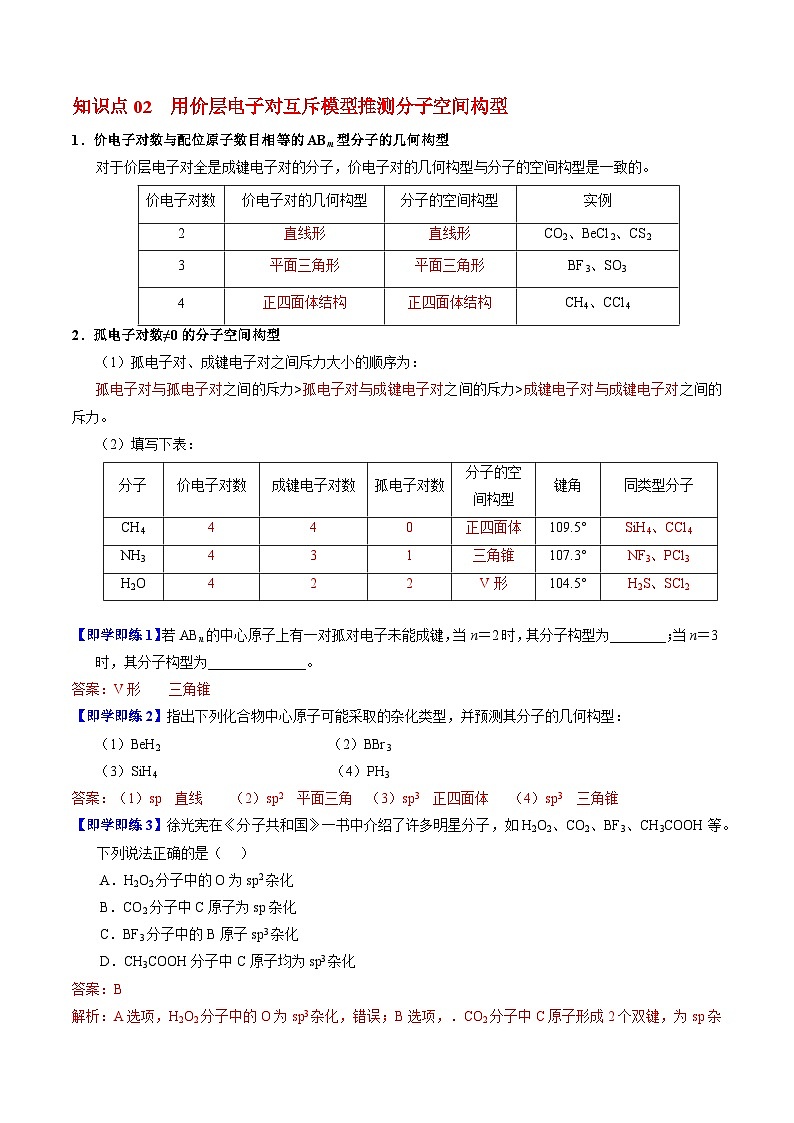
知识点02 用价层电子对互斥模型推测分子空间构型
1.价电子对数与配位原子数目相等的ABm型分子的几何构型
对于价层电子对全是成键电子对的分子,价电子对的几何构型与分子的空间构型是一致的。
价电子对数
价电子对的几何构型
分子的空间构型
实例
2
直线形
直线形
CO2、BeCl2、CS2
3
平面三角形
平面三角形
BF3、SO3
4
正四面体结构
正四面体结构
CH4、CCl4
2.孤电子对数≠0的分子空间构型
(1)孤电子对、成键电子对之间斥力大小的顺序为:
孤电子对与孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对与成键电子对之间的斥力。
(2)填写下表:
分子
价电子对数
成键电子对数
孤电子对数
分子的空间构型
键角
同类型分子
CH4
4
4
0
正四面体
109.5°
SiH4、CCl4
NH3
4
3
1
三角锥
107.3°
NF3、PCl3
H2O
4
2
2
V形
104.5°
H2S、SCl2
【即学即练1】若ABn的中心原子上有一对孤对电子未能成键,当n=2时,其分子构型为________;当n=3时,其分子构型为______________。
答案:V形 三角锥
【即学即练2】指出下列化合物中心原子可能采取的杂化类型,并预测其分子的几何构型:
(1)BeH2 (2)BBr3
(3)SiH4 (4)PH3
答案:(1)sp 直线 (2)sp2 平面三角 (3)sp3 正四面体 (4)sp3 三角锥
【即学即练3】徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。下列说法正确的是( )
A.H2O2分子中的O为sp2杂化
B.CO2分子中C原子为sp杂化
C.BF3分子中的B原子sp3杂化
D.CH3COOH分子中C原子均为sp3杂化
答案:B
解析:A选项,H2O2分子中的O为sp3杂化,错误;B选项,.CO2分子中C原子形成2个双键,为sp杂化,正确;C选项,BF3分子中的B原子sp2杂化,错误;D选项,CH3COOH分子中2个C原子分别为为sp3杂化和sp2杂化,错误。故选B。
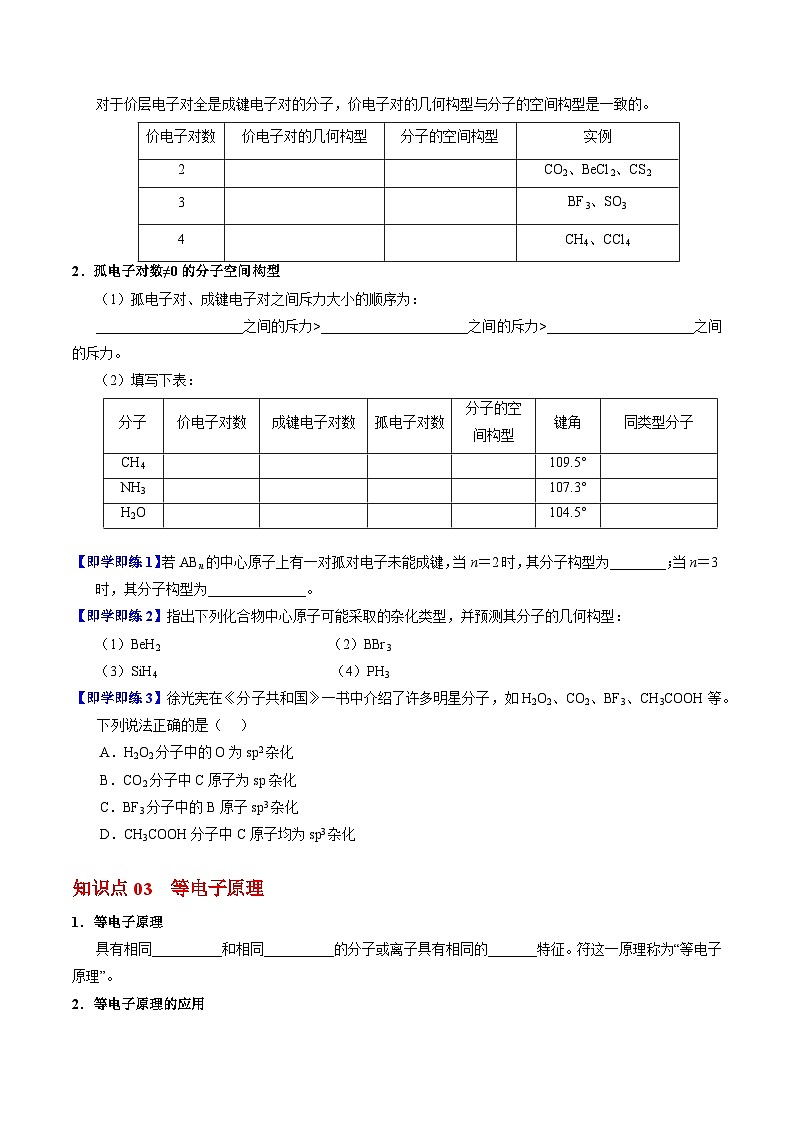
知识点03 等电子原理
1.等电子原理
具有相同价电子数和相同原子数的分子或离子具有相同的结构特征。符这一原理称为“等电子原理”。
2.等电子原理的应用
(1)判断一些简单分子或离子的立体结构:SiCl4、SiO、SO互为等电子体,空间结构为正四面体。
(2)判断分子的结构性质:CO和N2,它们的分子中价电子总数是10,都形成1个σ键和2个π键,CO的结构式为C≡O,CO和N2键能都较大,性质也相似。
(3)等电子原理在制造新材料方面的应用:晶体硅、锗、磷化铝(AlP)、砷化镓(GaAs)互为等电子体,都是良好的半导体材料。
【即学即练4】根据等电子原理,下列各组分子或离子的空间构型不相似的是( )
A.SO2和O3 B.NH4+和CH4 C.H3O+和NH3 D.CO2和H2O
答案:D
能力拓展
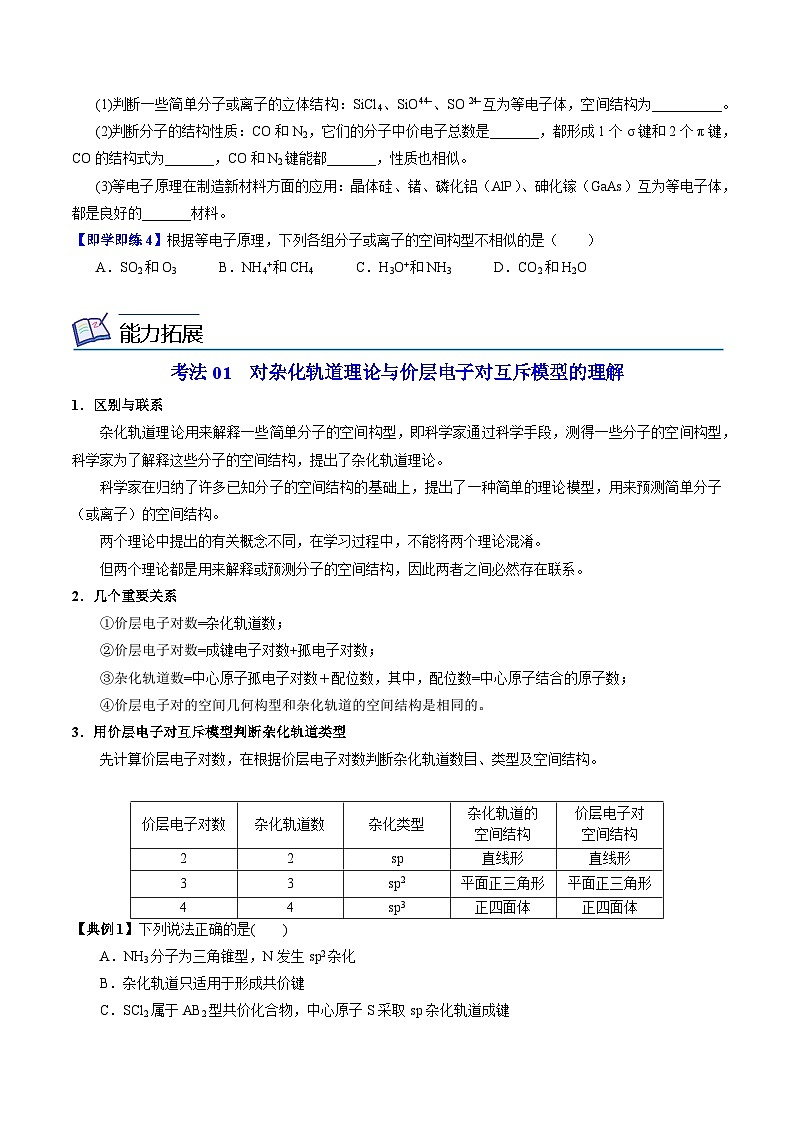
考法01 对杂化轨道理论与价层电子对互斥模型的理解
1.区别与联系
杂化轨道理论用来解释一些简单分子的空间构型,即科学家通过科学手段,测得一些分子的空间构型,科学家为了解释这些分子的空间结构,提出了杂化轨道理论。
科学家在归纳了许多已知分子的空间结构的基础上,提出了一种简单的理论模型,用来预测简单分子(或离子)的空间结构。
两个理论中提出的有关概念不同,在学习过程中,不能将两个理论混淆。
但两个理论都是用来解释或预测分子的空间结构,因此两者之间必然存在联系。
2.几个重要关系
①价层电子对数=杂化轨道数;
②价层电子对数=成键电子对数+孤电子对数;
③杂化轨道数=中心原子孤电子对数+配位数,其中,配位数=中心原子结合的原子数;
④价层电子对的空间几何构型和杂化轨道的空间结构是相同的。
3.用价层电子对互斥模型判断杂化轨道类型
先计算价层电子对数,在根据价层电子对数判断杂化轨道数目、类型及空间结构。
价层电子对数
杂化轨道数
杂化类型
杂化轨道的
空间结构
价层电子对
空间结构
2
2
sp
直线形
直线形
3
3
sp2
平面正三角形
平面正三角形
4
4
sp3
正四面体
正四面体
【典例1】下列说法正确的是( )
A.NH3分子为三角锥型,N发生sp2杂化
B.杂化轨道只适用于形成共价键
C.SCl2属于AB2型共价化合物,中心原子S采取sp杂化轨道成键
D.价层电子对互斥模型中,π键电子对数也要计入中心原子的价层电子对数
答:B
解析:NH3分子为三角锥型,N发生sp3杂化,A错误;杂化轨道只适用于形成共价键,因为必须形成共用电子对,所以不可能适用于离子键,故B正确;SCl2属于AB2型共价化合物,中心原子S采取sp3杂化轨道成键,分子空间构型为V形,不是直线形,故C错误;价层电子对互斥模型中,σ键和孤电子对计入中心原子的价层电子对数,而π键不计入,故D错误。
考法02 价层电子对互斥模型
1.确定中心原子价电子对数的方法
对于AXm型分子(A是中心原子,X是配位原子),分子的价电子对数可以通过下式确定:即n=。
规定:①作为配体,卤素原子和氢原子提供1个电子,氧族元素的原子不提供电子;
②作为中心原子,卤素原子按提供7个电子计算,氧族元素的原子按提供6个电子计算,即中心原子的价电子数等于中心原子的最外层电子数;
③对于复杂离子,在计算价电子对数时,还应加上阴离子的电荷数或减去阳离子的电荷数;
④计算价电子对数时,若剩余1个电子,亦当作1对电子处理;
⑤双键、三键等多重键作为1对电子看待。
2.判断分子的空间构型
根据价层电子对互斥理论,首先计算出价电子对数,价电子对数与杂化轨道数相同,再由杂化轨道数判断杂化类型。
根据成键电子对数与孤电子对数的关系,可以判断分子的空间构型。
价层电子对数
中心原子的杂化类型
成键电子对数
孤电子对数
分子的空间构型
实例
2
sp
2
0
直线形
CO2、CS2、BeCl2、NO
3
sp2
3
0
平面三角形
BF3、SO3、NO、CO、CH2O
2
1
V形
SO2、NO2、NO
4
sp3
4
0
正四面体
所有AB4型分子和离子
3
1
三角锥
NH3、NF3、PCl3、SO、ClO
2
2
V形
H2O、H2S、SCl2
3.根据已知分子结构判断杂化轨道类型
若已知分子结构,可以根据分子结构判断杂化轨道类型。
杂化轨道只能用于形成σ键或者用来容纳孤电子对,而两个原子之间只能形成一个σ键,故有下列关系:
杂化轨道数=中心原子孤电子对数+配位数,再由杂化轨道数判断杂化类型。例如:
代表物
杂化轨道数
杂化轨道类型
CO2
0+2=2
sp
CH2O
0+3=3
sp2
CH4
0+4=4
sp3
SO2
1+2=3
sp2
NH3
1+3=4
sp3
H2O
2+2=4
sp3
【典例2】(1) SO2中中心原子的价层电子对数为________,共价键的类型有________。
(2)SO中心原子轨道的杂化类型为________。
(3)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是________。
(4)固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为________。
答案:(1)3 σ键和π键 (2)sp3 (3)H2S (4)sp3
【解析】(1)SO2分子的中心原子S提供6个价电子,每个O原子提供0个单电子,所以S原子的价层电子对数为n==3,所以杂化轨道类型是sp2,SO2的结构式为,含有σ键和π键。
(2)SO中S原子的价层电子对数为n==4,则S为sp3杂化。
(3)根据价层电子对互斥理论,H2S、SO2、SO3的价层电子对数分别为n==4,n==3,n==3,因此中心原子价层电子对数不同于其他分子的是H2S。
(4)根据图可以得出固体三氧化硫中SO4原子团,为四面体构型,因此硫原子的杂化轨道类型为sp3。
考法03 等电子原理
1.等电子原理
(1)等电子原理是指原子总数相同、价电子总数相同的分子或离子具有相同的结构特征(立体结构和化学键类型),其性质相近。
等电子体的价电子总数相同,而组成原子的核外电子总数不一定相同。
2.等电子体实例
原子10电子 N2、CO、NO+、C、CNˉ 三键
二原子11电子 NO、O
二原子14电子 F2、O
三原子16电子 CO2、CS2、N2O、NO、N3ˉ、SCN- 直线形
三原子18电子 O3、SO2、NO V形
四原子24电子 BF3、NO、CO、SiO、SO3 平面三角形
四原子16电子 NF3、PCl3、SO、ClO3- 三角锥
五原子32电子 CCl4、SiF4、BF、SiO、PO SO、ClO 正四面体
【典例3】根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各微粒的电子总数相同,则互称为等电子体。以下各组微粒不是等电子体的是( )
A.CO和N2 B.O3和NO2- C.N2H4和C2H4 D.CO2和 N2O
答案:C
解析:N2H4中电子总数为18,C2H4中电子总数为16。
分层提分
题组A 基础过关练
1.下列关于杂化轨道的说法错误的是( )
A.所有原子轨道都参与杂化
B.同一原子中能量相近的原子轨道参与杂化
C.杂化轨道能量集中,有利于牢固成键
D.杂化轨道中不一定有电子
答案:A
解析:参与杂化的原子轨道,其能量不能相差太大,如 1s与2s、2p能量相差太大,不能形成杂化轨道,即只有能量相近的原子轨道才能参与杂化,故A项错误,B项正确;杂化轨道的电子云一头大一头小,成键时利用大的一头,可使电子云重叠程度更大,形成牢固的化学键,故C项正确;并不是所有的杂化轨道中都会有电子,也可以是空轨道,也可以有孤电子对(如 NH3、H2O的形成),故D项正确。
2.下列分子中中心原子是sp2杂化的是( )
A.PBr3 B.CH4 C.BF3 D.H2O
答案:C
解析:PBr3中P原子价层电子对数n==4,所以采取sp3杂化,故A错误;CH4中C原子价层电子对数n==4,所以采取sp3杂化,故B错误;BF3中B原子价层电子对数n==3,所以采取sp2杂化,故C正确;H2O中O原子价层电子对数==4,所以采取sp3杂化,故D错误。
3.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥型 B.V形;三角锥型
C.直线形;平面三角形 D.V形;平面三角形
答案:D
解析:根据价层电子对互斥理论,H2S是属于中心原子上有孤电子对的,它们相互排斥而形成V形结构;BF3是中心原子上没有孤电子对的,中心原子周围的原子数是3,故为平面三角形。
4.下列说法中正确的是 ( )
A.BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体型分子且键角都为109.5°
C.NH4+的空间构型为平面正方形
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
答案:D
5.已知原子数和价电子数相同的离子或分子结构相似,下列分子或离子中与SO有相似结构的是 ( )
A.PCl5 B.CCl4 C.NF3 D.N3-
答案:D
6.以下各组分子中,中心原子的杂化轨道类型相同,分子的几何构型也相同的是( )
A.NF3 BF3 NH3 B.H2O H2S OF2
C.H2O NH3 CH4 D.CO2 H2O HCHO
答案:B
7.下列各组分子或离子,中心原子的杂化轨道类型相同,但分子或离子的几何构型不同的是( )
①H2O、H3O+、NH ②H3O+、NH3、PCl3
③BF3、NH3、PCl3 ④OF2、H3O+、CH4
A.①② B.②③ C.③④ D.①④
答案:D
8.计算下列分子或离子中划线原子的价电子对数和孤电子对数。
①CCl4_____ _____ ②BeCl2_____ _____
③BCl3_____ _____ ④PCl3______ _____
答案:①4 0 ②2 0 ③3 0 ④4 1
9.用价层电子对互斥模型推测下列分子的空间构型:
(1)H2Se___________ (2)NH_________
(3)BBr3___________ (4)CHCl3___________
(5)SiF4__________ (6)SO2______________
答案:(1)V形 (2)V形 (3)平面三角形 (4)四面体 (5)正四面体 (6)V形
10.中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+SA+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的电负性从大到小依次为______________________。
(2)在生成物中,A的晶体类型为____________________,含极性共价键的分子的中心原子轨道杂化类型为_________________。
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为__________。
答案:(1)O>N>C>K (2)离子晶体 sp (3)1:1
解析:(2)根据原子守恒可知A为K2S,为离子晶体,含极性共价键的分子为CO2,为sp2杂化。
(3)根据等电子原理,CN-中含有三键,可知HCN的结构式为H-C≡N,σ键与π键数目之比为1:1。
题组B 能力提升练
1.氨基乙酸钠(H2NCH2COONa)用于有机产品的合成、工业洗涤剂中间体以及生化研究。下列说法正确的是( )
A.碳、氮原子的杂化类型相同
B.氨基乙酸钠中心原子N原子的价层电子对数为4
C.1 mol氨基乙酸钠分子中所含σ键为10 mol
D.氮原子和与其成键的另外三个原子在同一平面内
答案:B
解析:氨基乙酸钠分子中氮原子是sp3杂化,而碳原子是sp3、sp2杂化,A错误;氨基乙酸钠中存在2个N—H键、1个C—N键,N原子上含有1对孤电子对,价层电子对数=共价键单键数+孤电子对个数,则N原子的价层电子对数为4,B正确;1 mol氨基乙酸钠分子中有1 mol碳氧双键,有8 mol σ键,C错误;由于氮原子为sp3杂化,故相应的四个原子形成的是三角锥型结构,不可能共平面,D错误。
2.已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是( )
A.a、c分子中的键角完全相同
B.a、c分子中中心原子均采用sp3杂化
C.四种分子中都有σ键及π键
D.b、d分子中共价键的键能:b>d
答案:B
解析:根据题意分析a、b、c、d分别是CH4、Cl2、CH3Cl、HCl,其中CH4是正四面体分子,CH3Cl是四面体分子,二者的键角不相同,A错误;甲烷中碳与氢形成4个碳氢σ键、一氯甲烷分子中形成三个碳氢σ键和一个碳氯σ键,中心原子均为sp3杂化,B正确;四种分子中只存在σ键而没有π键,C错误;氯的原子半径大于氢原子半径,所以氯气分子中的氯氯键的键能小于氯化氢分子中的氢氯键的键能,D错误。
3.成键原子中孤电子对对键能有影响,第二周期元素A与氢形成的化合物中A-A键的键能(单位:kJ·mol-1)如下:
H3C-CH3 346 H2N-NH2 247 HO-OH 207
试分析上述化合物中A-A键的键能依次下降的原因。
___________________________________________________________________________。
答案:C原子上无孤电子对,1个N原子有一对孤电子对,1个O原子有2对孤电子对,分子中孤电子对数越多,对A-A键的排斥越大,A-A键越不稳定。
4.根据杂化轨道理论可以判断分子的空间结构,试根据相关知识填空:
(1)AsCl3分子的空间结构为__________,其中As的杂化轨道类型为________。
(2)CH3COOH中C原子轨道杂化类型为____________。
(3)一种有机化合物的结构简式如下:
①该分子中有__________个sp2杂化碳原子;______个sp3杂化碳原子。
②该分子中有________个sp2-sp3 σ键;____________个sp3-sp3 σ键。
(4)SCN-与NO的结构相同,微粒呈____________形,中心原子都采取__________杂化。
(5)CO、NO等微粒具有相同的原子个数,它们的价电子总数都是_______,空间结构呈_________形,中心原子都采取_________杂化。
答案:(1)三角锥型 sp3 (2)sp3、sp2
(3)①2 6 ②3 3 (4)直线 sp
(5)24 平面三角 sp2
解析:(1)AsCl3中As元素的价电子对数为4,As的杂化方式为sp3杂化,AsCl3分子的空间结构为三角锥型。(2)CH3COOH的结构式为,分子中甲基上的碳原子采用sp3杂化,羧基中碳原子采用sp2杂化。
(3)有机物中饱和碳原子是sp3杂化,双键上的碳原子是sp2杂化,三键上的碳原子是sp杂化。
①该分子中有2个sp2杂化碳原子;6个sp3杂化碳原子。
②该分子中有3个sp2-sp3 σ键;3个sp3-sp3 σ键。
(4)中SCN-与NO采用sp杂化,形成直线形分子。
(5)中CO、NO与SO3为等电子体,SO3中S采取sp2杂化形成平面三角形分子。
5.回答下列问题:
(1)碳原子有4个价电子,在形成化合物时价电子均参与成键,但杂化方式不一定相同。在乙烷、乙烯、乙炔和苯四种分子中,采取sp杂化的分子是__________(写结构简式,下同),采取sp2杂化的分子是________________,采取sp3杂化的分子是__________。试写出一种有机物分子的结构简式,要求同时含有三种不同杂化方式的碳原子:_________________________。
(2)第三周期中,某元素的氢化物含五核18电子,采取sp3杂化,空间构型呈正四面体型的化学式为________。
(3)化合物中阴离子的中心原子轨道采用________杂化。
(4)X的单质与氢气可化合生成气体G,其水溶液pH>7。G分子中X原子的杂化轨道类型是________。
(5)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________。
(6)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为________。
答案:(1)CH≡CH CH2=CH2、 CH3CH3 (其他合理答案均可)
(2)SiH4 (3)sp3 (4)sp3 (5)sp3
(6)sp3 σ键电子对与孤电子对的斥力差异所造成的
【解析】(1)有机物中饱和碳原子是sp3杂化,双键上的碳原子是sp2杂化,三键上的碳原子是sp杂化。
(2)第三周期中,某元素的氢化物含五核18电子,sp3杂化,空间构型呈正四面体型的化学式为SiH4。
(3)中心原子形成四个σ键,采用sp3杂化。
(4)G是NH3分子,N原子采取sp3杂化。
(5)硫原子形成2个S—S键,还有2对孤电子对,杂化方式为sp3。
(6)H2O和H3O+中的氧原子均采取sp3杂化,其键角的差异是由σ键电子对与孤电子对的斥力差异所造成的。
题组C 培优拔尖练
1.氯的含氧酸根离子有ClO-、ClO、ClO、ClO等,关于它们的说法正确的是( )
A.ClO-中Cl显+1价
B.ClO的空间构型为直线形
C.ClO的空间构型为平面三角形
D.ClO与SO所带电荷不同,故不属于等电子体
答案:A
解析:ClO-中O为-2价,Cl元素的化合价为-1-(-2)=+1,即Cl显+1价,故A正确;ClO中价层电子对个数n==4,杂化类型为sp3,配位原子数为2,所以是V形,故B错误;ClO中价层电子对个数n==4,杂化类型为sp3,配位原子数为3,所以是三角锥型,故C错误;ClO与SO的原子数相同,价电子数分别为7+6×4+1=32、6×5+2=32,所以二者是等电子体,故D不正确。
2.通常把具有相同价电子数和相同原子数的分子或离子称为等电子体。等电子体的结构和性质相似(等电子原理)。有下列两个系列的物质:
系列一:CH4 C2H6 CO Y C2O W
系列二:NH N2H X NO Z N2
试根据等电子体的概念及上述两系列物质的排列规律,推断X、Y、Z、W可能是下列各组分子或离子中的( )
A.NO CO2 N2O4 CO B.NO CO2 N2H4 C2H2
C.NO CO NO2 C2H2 D.NO HCO N2O CO
答案:A
解析:系列一中为含C元素的微粒,系列二为含N元素的微粒,上下互为等电子体,根据等电子原理推断四种微粒。
3.等电子体的结构相似、物理性质相近,称为等电子原理。如N2和CO为等电子体。下表为部分元素等电子体分类、空间构型表。
等电子体类型
代表物质
空间构型
四原子24电子等电子体
SO3
平面三角形
四原子26电子等电子体
SO
三角锥型
五原子32电子等电子体
CCl4
四面体型
六原子40电子等电子体
PCl5
三角双锥型
七原子48电子等电子体
SF6
八面体型
试回答:
(1)判断下列物质分子或离子的空间构型:
BrO__________ CO__________ ClO___________。
(2)由第2周期元素组成,与F2互为等电子体的离子有__________。
(3)SF6的空间构型如图1所示,请再按照图1的表示方法在图2中表示OSF4分子中O、S、F原子的空间位置。已知OSF4分子中O、S间为共价双键,S、F间为共价单键。
答案:(1)三角锥型 平面三角形 正四面体型 (2)O
(3)
解析:(1)BrO是26电子等电子体,为三角锥型,CO为四原子24电子等电子体,为平面三角形,ClO为五原子32电子等电子体,为正四面体型。
(2)F2为两原子14电子,由第2周期元素组成,与F2互为等电子体的离子为O。
(3)SF6为正八面体结构,根据题意,OSF4比SF6少2个F,多1个O,可推得OSF4空间构型。
4.已知:①红磷在氯气中燃烧可以生成两种化合物——PCl3和PCl5,氮与氢也可形成两种化合物——NH3和NH5。
②PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道,PCl5分子呈三角双锥型()。
(1)NH3、PCl3和PCl5分子中,所有原子的最外层电子数都是8个的是________(填分子式),该分子的形状是___________。
(2)经测定,NH5中存在离子键,N原子最外层电子数是8,所有氢原子的最外层电子数都是2,则NH5中H元素的化合价为______和______;该化合物中N原子的杂化方式为_______。
答案:(1)PCl3 三角锥形 (2)+1 -1 sp3
解析:(1)满足所有原子都是8电子的是PCl3,根据VSEPR可得分子的空间构型是三角锥形。
(2)根据题意,NH5的电子式为。
5.(1)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________,中心原子的杂化形式为________。
(2)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为________。
(3)NO的空间构型为_______________________________(用文字描述)。
(4)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
从结构角度分析,R中两种阳离子的相同之处为________,不同之处为________。(填标号)
A.中心原子的杂化轨道类型
B.中心原子的价层电子对数
C.立体结构
D.共价键类型
答案:(1)正四面体 sp3 (2)平面三角形 sp2 (3)平面(正)三角形 (4)ABD C
解析:(1)LiAlH4中的阴离子是AlH,中心原子铝原子的价层电子对数n==4,所以中心原子采取sp3杂化,配位原子数为4,轨道构型和实际构型一致,都是正四面体;(2)ZnCO3中,阴离子CO中价层电子对数n==3,碳原子的杂化形式为sp2,配位原子数为3,轨道构型和实际构型一致,都是平面三角形;(3)NO中价层电子对数n==3,配位原子数为3,轨道构型和实际构型一致,都是平面三角形;(4)根据图可知,阳离子是NH和H3O+,NH中心原子N的价层电子对数n==4,杂化类型为sp3,空间构型为正四面体型;H3O+中心原子O的价层电子对数n==4,杂化类型为sp3,轨道构型为正四面体,因为配位原子数为3,则实际空间构型为三角锥型,因此相同之处为ABD项,不同之处为C项。
相关试卷
这是一份【同步讲义】高中化学(苏教版2019)选修第二册--3.4.2 分子晶体 讲义,文件包含同步讲义高中化学苏教版2019选修第二册--342分子晶体学生版docx、同步讲义高中化学苏教版2019选修第二册--342分子晶体教师版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份【同步讲义】高中化学(苏教版2019)选修第二册--3.4.1 范德华力+氢键 讲义,文件包含同步讲义高中化学苏教版2019选修第二册--341范德华力氢键学生版docx、同步讲义高中化学苏教版2019选修第二册--341范德华力氢键教师版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份【同步讲义】高中化学(苏教版2019)选修第二册--3.1.2 金属晶体 讲义,文件包含同步讲义高中化学苏教版2019选修第二册--312金属晶体学生版docx、同步讲义高中化学苏教版2019选修第二册--312金属晶体教师版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。













