四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题(含解析)
展开四川省成都市石室中学2023届高三下学期高考适应性考试(二)理科综合化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.我国历史悠久,文化灿烂,拥有众多的非遗技艺传承。下列说法正确的是
A.斑铜制作技艺在铜中掺杂金、银等金属,斑铜的熔点比纯铜高
B.蒸馏酒传统酿造技艺利用酒和水的密度不同,蒸馏提高酒精度
C.传统纺织技艺中棉和麻的主要成分相同
D.木版年画制作技艺使用的靛蓝、赭石等颜料均属于有机化合物
2.进行下列封管实验都产生明显现象,其中不涉及化学反应的是
A. B. C. D.
3.某种兴奋剂的结构简式如图所示。下列有关该化合物的说法正确的是
A.该化合物的分子式为C15H14O3
B.分子中所有碳原子一定在个平面上
C.该化合物的同分异构体中一定有苯环
D.该化合物可以发生加成、加聚、氧化、还原、取代反应
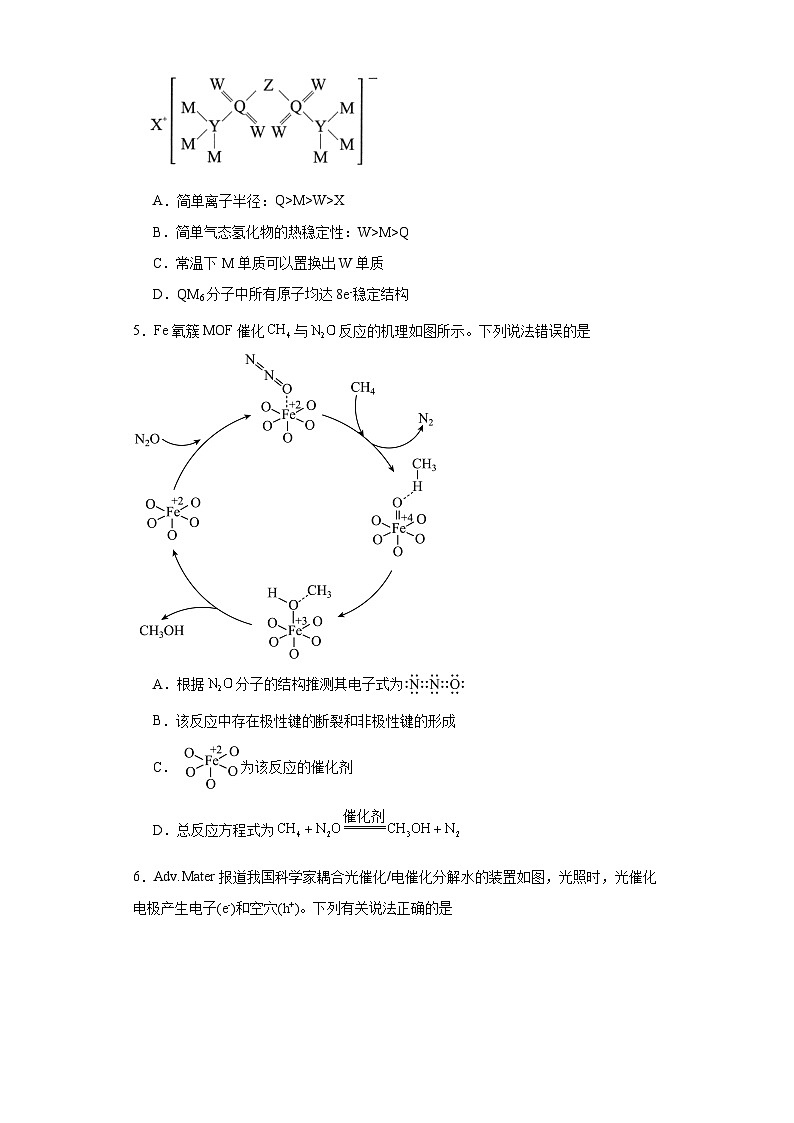
4.软包电池的关键组件结构如图所示。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素原子的最外层电子数是次外层电子数的一半,W元素和Q元素同主族。下列说法正确的是
A.简单离子半径:Q>M>W>X
B.简单气态氢化物的热稳定性:W>M>Q
C.常温下M单质可以置换出W单质
D.QM6分子中所有原子均达8e-稳定结构
5.Fe氧簇MOF催化与反应的机理如图所示。下列说法错误的是
A.根据分子的结构推测其电子式为
B.该反应中存在极性键的断裂和非极性键的形成
C. 为该反应的催化剂
D.总反应方程式为
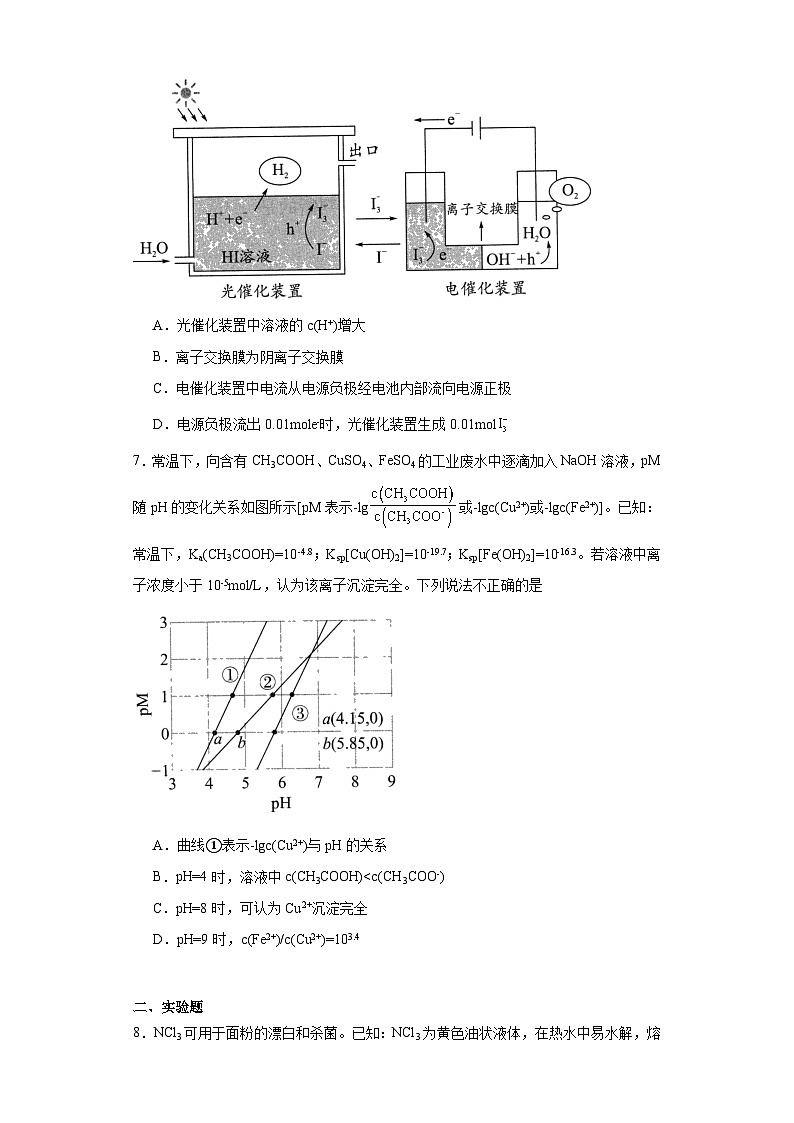
6.Adv.Mater报道我国科学家耦合光催化/电催化分解水的装置如图,光照时,光催化电极产生电子(e-)和空穴(h+)。下列有关说法正确的是
A.光催化装置中溶液的c(H+)增大
B.离子交换膜为阴离子交换膜
C.电催化装置中电流从电源负极经电池内部流向电源正极
D.电源负极流出0.01mole-时,光催化装置生成0.01mol
7.常温下,向含有CH3COOH、CuSO4、FeSO4的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示-lg或-lgc(Cu2+)或-lgc(Fe2+)]。已知:常温下,Ka(CH3COOH)=10-4.8;Ksp[Cu(OH)2]=10-19.7;Ksp[Fe(OH)2]=10-16.3。若溶液中离子浓度小于10-5mol/L,认为该离子沉淀完全。下列说法不正确的是
A.曲线①表示-lgc(Cu2+)与pH的关系
B.pH=4时,溶液中c(CH3COOH)
D.pH=9时,c(Fe2+)/c(Cu2+)=103.4
二、实验题
8.NCl3可用于面粉的漂白和杀菌。已知:NCl3为黄色油状液体,在热水中易水解,熔点为-40°C,沸点为70°C,95°C以上易爆炸。实验室可用Cl2和NH4Cl溶液反应制取NCl3所用装置如下:
完成下列填空:
(1)仪器a的名称是 。D装置盛装的物质是 ,D装置的作用是_ 。
(2)NCl3水解的反应液有漂白性,写出NCl3水解的化学方程式: 。
(3)向NH4Cl溶液中通入过量Cl2,B装置中反应的化学方程式为 ,待反应至油状液体不再增加,关闭A、B装置间的止水夹,控制水浴加热的温度范围为 ,将产品NCl3蒸出。
待反应结束,为测定溶液中残留的NCl3的物质的量浓度,进行如下操作:
i.取仪器a中的反应液25.00mL,加入过量饱和Na2SO3溶液充分反应后,再加入过量30%的NaOH溶液,微热。
ii.用25.00mL0.050mol·L-1的稀硫酸吸收产生的NH3,得到溶液A。
iii.用0.100mol·L-1的NaOH标准溶液滴定溶液A至滴定终点,消耗VmLNaOH标准溶液。
(4)滴定至终点时溶液中溶质仅有(NH4)2SO4和Na2SO4,滴定过程中水的电离程度_ (填序号)。
a.先增大后减小 b.先减小后增大 c.增大 d.减小
(5)用含V的代数式表示溶液中残留的NCl3的物质的量浓度为 mol·L-1。
三、原理综合题
9.锡烟尘(主要含ZnO、ZnFe2O4、SnO、SnO2、In2O3、In2S3)氧压浸出分离回收金属的工艺流程如下:
已知:常温下,Ksp[In(OH)3]=10-34。
回答下列问题:
(1)金属铟为49号元素,在元素周期表中的位置为 。
(2)“氧压浸出”过程中,In2S3发生氧化还原生成单质S的离子方程式为 。
(3)实验测得氧分压对Sn、In、Zn的浸出率影响如图所示。
写出由Sn(Ⅱ)转化为H2SnO3的离子方程式: ,从平衡移动的角度解释氧分压对Sn的浸出率的影响: ;最佳氧分压为 (填序号)MPa。
A.0.4 B.0.6 C.0.7 D.1.0
(4)“萃取”过程中,发生反应In3++3(HA)2=InA3·3HA+3H+。
①“萃取”过程中,使用的硅酸盐仪器为 。
②“萃余液I”中含有的金属离子为 。
(5)“反萃取”后,可先中和再加入Zn粉置换,中和的目的是 ;已知常温下,“反萃取”后溶液中In3+的浓度为0.0115g·L-1,则中和时可调节pH的最大值为 。
10.CO2与氢气在固载金属催化剂上可发生以下反应:
反应i. CO2(g)+H2(g) HCOOH(g) ΔH1
反应ii. CO2(g)+H2(g) H2O(g)+CO(g) ΔH2>0
反应iii.……
可能的反应机理如下(M为催化剂);
回答下列问题:
(1)反应iii的化学方程式为 。
(2)已知下列几种物质的标准摩尔生成焓(在101kPa时,由最稳定单质合成1mol指定产物时所放出的热量):
物质
CO2(g)
H2(g)
HCOOH(g)
标准摩尔生成焓/kJ·mol-1
-393.51
0
-362.3
依据以上信息,ΔH1= 。
(3)在一定压强下,按n(H2):n(CO2)=1:1 投料,发生反应i和反应ii (忽略反应iii), 反应相同时间,CO2的转化率及HCOOH选择性(甲酸选择性=随温度变化曲线如下图所示。
①下列措施能提高CO2平衡转化率的是 ( 填标号)。
A.降低温度 B.再充入Ar C.分离出HCOOH
②673.15K,反应后体系中H2的分压为a MPa,则反应i的压力商计算式Qp= MPa-1。
③当温度高于673.15K,随温度升高,反应i与反应ii的反应速率相比,增加更显著的是反应 (填“ i”或“ii”),判断的理由是 。
(4)若在Bi或Bi/CeO2催化剂表面还原CO2生成HCOOH, 模拟经历两种中间体的能量变化如图所示。HCOOH的合成更倾向于通过生成 中间体,且 (填 “Bi”或“Bi/CeO2”)的催化活性更优异。
四、结构与性质
11.H、N、O、S、Zn、Cu是日常生活中常见的元素。
(1)基态S原子的核外电子排布式为 ,其中两种自旋状态的电子数之比为 。
(2)[Cu(NH3)4]SO4·H2O中,电负性最大的元素是 (填名称);第一电离能最大的元素是 (填名称)。1mol[Cu(NH3)4]2+中含有σ键的数目为 。
(3)硼酸晶体的片层结构如图1所示,其中键角∠B-O-H为114°,则硼酸晶体中氧原子的杂化方式是 。键角∠B-O-H不同于键角∠O-B-O的原因是 。
(4)N原子和P原子的价电子相同,但磷酸的组成为H3PO4,而硝酸的组成不是H3NO4,其原因是 。
(5)GaN(相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图2所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿z轴从上往下俯视的晶胞投影图如图3所示。
①若图3中原子5的分数坐标是(1,,),则原子1的分数坐标是 。
②设阿伏加德罗常数的值为NA,则GaN晶体的密度为 g·cm-3。
五、有机推断题
12.化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:①RCHO+CH3CHORCH=CHCHO+H2O
②
请回答下列问题:
(1)化合物G的结构简式为 ,D中官能团的名称为 。
(2)下列说法不正确的是 。
A.C→D的反应类型是取代反应
B.化合物C可以与NaHCO3溶液反应
C.化合物D不能发生消去反应
D.化合物H的分子式为C18H18O2
(3)B→C第一步的化学反应方程式为 。
(4)芳香化合物X是C的同分异构体,X具有以下特点:①只有一个环状结构;②具有两个相同的官能团;③能发生银镜反应,X共有 种(不考虑立体异构)。其中核磁共振氢谱有四种不同化学环境的氢,且峰面积之比为3:2:2:1,写出1种符合要求的X的结构简式 。
(5)写出用环戊烷()和2—丁炔(CH3CH ≡ CHCH3)为原料制备化合物x()的合成路线(用流程图表示,其他试剂任选) 。
参考答案:
1.C
【详解】A.斑铜为合金,合金熔点低于纯金属,A错误;
B.蒸馏酒用的是酒精和水的沸点差异较大,B错误;
C.传统纺织技艺中棉和麻的主要成分相同,均为纤维素,C正确;
D.木版年画制作技艺使用的靛蓝属于有机化合物、赭石主要成分为氧化铁是无机物,D错误;
故选C。
2.B
【详解】A.加热氯化铵的化学反应方程式是,故A不符合题意;
B.碘是加热升华,属于物理过程,不涉及化学反应,故B符合题意;
C.氨气能溶于水并与水反应生成氨水,能使无色酚酞溶液变红色,氨水又是一种不稳定的碱,加热后又分解为氨气和水,酚酞溶液又由红色变成无色,涉及化学反应;故C不符合题意
D.品红中的有色物质与SO2发生化合反应生成不稳定的无色物质,加热会恢复品红的颜色项,故D不符合题意;
故答案选B。
3.D
【详解】A.有该有机物的结构简式可知,该有机物分子式为,A项错误;
B.苯环是平面结构,乙烯也是平面结构,单键可以旋转,该有机物中所有的碳原子均可共面,但不一定共面,B项错误;
C.同分异构体是指分子式相同结构不同的有机物,该化合物的同分异构体中不一定有苯环,C项错误;
D.该有机物含有苯环,碳碳双键,酚羟基,苯环可以发生加成反应,还原反应,碳碳双键可以发生加聚反应,氧化反应,加成反应,酚羟基可以发生取代反应,氧化反应,D项正确;
答案选D。
4.C
【分析】软包电池的关键组件结构如图所示。X、Y、Z、W、M、Q为原子序数依次增大的短周期元素,X元素原子的最外层电子数是次外层电子数的一半,且为+1价,X为锂,W元素和Q元素同主族,结合图像判断,W和Q分别为O和S,Y为C,Z为N,M为F。
【详解】A.简单离子半径:Q>W>M>X,A错误;
B.简单气态氢化物的热稳定性:M>W>Q,B错误;
C.常温下F单质可以置换出O单质,C正确;
D.QM6分子中S原子最外层有12个电子,D错误;
故选C。
5.A
【详解】A.选项中电子式中N原子电子数超出了其最外层电子数,故A错误;
B.由图示可知该过程中甲烷中C-H断裂,C-H键属于极性键,同时生成氮气,氮气中氮氮键属于非极性键,故B正确;
C.反应起点作为反应物,终点做为生成物,是该反应的催化剂,故C正确;
D.由机理图可知该过程的总反应为甲烷和反应生成和,反应方程式为:,故D正确;
故选:A。
6.C
【详解】A.光催化装置中溶液的H+转化为氢气,c(H+)不会增大,A错误;
B.由离子未通过交换膜可知离子交换膜为阳离子交换膜,B错误;
C.催化装置中电流从电源负极经电池内部流向电源正极,C正确;
D.源负极流出0.01mole-时,光催化装置生成0.005mol,D错误;
故选C。
7.B
【详解】A.将a点坐标值带入可知,Ksp=10-19.7,曲线①表示-lgc(Cu2+)与pH的关系,A正确;
B.②代表-lg,pH=4时,-lg<0,故溶液中c(CH3COOH)>c(CH3COO-),B错误;
C.pH=8时,-lgc(Cu2+)=4.3<5,不可认为Cu2+沉淀完全,C错误;
D.pH=9时,c(Fe2+)/c(Cu2+)=10-3.4,D错误;
故选B。
8.(1) 蒸馏烧瓶 碱石灰 吸收尾气,同时防止空气中的水蒸气进入装置C中
(2)NCl3+3H2O3HClO+NH3↑
(3) 3Cl2+NH4ClNCl3+4HCl 70°C≤T<95°C
(4)c
(5)
【分析】由实验装置图可知,装置A中为高锰酸钾固体与浓盐酸反应制备氯气,装置B中氯气与氯化铵溶液在水浴加热条件下反应制备三氯化氮,装置C用于冷凝收集三氯化氮,装置D中盛有的碱石灰用于吸收未反应的氯气,防止污染空气,同时防止水蒸气进入锥形瓶中。
【详解】(1)由仪器构造可知a 为蒸馏烧瓶,装置D中盛有的碱石灰用于吸收未反应的氯气,防止污染空气,同时防止水蒸气进入锥形瓶中;
(2)NCl3水解的反应液有漂白性,可知水解生成HClO,则另一产物应为NH3;水解的化学方程式:NCl3+3H2O3HClO+NH3↑;
(3)由分析可知,装置B中氯气与氯化铵溶液在水浴加热条件下反应制备三氯化氮,反应的化学方程式为3Cl2+NH4ClNCl3+4HCl;由题给信息可知,实验时,为保证三氯化氮顺利蒸出,同时防止三氯化氮发生爆炸,水浴加热的温度应控制在70℃~95℃之间;
(4)滴定前溶液为硫酸和硫酸铵的混合溶液,有酸存在水的电离被抑制,滴定过程中NaOH与硫酸中和,溶液中氢离子浓度减小,水的电离程度增大,故答案为c;
(5)由题意可知,滴定过程中消耗VmL0.100mol/L氢氧化钠溶液,则用于吸收氨气的稀硫酸的物质的量为0.050mol/L×0.025L-0.100mol/L×10-3VL×,由方程式和氮原子个数守恒可知,溶液中残留的三氯化氮的物质的量浓度为mol/L。
9.(1)第五周期第IIIA族
(2)2In2S3+3O2+12H+=4In3++6S+6H2O
(3) 2Sn2++O2+4H2O2H2SnO3↓+4H+或(2SnO+O2+2H2O=2H2SnO3↓) 氧分压增大,平衡正向移动,Sn的浸出率降低 C
(4) 烧杯、分液漏斗 Zn2+、Fe3+
(5) 减少Zn粉的使用量 4
【分析】锡烟尘(主要含ZnO、ZnFe2O4、SnO、SnO2、In2O3、In2S3)进行氧压浸出,将-2价硫氧化为硫单质,SnO酸性条件下氧化生成H2SnO3沉淀,其余均转化为金属离子进入溶液中,加入萃取剂将In3+萃取入有机层中,分液,在有机层中加入反萃取剂,得到含In3+的无机溶液,锌置换得到In。
【详解】(1)金属铟为49号元素,在元素周期表中的位置为第五周期第ⅢA族。
答案为:第五周期第ⅢA族
(2)结合上述分析,“氧压浸出”过程中,In2S3发生氧化还原生成单质S的离子方程式为:2In2S3+3O2+12H+=4In3++6S+6H2O。
答案为:2In2S3+3O2+12H+=4In3++6S+6H2O。
(3)由Sn(Ⅱ)转化为H2SnO3的离子方程式:2Sn2++O2+4H2O2H2SnO3↓+4H+或(2SnO+O2+2H2O=2H2SnO3↓);氧分压增大,2Sn2++O2+4H2O2H2SnO3↓+4H+平衡正向移动,Sn的浸出率降低;结合以上分析,氧压浸出将Sn转化为H2SnO3沉淀除去,故Sn的浸出率越低,除杂效果越好,结合图像信息,最佳氧分压为0.7。
答案为:2Sn2++O2+4H2O2H2SnO3↓+4H+或(2SnO+O2+2H2O=2H2SnO3↓);氧分压增大,平衡正向移动,Sn的浸出率降低;C。
(4)“萃取”过程中,发生反应In3++3(HA)2=InA3·3HA+3H+。
①“萃取”过程中,需要进行的实验操作是萃取、分液,使用的硅酸盐仪器有分液漏斗、烧杯;
②结合以上分析,“萃余液I”中含有的金属离子为Zn2+、Fe3+。
答案为:烧杯、分液漏斗;Zn2+、Fe3+。
(5)“反萃取”后,溶液中还剩余有硫酸,可先中和完硫酸,再加入Zn粉置换,可减少锌粉的使用量;已知常温下,Ksp[In(OH)3]=10-34,“反萃取”后溶液中In3+的浓度为0.0115g·L-1,则c(In3+)=, Ksp[In(OH)3]= c(In3+)=10-34,则c(OH-)=mol/L, c(OH-)=mol/L,则中和时可调节pH的最大值为4。
答案为:减少Zn粉的使用量;4。
10.(1)CO2(g)+2H2(g) HCHO(g)+ H2O(g)
(2)+31.21kJ·mol-1
(3) C ii 随温度升高,二氧化碳的转化率升高,但HCOOH的选择性却迅速下降
(4) HCOO* Bi/CeO2
【详解】(1)据图可知,CO2(g)还可以和H2(g)反应生成HCHO(g),根据元素守恒可知反应iii为CO2(g)+2H2(g)HCHO(g)+ H2O(g);
(2)焓变=生成物总能量-反应物总能量,所以ΔH1=[-362.3-0-(-393.51)] kJ·mol-1=+31.21kJ·mol-1;
(3)①A.ΔH1>0,ΔH2>0,即反应i和反应ii均为吸热反应,降低温度平衡逆向移动,CO2平衡转化率减小,A不符合题意;
B.恒压条件,再冲入Ar,则容器体积变大,相当于减压,反应i为气体系数之和减小的反应,平衡逆向移动,CO2的转化率减小,B不符合题意;
C.分离出HCOOH,反应i平衡正向移动,CO2转化率增大,C符合题意;
答案选C;
②不妨设初始投料为n(H2)=n(CO2)=1mol,673.15K时,CO2的转化率为95%,HCOOH的选择性为0.3%,所以n(HCOOH)=1×95%×0.3%mol,由于反应i和反应ii中H2和CO2都是1∶1反应,所以此时n(H2)=n(CO2)=1×5%mol,则此时p(CO2)=p(H2)=aMPa,p(HCOOH)=MPa,所以反应i的压力商计算式Qp==;
③随温度升高,二氧化碳的转化率升高,但HCOOH的选择性却迅速下降,说明反应ii的反应速率增加更显著;
(4)据图可知生成HCOO*的活化能更小,所以HCOOH的合成更倾向于通过生成HCOO*中间体,Bi/CeO2对反应的活化能降低的更多,催化活性更优异。
11.(1) [Ne]3s23p4(或1s22s22p63s23p4) 7:9(或9:7)
(2) 氧元素 氮元素 16NA
(3) sp3 O原子上有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力
(4)N原子的半径小于P原子,N原子周围空间小,不能同时容纳较多的原子轨道,故不能形成H3NO4
(5) (,,)
【详解】(1)基态S原子的原子序数为16,其核外电子排布式为:[Ne]3s23p4(或1s22s22p63s23p4);两种自旋状态的电子数之比为:7:9(或9:7)。
答案为:[Ne]3s23p4(或1s22s22p63s23p4);7:9(或9:7)。
(2)[Cu(NH3)4]SO4·H2O中,电负性大小:O>N>S>H>Cu;N元素原子的2P轨道为半充满 ,其第一电离能最大;Cu(NH3)4]2+中中心原子铜与4个N形成配位键,1molNH3中含有3mol共价键,1mol[Cu(NH3)4]2+中含有σ键的数目为4+34=16mol。
答案为:氧元素;氮元素;16NA。
(3)结合图片信息,O原子形成3个键,其中键角∠B-O-H为114°,说明有1对孤对电子,则硼酸晶体中氧原子的杂化方式是sp3;∠B-O-H 中O原子上有两对孤电子对,∠O-B-O中,每个O上均有两对孤对电子,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力,故键角∠B-O-H不同于键角∠O-B-O。
答案为:sp3;O原子上有孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对间的斥力。
(4)N、P的原子半径有关,N半径较小, N原子周围空间小,不能同时容纳较多的原子轨道,答案为:N原子的半径小于P原子,N原子周围空间小,不能同时容纳较多的原子轨道,故不能形成H3NO4。
(5)由图2和图3可知,图3中原子5在晶胞中处于面心位置,其的分数坐标是(1,,),原子1在晶胞体对角线的1/4处,故其的分数坐标是(,,);由图可知,晶胞中N原子的数目为4个, Ga原子的数目为,晶胞参数为acmGaN晶体的密度:。
答案为:(,,);。
12.(1) 碳溴键、羧基
(2)AC
(3)+2Cu(OH)2+NaOH+Cu2O↓+3H2O
(4) 10 或
(5)
【分析】由有机物的转化关系可知,与乙醛发生信息①反应生成,则A为、B为;与新制的氢氧化铜先共热发生氧化反应,后酸化得到,则C为;与溴的四氯化碳溶液发生加成反应生成,则D为;先在氢氧化钾醇溶液中共热发生消去反应,后酸化得到,则E为;浓硫酸作用下与乙醇共热发生酯化反应生成,则F为;与发生信息②反应生成。
【详解】(1)由分析可知,化合物G的结构简式为,化合物D的结构简式为,官能团为碳溴键、羧基,故答案为:;碳溴键、羧基;
(2)A.由分析可知,C→D的反应为与溴的四氯化碳溶液发生加成反应生成,故错误;
B.由分析可知,C的结构简式为,分子中含有的羧基能碳酸氢钠溶液反应生成二氧化碳气体,故正确;
C.由分析可知,先在氢氧化钾醇溶液中共热发生消去反应,后酸化得到,故错误;
D.由结构简式可知,化合物H的分子式为C18H18O2,故正确;
故选AC;
(3)B→C第一步反应为与新制的氢氧化铜共热发生氧化反应生成、氧化亚铜沉淀和水,反应的化学反应方程式为+2Cu(OH)2+NaOH+Cu2O↓+3H2O,故答案为:+2Cu(OH)2+NaOH+Cu2O↓+3H2O;
(4)C的同分异构体X只有一个环状结构,具有两个相同的官能团,能发生银镜反应说明X分子中苯环上的取代基为醛基和甲基,可以视作邻、间、对苯二甲醛分子中苯环上的氢原子被甲基取代所得结构,共有10种,其中符合核磁共振氢谱有四种不同化学环境的氢,且峰面积之比为3:2:2:1的结构简式为、,故答案为:10;或;
(5)由有机物的转化关系可知,用和CH3CH ≡ CHCH3为原料制备化合物的合成步骤为光照条件下与氯气发生取代反应生成,在氢氧化钠醇溶液中共热发生消去反应生成,与CH3CH ≡ CHCH3发生信息②反应生成,合成路线为,故答案为:。
四川省成都市石室中学2023-2024学年高三高三上学期一诊模拟考试理科综合化学试题(Word版附解析): 这是一份四川省成都市石室中学2023-2024学年高三高三上学期一诊模拟考试理科综合化学试题(Word版附解析),共20页。试卷主要包含了考生必须保证答题卡的整洁, Al3和H2SiO3等内容,欢迎下载使用。
四川省成都市石室名校2023-2024学年高三高三上学期一诊模拟考试理科综合化学试题 Word版含解析: 这是一份四川省成都市石室名校2023-2024学年高三高三上学期一诊模拟考试理科综合化学试题 Word版含解析,文件包含四川省成都市石室名校2023-2024学年高三高三上学期一诊模拟考试理科综合化学试题Word版含解析docx、四川省成都市石室名校2023-2024学年高三高三上学期一诊模拟考试理科综合化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
四川省成都市石室中学2023届高三下学期高考适应性考试(一)理科综合化学试题(含解析): 这是一份四川省成都市石室中学2023届高三下学期高考适应性考试(一)理科综合化学试题(含解析),共18页。试卷主要包含了单选题,工业流程题,实验题,填空题,结构与性质,有机推断题等内容,欢迎下载使用。












