

山西高考化学三年(2021-2023)模拟题汇编-02离子反应
展开山西高考化学三年(2021-2023)模拟题汇编-02离子反应
一、单选题
1.(2023·山西·校联考模拟预测)下列说法正确的是
A.O3为极性分子
B.SF6分子的键角为90°
C.Ge位于元素周期表的d区
D.氢氟酸电离方程式: HF= F-+H+
2.(2023·山西大同·统考三模)下列过程中的化学反应,相应的离子方程式错误的是
A.IBr与NaOH溶液反应:IBr+2OH-=Br- +IO- + H2O
B.用纯碱溶液处理水垢中的CaSO4: +CaSO4=CaCO3 +
C.将CO2通入NaOH溶液中[]:2CO2 + 3OH-=+ +H2O
D.用惰性电极电解足量的CuCl2溶液:Cu2+ +2Cl +2H2OCu(OH)2↓+Cl2↑+H2↑
3.(2023·山西朔州·统考二模)SO2、Cl2、NO2都是大气污染物,下列说法正确的是
A.都能使品红试液褪色,原理相同
B.都能与水反应,生成物都是电解质
C.等物质的量的SO2和Cl2混合通入装有湿润的有色布条的试管中,漂白效果更好
D.将SO2、NO2同时通入水中,加入BaCl2溶液有白色沉淀生成
4.(2023·山西太原·统考一模)下列反应的离子方程式正确的是
A.向Na2S溶液中加入稀硝酸:S2-+2H+= H2S↑
B.向H2O2溶液中滴入FeCl3溶液:H2O2+2Fe3+= 2Fe2++O2↑+2H+
C.向AgCl沉淀中滴加浓氨水:2NH3·H2O+AgCl = [Ag(NH3)2]+ +Cl-+2H2O
D.将NO、NO2混合气体通入NaOH溶液中:NO2+NO+2OH =++H2O
5.(2022·山西晋城·统考二模)为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法均正确的是
选项
被提纯的物质(杂质)
除杂试剂
分离方法
A
乙酸乙酯(乙醇)
饱和Na2CO3溶液
分液
B
Mg(OH)2[Al(OH)3]
氨水
过滤
C
C2H6(C2H4)
酸性高锰酸钾溶液
洗气
D
FeCl3(Na2CO3)
水
重结晶
A.A B.B C.C D.D
6.(2022·山西吕梁·统考二模)轻粉(Hg2Cl2)可入药,《本草纲目》载有其制法:将50g水银、足量明矾和食盐混合研磨,用盆倒扣。加热充分反应后。盆底可收集到40g轻粉。下列说法正确的是
A.制备轻粉所用原料均属于电解质 B.制备轻粉的反应属于复分解反应
C.制备轻粉过程中存在轻粉升华现象 D.本实验中轻粉的产率约为32%
7.(2022·山西太原·统考二模)宏观辨识和微观探析是化学学科的核心素养之一。下列描述物质制备和应用的离子方程式正确的是
A.泡沫灭火器的反应原理:2Al3++3CO+3H2O=2Al(OH)3↓+3CO2↑
B.海水提溴工艺中,用纯碱溶液富集Br2:Br2+2OH-=Br-+BrO-+H2O
C.锅炉除垢过程中将CaSO4转化为CaCO3:CaSO4(s)+CO(aq)CaCO3(s)+SO(aq)
D.用惰性电极电解饱和MgCl2溶液:2Cl-+2H2OCl2↑+H2↑+2OH-
8.(2022·山西临汾·统考三模)下列关于离子反应或离子共存表达正确的是
A.以下离子在0.1mol·L-1NaOH溶液中能大量共存:Na+、K+、、
B.以下离子在0.1mol·L-1K2CO3溶液中能大量共存:Na+、Ba2+、Cl-、OH-
C.向氯化铝溶液中滴加过量氨水:4NH3·H2O+Al3+=+4+2H2O
D.漂白粉漂白原理:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO
9.(2021·山西吕梁·统考一模)下列离子方程式正确的是
A.溶液中加入足量石灰乳:
B.在偏铝酸钠溶液中通入少量二氧化碳:
C.酸化的硫酸亚铁溶液长时间存放溶液变黄:
D.用高锰酸钾标准溶液滴定草酸:
10.(2021·山西吕梁·统考一模)常温下,下列各组离子在指定溶液中可能大量共存的是
A.在的溶液中:
B.含有大量Fe3+的溶液中:
C.的溶液中:
D.在的溶液中:
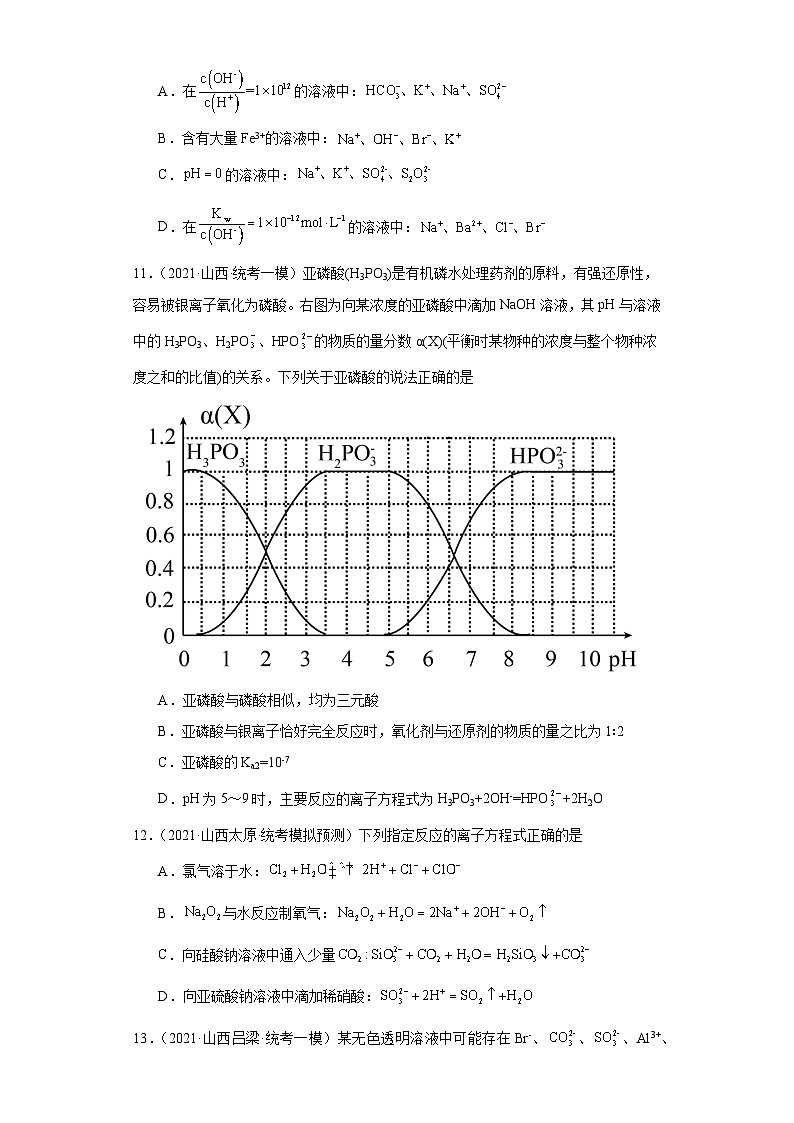
11.(2021·山西·统考一模)亚磷酸(H3PO3)是有机磷水处理药剂的原料,有强还原性,容易被银离子氧化为磷酸。右图为向某浓度的亚磷酸中滴加NaOH溶液,其pH与溶液中的H3PO3、H2PO、HPO的物质的量分数α(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系。下列关于亚磷酸的说法正确的是
A.亚磷酸与磷酸相似,均为三元酸
B.亚磷酸与银离子恰好完全反应时,氧化剂与还原剂的物质的量之比为1∶2
C.亚磷酸的Ka2=10-7
D.pH为5~9时,主要反应的离子方程式为H3PO3+2OH-=HPO+2H2O
12.(2021·山西太原·统考模拟预测)下列指定反应的离子方程式正确的是
A.氯气溶于水:
B.与水反应制氧气:
C.向硅酸钠溶液中通入少量
D.向亚硫酸钠溶液中滴加稀硝酸:
13.(2021·山西吕梁·统考一模)某无色透明溶液中可能存在Br-、、、Al3+、I-、Na+、Cu2+中的若干种。现进行如下实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入盐酸后沉淀不溶解;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定存在的离子组是
A.Na+、、、Br- B.Al3+、Na+、、Br-
C.Al3+、、I-、Br- D.Al3+、Br-、、Cu2+
二、实验题
14.(2023·山西朔州·统考二模)硫酸亚铁铵晶体[x(NH4)2SO4·yFeSO4·zH2O][M=(132x+152y+18z)g·mol-1]是常见的补血剂。
已知:①硫酸亚铁铵晶体在空气中不易被氧化。
②FeSO4溶液与(NH4)2SO4反应可得到硫酸亚铁铵。
(1)FeSO4溶液的制备。将铁粉、一定量H2SO4溶液反应制得FeSO4溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是 (用离子方程式表示)。
(2)制备x(NH4)2SO4·yFeSO4·zH2O向制备得到的FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃-80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为 。
(3)产品化学式的确定——NH含量的测定
I.准确称取58.80g晶体,加水溶解后,将溶液注入三颈烧瓶中:
Ⅱ.准确量取50.00mL3.030mol·L-1H2SO4溶液于锥形瓶中:
Ⅲ.向三颈烧瓶中通入氮气,加入足量NaOH浓溶液,加热,蒸氨结束后取下锥形瓶;
Ⅳ.用0.120mol·L-1的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mLNaOH标准溶液。
①装置M的名称为 。
②通入N2的作用为 。
③步骤Ⅲ中,反应的离子方程式是 。
④若步骤Ⅳ中,未用NaOH标准溶液润洗滴定管,则n(NH)将 (填“偏大”、“偏小”或“不变”)。步骤Ⅳ中,滴定时还必须选用的仪器是 (填编号)。
(4)产品化学式的确定一SO含量的测定
I.另准确称取58.80g晶体于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
Ⅱ.将得到的溶液过滤得到沉淀,洗涤沉淀3~4次;
Ⅲ.灼烧沉淀至恒重,称量,得沉淀质量为69.90g。
结合实验(3)和(4),通过计算得出硫酸亚铁铵晶体的化学式为 。
15.(2021·山西吕梁·统考一模)镁能在二氧化碳中燃烧:,钠比镁更活泼,那么钠能在二氧化碳中燃烧吗?某研究性学习小组设计了如图装置进行探究。
请回答下列问题:
(1)写出装置a中发生反应的离子方程式 。
(2)按照气流的方向从左至右连接装置:a接 、 、 、 、 。
(3)装置f中应盛放的试剂是 ,装置b的作用是 。
(4)实验过程中,在点燃装置c中的酒精灯前,必须经过必要的操作,方可进行后续的实验,该必要操作的目的是 。
(5)实验发现钠在充满二氧化碳气体的玻璃管里剧烈地燃烧,产生大量的白烟并伴有黑色物质生成。取一部分生成物于试管中,往试管中加水,白色物质溶解,黑色物质不溶。过滤,得到澄清的滤液。将滤纸上的黑色物质移人小试管中,加少量浓硫酸,加热,有刺激性气味的气体生成。则该黑色物质与浓硫酸共热的化学反应方程式为 。
(6)往(5)所得滤液中加澄清石灰水,溶液变浑浊。再滴入稀盐酸,溶液中有气泡出现。试写出钠与二氧化碳反应的化学方程式: 。
参考答案:
1.A
【详解】A.O3分子正负电荷中心不重合,是极性分子,A正确;
B.SF6分子为正八面体结构,其中F-S-F的键角部分为90°,部分为180°,B错误;
C.Ge位于元素周期表的p区,C错误;
D.HF为弱电解质,其电离方程式为HFH++F-,D错误;
故答案选A。
2.D
【详解】A.IBr中碘元素为+1价,溴元素为―1价,IBr与NaOH溶液反应的离子方程式为,故A正确;
B.微溶于水,难溶于水,用纯碱溶液处理水垢中的,可将转化为难溶的,反应的离子为程式为,故B正确;
C.将CO2通入NaOH溶液中,反应的离子方程式为,故C正确;
D.用惰性电极电解足量的溶液,反应的离子方程式为Cu2+ +2Cl Cu+Cl2↑,故D错误;
故答案选D。
3.D
【详解】A.SO2、Cl2、NO2都能使品红试液褪色,SO2与Cl2、NO2的原理不相同,故A错误;
B.NO2与水反应生成硝酸和NO,NO是非电解质,故B错误;
C.等物质的量的SO2和Cl2混合通入装有湿润的有色布条的试管中,发生反应SO2+Cl2+2H2O=H2SO4+2HCl,H2SO4、HCl没有漂白性,漂白效果变差,故C错误;
D.将SO2、NO2同时通入水中,SO2被氧化为硫酸,加入BaCl2溶液生成硫酸钡沉淀,故D正确;
选D。
4.C
【详解】A.S2-具有还原性,向Na2S溶液中加入稀硝酸会发生氧化还原反应生成NO和S单质,离子方程式为:3S2-+8H++8NO=8NO↑+3SO+4H2O,故A错误;
B.向H2O2溶液中滴入FeCl3溶液,Fe3+可以催化H2O2分解,氯化铁不是反应物,故B错误;
C.向AgCl沉淀中滴加浓氨水生成[Ag(NH3)2]+,离子方程式为:2NH3·H2O+AgCl = [Ag(NH3)2]+ +Cl-+2H2O,故C正确;
D.若将体积比为1:1的NO和NO2的混合气体通入氢氧化钠溶液中生成NaNO2和H2O,离子方程式为:NO2+NO+2OH =2+H2O,故D错误;
故选C。
5.A
【详解】A.乙醇与水互溶,饱和碳酸钠溶液可降低其在水中的溶解度,所以利用饱和碳酸钠溶液可吸收乙酸乙酯中的乙醇,然后分液可得到乙酸乙酯,A正确;
B.氨水中一水合氨属于弱碱,氢氧化镁和氢氧化铝均不能被溶解,B错误;
C.C2H4可以被酸性高锰酸钾溶液氧化为二氧化碳,使乙烷中引入新的杂质,C错误;
D.FeCl3和Na2CO3都易溶于水,两者混合会发生双水解,不能利用重结晶的方法分离提纯混合物,D错误;
故选A。
6.C
【详解】A.制备轻粉所用原料中,Hg是金属单质,既不是电解质又不是非电解质,故A错误;
B.制备轻粉的反应,有单质水银参加反应,一定不属于复分解反应,故B错误;
C.用盆倒扣,充分反应后,盆底可收集到轻粉,可知制备轻粉过程中存在轻粉升华现象,故C正确;
D.理论上生成Hg2Cl2的质量为,本实验中轻粉的产率约为,故D错误;
选C。
7.C
【详解】A.泡沫灭火器的反应原理:Al3++3HCO=Al(OH)3↓+3CO2↑,故A错误;
B.海水提溴工艺中,用纯碱溶液富集Br2:3Br2+3CO=5Br-+BrO+3CO2↑,故B错误;
C.CaCO3比CaSO4更难溶,故为CaSO4(s)+CO(aq)CaCO3(s)+SO(aq),故C正确;
D.用惰性电极电解饱和MgCl2溶液:Mg2++2Cl-+2H2OCl2↑+H2↑+Mg(OH)2↓,故D错误;
故选C。
8.A
【详解】A.OH-与Na+、K+、、都不反应,可以共存,故A正确;
B.与Ba2+反应生成BaCO3沉淀,不能共存,故B错误;
C.氢氧化铝为两性氢氧化物,但氢氧化铝不溶于氨水,正确的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3,故C错误;
D.漂白粉漂白原理为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,故D错误;
故选A。
9.A
【详解】A.MgCl2溶液中加入足量石灰乳反应生成氢氧化镁和氯化钙,Ca(OH)2主要以固体存在,应该写化学式,反应的离子方程式为:Mg2++Ca(OH)2=Mg(OH)2+Ca2+,A正确;
B在偏铝酸钠溶液中通入少量二氧化碳生成Al(OH)3沉淀和Na2CO3,反应的离子反应方程式:2+CO2+3H2O=2Al(OH)3↓+,B错误;
C.酸化的FeSO4溶液长时间存放溶液变黄是由于Fe2+被溶解在溶液中的O2氧化为Fe3+,反应的离子方程式为:4H++4Fe2++O2=4Fe3++2H2O,C错误;
D.草酸是二元弱酸,主要以电解质分子存在,不能拆写为离子形式,离子方程式应该为:,D错误;
故合理选项是A。
10.D
【详解】A.的溶液显碱性,含有大量OH-,OH-与HCO反应产生H2O、,不能大量共存,A错误;
B.含有大量Fe3+的溶液中,Fe3+与OH-会反应产生Fe(OH)3沉淀而不能大量共存,B错误;
C. pH=0的溶液呈酸性含有大量H+,H+与S2O在强酸性溶液中会反应产生H2O、S、SO2而不能大量共存,C错误;
D.溶液呈碱性,含有大量OH-,OH-与选项离子Na+、Ba2+、Cl-、Br-不能发生任何反应,可以大量共存,D正确;
故合理选项是D。
11.C
【详解】A.根据图示知,溶液中不存在PO,则亚磷酸是二元酸,A错误;
B.银离子还原为银单质,反应中银离子是氧化剂,氧化产物的化学式为H3PO4,则H3PO3是还原剂,根据转移电子守恒,n(Ag+)=n(H3PO3)×(5-3),即n(Ag+)∶n(H3PO3)=2∶1,B错误;
C.亚磷酸的,根据图示pH=6.5时,c(HPO)=c(H2PO),则Ka2=c(H+)=10-6.5,即数量级为10-7,C正确;
D.根据图示知,pH为5~9时,H2PO转化为HPO,主要的离子方程式为:H2PO+OH-=HPO+H2O,D错误;
故答案选C。
12.C
【详解】A.HClO为弱酸不能写成离子,正确离子方程式为Cl2+H2OH++Cl-+HClO,A错误;
B.选项所给离子方程式元素不守恒,正确的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,B错误;
C.硅酸钠溶液中通入少量二氧化碳生成硅酸沉淀和碳酸钠,C正确;
D.硝酸具有强氧化性会将亚硫酸根氧化成硫酸根,正确离子方程式为3SO+2NO+2H+=3SO+2NO+H2O,D错误;
综上所述答案为C。
13.A
【分析】从无色透明溶液排除有色离子,氯水具有强氧化性,可能氧化还原性离子Br-或I-;加入足量BaCl2溶液,有白色沉淀生成,加入盐酸后沉淀不溶解,说明生成了硫酸钡沉淀,可能是被氧化成;向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,说明没有碘单质存在,可能是原溶液中不含I-或含有I-被氧化成碘单质,又发生5Cl2+I2+6H2O=10HCl+2HIO3,不能确定I-存在,由此分析。
【详解】Cu2+为蓝色,由于是无色透明溶液,Cu2+一定不存在;
①向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子,和Al3+会生成沉淀,溶液中不含Al3+;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入盐酸后沉淀不溶解,说明产生了硫酸钡沉淀,说明溶液中含离子;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色,可能是碘离子氧化成单质碘,进一步单质碘被氧化成碘酸根离子5Cl2+I2+6H2O=10HCl+2HIO3,溶液中不含I-,所以溶液不变色,不能确定I-存在;故溶液中肯定存在的离子组是、、Br-,由于溶液显电中性,溶液中含有Na+;肯定存在的离子组是Na+、、、Br-,不能确定I-存在,Al3+、Cu2+一定不存在,答案选A。
14.(1)2Fe3++Fe=3Fe2+(4Fe2++O2+4H+=4Fe3++2H2O)
(2)乙醇的分子极性弱于水的,加入乙醇,形成乙醇一水的混合溶剂,极性比水的更弱。根据相似相溶原理,使离子化合物硫酸亚铁铵在乙醇一水的混合溶剂中的溶解度更小,有利于晶体析出
(3) 分液漏斗 将产生的氨气全部赶至锥形瓶内,被硫酸溶液完全吸收 NH+OH-NH3↑+H2O 偏小 ③⑥
(4)(NH4)2SO4·FeSO4·6H2O
【分析】确定产品化学式时,先将产品中的铵根转化为氨气,用硫酸标准液吸收氨气,通过滴定剩余氢离子的量,来间接测定铵根的量;然后另取样品,利用氯化钡来沉淀硫酸根,通过硫酸钡沉淀的量来确定硫酸根的含量,继而确定化学式。
【详解】(1)Fe2+易被空气中的氧气氧化为铁离子,4Fe2++O2+4H+=4Fe3++2H2O,Fe粉可以和铁离子发生反应2Fe3++Fe = 3Fe2+,因此过量的铁粉能防止其被氧化;
(2)硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇,因此乙醇可以降低硫酸亚铁铵晶体在水中的溶解度,有利于晶体的析出;
(3)①装置M为分液漏斗;
②反应中装置中会有残留的氨气,持续通入N2可以将产生的氨气全部赶至锥形瓶内,被硫酸溶液完全吸收;
③步骤Ⅲ中,反应为铵根离子和氢氧根离子生成氨气和水,离子方程式是NH+OH-NH3↑+H2O;
④若未用NaOH溶液润洗滴定管,则NaOH溶液的浓度偏低,则滴定中消耗的NaOH的体积偏大,剩余的硫酸偏大,则氨气的含量偏小;步骤Ⅳ中,滴定时还必须选用的仪器是③滴定架、⑥碱式滴定管;
(4)测定NH含量时,,滴定终点时消耗25.00 mL NaOH标准溶液,所以剩余的n(H+)=0.120mol/L×0.025L=0.003mol,所以n(NH)=3.030mol/L×0.05L×2-0.003mol=0.3mol;测定SO含量时,BaSO4的物质的量为0.3mol,则(NH4)2SO4的物质的量为0.15mol,FeSO4的物质的量为0.15mol,则根据M的计算公式可得,132×0.15+152×0.15+18×n水=58.8,则n水=0.9,则根据比例可得硫酸亚铁铵晶体的化学式为(NH4)2SO4·FeSO4·6H2O。
15.(1)CaCO3+2H+=Ca2++CO2↑+H2O
(2) d f c g b
(3) 浓硫酸 判断装置中空气是否排尽
(4)防止钠与空气中的氧气反应
(5)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
(6)4Na+3CO22Na2CO3+C
【分析】装置a为碳酸钙和稀盐酸反应制取二氧化碳,由于盐酸易挥发,先用装置d除去HCl杂质气体,再经装置f中浓硫酸来干燥二氧化碳,装置c将镁和二氧化碳反应,为防止空气的水蒸气进入c,用装置g来干燥空气,装置b来判断装置中空气是否排尽;
【详解】(1)装置a是简易启普发生器,作用是就是制取二氧化碳,反应的离子方程式:CaCO3+2H+=Ca2++CO2↑+H2O
(2)按照气流的方向从左至右应该是二氧化碳制备、除去二氧化碳中混有HCl和水蒸气(除水时用f,不用g,原因是保证水除尽)、钠与二氧化碳反应装置、防止水进入装置、检验二氧化碳是否充满的装置。故答案为:dfcgb
(3)装置f防止g中水蒸气进入d装置,应盛放的试剂是浓硫酸;装置b的作用是判断装置中空气是否排尽;
(4)在点燃c装置中的酒精灯前,必须除去系统内内的空气,防止钠与空气中的氧气反应;
(5)该黑色不溶物为碳,碳可以和浓硫酸反应生成二氧化碳、二氧化硫和水,即C+2H2SO4(浓)CO2↑+2SO2↑+2H2O;
(6)通过对生成物进行了探究实验可得出钠与二氧化碳反应生成了碳酸钠和碳,可以写出反应的方程式:4Na+3CO22Na2CO3+C。
新疆高考化学三年(2021-2023)模拟题汇编-02离子反应: 这是一份新疆高考化学三年(2021-2023)模拟题汇编-02离子反应,共21页。试卷主要包含了单选题,填空题,实验题,工业流程题等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-11水溶液中的离子反应和平衡: 这是一份山西高考化学三年(2021-2023)模拟题汇编-11水溶液中的离子反应和平衡,共50页。试卷主要包含了单选题,实验题,工业流程题,原理综合题等内容,欢迎下载使用。
山西高考化学三年(2021-2023)模拟题汇编-02离子反应: 这是一份山西高考化学三年(2021-2023)模拟题汇编-02离子反应,共13页。试卷主要包含了单选题,实验题等内容,欢迎下载使用。












