


高中化学重要知识点易错点整理
展开
排查点一元素化合物1.漂白粉可用于生活用水的消毒。2.氢氧化铝可用于中和过多胃酸。3.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火。4.钠与O 2的反应产物与反应条件有关,即使钠在少量O 2中燃烧也生成Na 2O 2。5.常温下铁、铝遇浓HNO 3、浓H 2SO 4发生钝化。钝化并不是不反应,而是属于化学变化,钝化体现了浓HNO 3和浓H 2SO 4的强氧化性。6.1 mol Na 2O 2固体中含离子总数为3 N A。7.1 mol Na 2O 2参与反应转移电子的物质的量不一定为1 mol。8.钠与盐溶液反应,不能置换出盐的金属。9.往盛有足量NH 3的饱和NaCl溶液中通入足量的CO 2,反应方程式是:NaCl(饱和)+NH 3+CO 2+H 2O===NaHCO 3↓+NH 4Cl。10.往BaCl 2、CaCl 2、Ba(NO 3) 2等溶液中通入CO 2气体不发生反应,而往Ca(ClO) 2、NaAlO 2、Na 2SiO 3溶液中通入CO 2发生反应。11.往Ca(ClO) 2、Ba(NO 3) 2溶液中通入SO 2气体发生反应生成白色沉淀。12.Al 2O 3、Al(OH) 3既能与盐酸,又能与氢氧化钠溶液反应。13.Al 2O 3、MgO可用作耐高温材料。14.并不是铝与所有金属氧化物均能组成铝热剂。15.铁与氯气反应只能生成FeCl 3,氮气与氧气反应只能生成NO,硫在氧气中燃烧只生成二氧化硫,铁与足量稀HNO 3反应只生成硝酸铁。16.Fe与O 2点燃Fe与H 2O(g)(高温)反应的固体产物都是Fe 3O 4而不是Fe 2O 3。17.铜在潮湿的空气中最终不是生成CuO,而是生成铜绿[Cu 2(OH) 2CO 3]。18.SiO 2可用于制光导纤维,硅可制光电池。19.酸性氧化物一般能与水反应生成相应的酸,但SiO 2不溶于水;酸性氧化物一般不与酸作用,但SiO 2能与氢氟酸反应。20.SO 2使含有酚酞的NaOH溶液褪色,表现SO 2酸性氧化物的性质;使品红溶液褪色,表现SO 2的漂白性;使溴水、酸性KMnO 4溶液褪色,表现SO 2的还原性;SO 2与H 2S反应,表现SO 2的氧化性;SO 2和Cl 2等体积混合通入溶液中,漂白性不但不增强,反而消失。21.把SO 2气体通入BaCl 2溶液中,没有沉淀生成,但若通入NH 3或加入NaOH溶液,或把BaCl 2改成Ba(NO 3) 2均有白色沉淀生成,前两者生成BaSO 3沉淀,后者生成BaSO 4沉淀。22.浓硝酸和Cu(足量)、浓硫酸和Cu(足量)、浓盐酸和MnO 2(足量)在反应时,随反应的进行,产物会发生变化或反应停止。23.强氧化性酸(如HNO 3、浓硫酸)与金属反应不生成H 2;金属与浓硝酸反应一般生成NO 2,而金属与稀硝酸反应一般生成NO。24.实验室制备NH 3,除了用Ca(OH) 2和NH 4Cl反应外,还可用浓氨水的分解(加NaOH固体或加CaO或加热)制取。而检验NH 4+需用NaOH溶液并加热,用湿润的红色石蕊试纸检验生成的气体,以确定NH4+的存在。25.Cu和一定量的浓硝酸反应,产生的是NO 2和NO的混合气体,当Cu有剩余时,再加入稀硫酸,Cu可继续溶解。排查点2基本理论、基本概念1.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物。2.酸性氧化物不一定是非金属氧化物,非金属氧化物也不一定是酸性氧化物。3.含有离子键的化合物一定是离子化合物,共价化合物一定不含离子键。4.同种元素组成的物质可能是纯净物,也可能是混合物。 6.比例模型:如甲烷的比例模型:
6.比例模型:如甲烷的比例模型: 7.球棍模型:如甲烷的球棍模型:
7.球棍模型:如甲烷的球棍模型: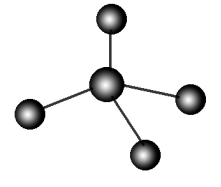 8.Cl、Br、I的+1价含氧酸的结构式都可用“
8.Cl、Br、I的+1价含氧酸的结构式都可用“ ”表示。9.熔融状态下能导电的化合物是离子化合物,熔融状态下不能导电的化合物是共价化合物。10.ClO -不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO -与SO 32-、I -、Fe 2+均不能大量共存;ClO -能水解,因HClO酸性很弱,ClO -水解使溶液显碱性,如Fe 3++3ClO -+3H 2O===Fe(OH) 3↓+3HClO,所以ClO -与Fe 3+、Al 3+均不能大量共存。11.比较元素非金属性强弱时,应是该元素最高价氧化物对应水化物酸性的强弱,而不是非金属元素对应氢化物酸性的强弱。12.化学键影响物质的化学性质,如稳定性等;分子间作用力和氢键影响物质的物理性质,如熔、沸点等。13.常见吸热反应:所有盐的水解和电离过程、大多数的分解反应。常见放热反应:燃烧、爆炸反应、金属与酸的置换、酸碱中和反应、2NO 2N 2O 4、大多数的化合反应是放热的。14.原电池放电时,电解质溶液中的离子是阳离子向正极移动,阴离子向负极移动。15.原电池充电时,电解质溶液中的离子是阳离子向负极移动,阴离子向正极移动。16.原电池放电时,盐桥中的离子是阳离子向正极移动、阴离子向负极移动。17.电解池里电解质溶液中离子的移动方向为:阳离子向阴极移动,阴离子向阳极移动。18.钢铁的析氢腐蚀或吸氧腐蚀的负极反应均为Fe-2e -===Fe 2+。19.金属腐蚀快慢与两极材料的活泼性有关,活泼性相差越大,金属腐蚀越快。20.金属腐蚀快慢与接触介质有关,一般在非电解质溶液中的腐蚀较慢。21.升高温度,不论吸热还是放热反应,也不论正反应速率还是逆反应速率都增大。22.向恒温恒容已达平衡的反应体系中,充入“惰性气体”(不参加反应的气体),对平衡无影响。23.增大压强(缩小体积),化学平衡向气体物质的量减小的方向移动,但 v 正、 v 逆均增大。24.平衡常数 K 只受温度影响,既与任何一种反应物或生成物的浓度变化无关,也与压强的改变无关。25.对于一个可逆反应,若升高温度, K 值增大,则正反应为吸热反应。26.盐水解规律:有弱才水解,越弱越水解,谁强显谁性,同强显中性,越热越水解,越稀越水解。27.除去酸性溶液ZnCl 2溶液中的FeCl 2,应先通入Cl 2或加入H 2O 2,再加入ZnO,使Fe 3+水解生成沉淀过滤除去。28.FeCl 3、Fe 2(SO 4) 3的水溶液蒸干所得固体不同:FeCl 3溶液加热蒸干得Fe(OH) 3,灼烧Fe(OH) 3可得Fe 2O 3;Fe 2(SO 4) 3溶液蒸干仍为Fe 2(SO 4) 3。29.弱酸酸式盐水溶液酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。30.碳酸钙与稀盐酸反应,实质是H +与沉淀溶解平衡中的CO 32-反应,促进平衡向生成离子的方向移动。31.盐溶液蒸干后并灼烧,有的能得到原溶质,有的不能得到原溶质而转化成其他物质,有的得不到任何物质。排查点3化学实验1.使用容量瓶、滴定管、分液漏斗第一步操作是“检漏”。2.配制Fe 2+、Sn 2+等易水解、易被氧化的盐溶液,先把蒸馏水煮沸,再溶解,并加少量相应金属粉末和相应酸。3.酸式滴定管不能装碱性溶液,碱式滴定管不能装酸性及氧化性溶液。4.容量瓶不能长期存放溶液,更不能作为反应容器,也不可加热,瓶塞不可互用。5.烧瓶、烧杯、锥形瓶不可直接加热。6.能与盐酸反应产生有刺激性气味的无色气体,且产生的气体能使品红溶液褪色,加热又恢复原色的,只有SO32-和HSO3-。7.点燃可燃性气体(如H 2、CO、CH 4、C 2H 4)或用CO、H 2还原Fe 2O 3、CuO之前,要检验气体的纯度。8.制取有毒气体(如Cl 2、CO、SO 2、H 2S、NO 2、NO)时,应在通风橱中进行,且进行尾气处理。9.加热法制取并用排水法收集气体或吸收溶解度较大的气体(如NH 3、HCl)时,要注意熄灯顺序或加装安全瓶。排查点4有机化学1.淀粉、纤维素、蛋白质都是天然高分子化合物,它们都是混合物。2.能与Na 2CO 3或NaHCO 3溶液反应放出CO 2或使石蕊试液变红的有机物中必含有—COOH。3.能发生消去反应的有机物为醇或卤代烃。遇浓硝酸变黄,可推知该物质是含有苯环结构的蛋白质。遇碘水变蓝,可推知该物质为淀粉。加入过量浓溴水,出现白色沉淀,可推知该物质为苯酚或其衍生物。4.能发生水解反应的有机物为卤代烃、酯、二糖、多糖、蛋白质或含有肽键的物质。5.检验卤代烃中的卤元素时,在水解后的溶液中先加稀HNO 3再加AgNO 3溶液。6.检验蔗糖、淀粉等是否水解时,先在水解后溶液中加NaOH溶液中和,后加银氨溶液或Cu(OH) 2悬浊液。
”表示。9.熔融状态下能导电的化合物是离子化合物,熔融状态下不能导电的化合物是共价化合物。10.ClO -不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO -与SO 32-、I -、Fe 2+均不能大量共存;ClO -能水解,因HClO酸性很弱,ClO -水解使溶液显碱性,如Fe 3++3ClO -+3H 2O===Fe(OH) 3↓+3HClO,所以ClO -与Fe 3+、Al 3+均不能大量共存。11.比较元素非金属性强弱时,应是该元素最高价氧化物对应水化物酸性的强弱,而不是非金属元素对应氢化物酸性的强弱。12.化学键影响物质的化学性质,如稳定性等;分子间作用力和氢键影响物质的物理性质,如熔、沸点等。13.常见吸热反应:所有盐的水解和电离过程、大多数的分解反应。常见放热反应:燃烧、爆炸反应、金属与酸的置换、酸碱中和反应、2NO 2N 2O 4、大多数的化合反应是放热的。14.原电池放电时,电解质溶液中的离子是阳离子向正极移动,阴离子向负极移动。15.原电池充电时,电解质溶液中的离子是阳离子向负极移动,阴离子向正极移动。16.原电池放电时,盐桥中的离子是阳离子向正极移动、阴离子向负极移动。17.电解池里电解质溶液中离子的移动方向为:阳离子向阴极移动,阴离子向阳极移动。18.钢铁的析氢腐蚀或吸氧腐蚀的负极反应均为Fe-2e -===Fe 2+。19.金属腐蚀快慢与两极材料的活泼性有关,活泼性相差越大,金属腐蚀越快。20.金属腐蚀快慢与接触介质有关,一般在非电解质溶液中的腐蚀较慢。21.升高温度,不论吸热还是放热反应,也不论正反应速率还是逆反应速率都增大。22.向恒温恒容已达平衡的反应体系中,充入“惰性气体”(不参加反应的气体),对平衡无影响。23.增大压强(缩小体积),化学平衡向气体物质的量减小的方向移动,但 v 正、 v 逆均增大。24.平衡常数 K 只受温度影响,既与任何一种反应物或生成物的浓度变化无关,也与压强的改变无关。25.对于一个可逆反应,若升高温度, K 值增大,则正反应为吸热反应。26.盐水解规律:有弱才水解,越弱越水解,谁强显谁性,同强显中性,越热越水解,越稀越水解。27.除去酸性溶液ZnCl 2溶液中的FeCl 2,应先通入Cl 2或加入H 2O 2,再加入ZnO,使Fe 3+水解生成沉淀过滤除去。28.FeCl 3、Fe 2(SO 4) 3的水溶液蒸干所得固体不同:FeCl 3溶液加热蒸干得Fe(OH) 3,灼烧Fe(OH) 3可得Fe 2O 3;Fe 2(SO 4) 3溶液蒸干仍为Fe 2(SO 4) 3。29.弱酸酸式盐水溶液酸碱性,取决于酸式酸根离子电离程度和水解程度的相对大小。30.碳酸钙与稀盐酸反应,实质是H +与沉淀溶解平衡中的CO 32-反应,促进平衡向生成离子的方向移动。31.盐溶液蒸干后并灼烧,有的能得到原溶质,有的不能得到原溶质而转化成其他物质,有的得不到任何物质。排查点3化学实验1.使用容量瓶、滴定管、分液漏斗第一步操作是“检漏”。2.配制Fe 2+、Sn 2+等易水解、易被氧化的盐溶液,先把蒸馏水煮沸,再溶解,并加少量相应金属粉末和相应酸。3.酸式滴定管不能装碱性溶液,碱式滴定管不能装酸性及氧化性溶液。4.容量瓶不能长期存放溶液,更不能作为反应容器,也不可加热,瓶塞不可互用。5.烧瓶、烧杯、锥形瓶不可直接加热。6.能与盐酸反应产生有刺激性气味的无色气体,且产生的气体能使品红溶液褪色,加热又恢复原色的,只有SO32-和HSO3-。7.点燃可燃性气体(如H 2、CO、CH 4、C 2H 4)或用CO、H 2还原Fe 2O 3、CuO之前,要检验气体的纯度。8.制取有毒气体(如Cl 2、CO、SO 2、H 2S、NO 2、NO)时,应在通风橱中进行,且进行尾气处理。9.加热法制取并用排水法收集气体或吸收溶解度较大的气体(如NH 3、HCl)时,要注意熄灯顺序或加装安全瓶。排查点4有机化学1.淀粉、纤维素、蛋白质都是天然高分子化合物,它们都是混合物。2.能与Na 2CO 3或NaHCO 3溶液反应放出CO 2或使石蕊试液变红的有机物中必含有—COOH。3.能发生消去反应的有机物为醇或卤代烃。遇浓硝酸变黄,可推知该物质是含有苯环结构的蛋白质。遇碘水变蓝,可推知该物质为淀粉。加入过量浓溴水,出现白色沉淀,可推知该物质为苯酚或其衍生物。4.能发生水解反应的有机物为卤代烃、酯、二糖、多糖、蛋白质或含有肽键的物质。5.检验卤代烃中的卤元素时,在水解后的溶液中先加稀HNO 3再加AgNO 3溶液。6.检验蔗糖、淀粉等是否水解时,先在水解后溶液中加NaOH溶液中和,后加银氨溶液或Cu(OH) 2悬浊液。





