

高中化学复习微专题大素养专练含答案01
展开【常考易错点】
一、气体状态与体积
1.判断正误(正确的打“√”,错误的打“×”)
(1)标准状况下,22.4 L己烷中含共价键数目为19NA( )
(2)常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA( )
(3)标准状况下,2.24 L HF含有的HF分子数为0.1NA( )
(4)标准状况下,2.24 L三氯甲烷含有的分子数目为0.1NA( )
(5)22.4 L(标准状况)氩气含有的质子数为18NA( )
(6)常温常压下,124 g P4中所含P—P键数目为4NA( )
(7)标准状况下,2.24 L CCl4含有的共价键数为0.4NA( )
[提醒] 解答此类试题,突破的关键是抓住“三看”:
二、微粒的组成与结构
2.判断正误(正确的打“√”,错误的打“×”)
(1)在常温常压下,32 g 18O2中含有2NA个氧原子( )
(2)17 g —OH与17 g OH-所含电子数均为10NA( )
(3)相同质量的N2O4与NO2中所含原子数目相同( )
(4)标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA( )
(5)18 g D2O所含的电子数为10NA( )
(6)1 ml Na2O2固体中含离子总数为4NA( )
(7)31 g白磷中含有的共价键数为1.5NA( )
82.0 g H218O与D2O的混合物中所含中子数为NA( )
(9)常温常压下,32 g O2和O3的混合气体中含有的原子数为2NA( )
(10)56 g乙烯中所含共用电子对数目为12NA( )
(11)78 g苯中含有3NA碳碳双键( )
(12)60 ℃时,92 g NO2与N2O4的混合气体中含有的原子总数为6NA( )
[提醒] 熟记特殊物质的组成结构
(1)记特殊物质中所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、—OH、OH-等,理清整体与部分的关系。
(2)记最简式相同的物质,构建解答混合物的模型,如NO2和N2O4、乙烯(C2H4)和丙烯(C3H6)、O2和O3等。
(3)记摩尔质量相同的物质,如N2、CO、C2H4;H2SO4和H3PO4等。
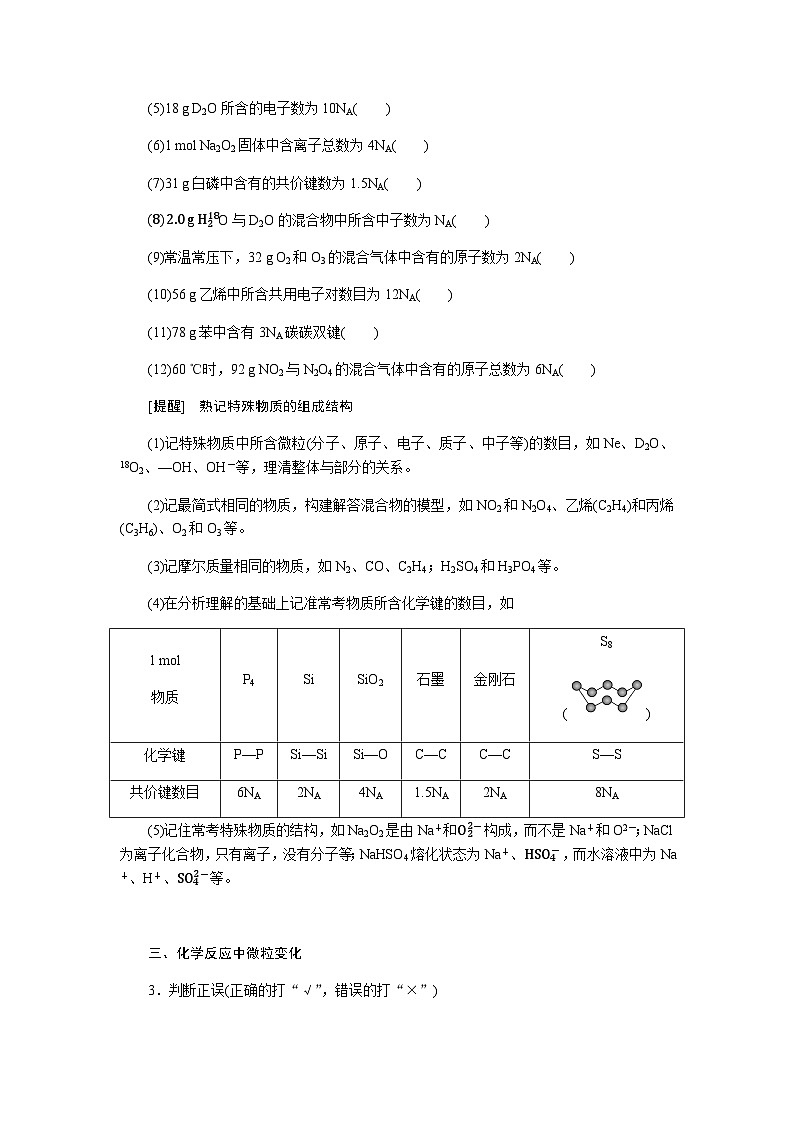
(4)在分析理解的基础上记准常考物质所含化学键的数目,如
(5)记住常考特殊物质的结构,如Na2O2是由Na+和O22-构成,而不是Na+和O2-;NaCl为离子化合物,只有离子,没有分子等;NaHSO4熔化状态为Na+、HSO4-,而水溶液中为Na+、H+、SO42-等。
三、化学反应中微粒变化
3.判断正误(正确的打“√”,错误的打“×”)
(1)5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA( )
(2)2 ml SO2和1 ml O2在一定条件下充分反应后,混合物的分子数为2NA( )
(3)50 mL 12 ml·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA( )
(4)0.1 ml Zn与含0.1 ml HCl的盐酸充分反应,转移的电子数目为0.2NA( )
(5)1 ml Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA( )
(6)密闭容器中2 ml NO与1 ml O2充分反应,产物的分子数为2NA( )
(7)1 ml SO2和4 ml O2在一定条件下,充分反应后,转移电子数为2NA( )
(8)100 g 17%的氨水,溶液中含有的NH3分子数为NA( )
(9)向2 L 2 ml·L-1的盐酸中,加入足量MnO2,充分反应后,生成的Cl2在标准状况下为22.4 L( )
(10)将0.1 ml Cl2通入足量水中,充分反应后,转移电子的个数为0.1NA( )
【提醒】
(一)
(二)熟记常见的特殊反应、隐含反应及特殊变化
四、溶液中的微粒数目
4.判断正误(正确的打“√”,错误的打“×”)
(1)0.1 L 3.0 ml·L-1的NH4NO3溶液中含有的NH4+的数目为0.3NA( )
(2)等体积、等物质的量浓度的NaCl和KCl溶液中,阴、阳离子数目之和均为2NA( )
(3)0.1 ml·L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA( )
(4)25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA( )
(5)1 L 0.1 ml·L-1的Na2CO3溶液中所含氧原子数目为0.3NA( )
(6)25 ℃时,1 L pH=12的氨水中,含有OH-的数目为0.01NA( )
(7)pH=1的H3PO4溶液中,含有0.1NA个H+( )
[提醒]
(1)明确是否有弱电解质或可水解的盐(即溶液中是否存在平衡)如1 L 0.1 ml·L-1的乙酸溶液中存在CH3COOH⇌CH3COO-+H+电离平衡,1 L 0.1 ml·L-1的乙酸钠溶液中存在
CH3COO-+H2O⇌CH3COOH+OH-水解平衡,故两溶液中含有的CH3COO-数目都小于0.1NA。
(2)明确所给条件是否与电解质的化学式有关。如1 L pH=1的HCl、H2SO4中所含H+数目均为NA,而1 L 0.1 ml·L-1 HCl、H2SO4中所含H+数目与化学式有关(分别为0.1NA、0.2NA)。
(3)明确是否注明溶液体积。
【素养专练】
1.下列说法正确的是( )
A.同温同压下,O2和CO2的密度相同
B.质量相同的H2O和D2O(重水)所含的原子数相同
C.物质的量相同的CH3CH2OH和CH3OCH3所含共价键数相同
D.室温下,pH相同的盐酸和硫酸中,溶质的物质的量浓度相同
2.设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.14 g乙烯和丙烯混合气体中的氢原子数为2NA
B.1 ml N2与4 ml H2反应生成的NH3分子数为2NA
C.1 ml Fe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
3.设NA为阿伏加德罗常数的值,下列说法错误的是( )
A.7 g CnH2n中含有NA个碳氢共价键
B.标准状况下,22.4 L CHCl3中含有3NA个氯原子
C.含0.3 ml NH4NO3与a ml NH3·H2O的中性溶液中含0.3NA个NH4+
D.1 ml Na与O2反应生成Na2O和Na2O2的混合物的过程中失去NA个电子
4.[2023·河北衡水中学一模]NA表示阿伏加德罗常数的值。下列说法错误的是( )
A.标准状况下,11.2 L正丁烷所含极性键的数目为5NA
B.常温常压下,1 ml Na218O2中含有的中子数为44NA
C.1 L pH均为2的盐酸和醋酸溶液,氢离子数均为0.01NA
D.64 g铜与足量硫粉加热充分反应,转移电子数为2NA
5.[2023·唐山一模]阿伏加德罗常数的值用NA表示,下列叙述正确的是( )
A.室温时,1 L pH=2的NH4Cl溶液中所含H+的数目为1×10-12NA
B.1 ml LiAlH4在125 ℃时完全分解生成LiH、H2、Al,转移电子数为3NA
C.1.7 g氨气中含有共价键的数目为0.4NA
D.标准状况下,22.4 L NO2含有的原子数小于3NA
6.NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.在0 ℃、101 kPa条件下,11.2 L丁烷中含极性共价键数目为5NA
B.含23 g钠元素的Na2O和Na2O2混合物中阴离子数目介于0.5NA和NA之间
C.5NH4NO3≜4N2↑+2HNO3+9H2O中当氧化产物比还原产物每多14 g时,转移电子数为15 NA
D.用惰性电极电解饱和碳酸钠溶液时,电路上通过2 ml电子时产生气体分子总数为NA
7.阿伏加德罗常数的值为NA,实验室制备联氨(N2H4)的化学方程式为2NH3+NaClO===N2H4+NaCl+H2O。下列说法正确的是( )
A.0.1 ml N2H4中所含质子数为1.6NA
B.0.1 ml·L-1的NaClO溶液中,ClO-的数量为0.1NA
C.消耗4.48 L NH3时,转移电子数为0.2NA
D.1.6 g N2H4中存在共价键总数为0.25NA
【练后总结】
1.结构特点再强调
在分析理解的基础上记准常考物质所含化学键的数目,如
2.反应特点再提醒
(1)反应为可逆反应,反应物不能完全转化,如:
(2)明确是否“钝化”
常温下,铁、铝遇浓硫酸、浓硝酸发生“钝化”。
(3)明确反应是否有“浓度的变化”,导致反应不能进行完全或反应发生变化。
如:MnO2+4HCl(浓) ≜MnCl2+Cl2↑+2H2O,
MnO2+HCl(稀) × Cu+2H2SO4(浓) ≜CuSO4+SO2↑+2H2O,
Cu+H2SO4(稀) × Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
(4)有些反应反应物的用量不一样,反应不一样。如二氧化碳与碱的反应,碳酸钠与盐酸的反应,石灰水与碳酸氢钠的反应等。
3.“氧化还原”再注意
(1)同一种物质在不同反应中氧化剂、还原剂的判断。如①Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂;②Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反应,Na2O2只作氧化剂。
(2)量不同,所表现的化合价不同。如Fe和HNO3反应,Fe不足,生成Fe3+;Fe过量,生成Fe2+。
(3)氧化剂或还原剂不同,所表现的化合价不同。如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。
(4)注意氧化还原的顺序。如向FeI2溶液中通入Cl2,Cl2首先氧化I-,再氧化Fe2+。
微专题·大素养①
1.答案:(1)× (2)× (3)× (4)× (5)√ (6)× (7)×
2.答案:(1)× (2)× (3)√ (4)× (5)× (6)× (7)√ (8)√ (9)√ (10)√ (11)× (12)√
3.答案:(1)× (2)× (3)× (4)× (5)√ (6)× (7)× (8)× (9)× (10)×
4.答案:(1)× (2)× (3)× (4)× (5)× (6)√ (7)×
【素养专练】
1.解析:同温同压下,O2和CO2的密度之比为32∶44,A说法错误;质量相同的H2O和D2O(重水)的物质的量之比为20∶18,分子中均含有3个原子,则所含的原子数之比为20∶18,B说法错误;每个CH3CH2OH和CH3OCH3中含共价键数均为8条,则物质的量相同的CH3CH2OH和CH3OCH3所含共价键数相同,C说法正确;室温下,pH相同的盐酸和硫酸中,氢离子的浓度相等,硫酸是二元强酸,而盐酸是一元强酸,故pH相同的盐酸和硫酸的物质的量浓度不相同,D说法错误。
答案:C
2.解析:A项,乙烯和丙烯的最简式均为CH2,14 g乙烯和丙烯混合气体中相当于含有1 ml CH2,则其氢原子数为2NA,正确;B项,合成氨的反应是可逆反应,则1 ml N2与4 ml H2反应生成的NH3分子数小于2NA,错误;C项,铁和过量硝酸反应生成硝酸铁,故1 ml Fe溶于过量硝酸,电子转移数为3NA,错误;D项,标准状况下CCl4为液态,故2.24 L CCl4的物质的量不是0.1 ml,则其含有的共价键数不是0.4NA,错误。
答案:A
3.解析:CnH2n的最简式为CH2,其物质的量为 eq \f(7 g,14 g·ml-1) =0.5 ml,碳氢键个数为0.5 ml×2NA ml-1=NA,A项正确;CHCl3标准状况下为液体,不能利用n= eq \f(V,Vm) 进行计算,B项错误;由于溶液呈中性,故NH eq \\al(\s\up1(+),\s\d1(4)) 的水解程度与NH3·H2O的电离程度相当,NH eq \\al(\s\up1(+),\s\d1(4)) 的物质的量与NH4NO3相同,为0.3 ml,C项正确;均失1 e-,故1 ml Na反应时失电子总数为NA,D项正确。
答案:B
4.解析:A项,正丁烷分子式为C4H10,分子中含10个C—H,故标准状况下11.2 L正丁烷中所含极性键的数目为5NA,正确;B项,Na eq \\al(\s\up1(18),\s\d1(2)) O2中含有的中子数为12×2+10×2=44,故1 ml Na eq \\al(\s\up1(18),\s\d1(2)) O2中含有的中子数为44NA,正确;C项,pH为2的盐酸、醋酸中c(H+)=0.01 ml·L-1,故1 L溶液中所含n(H+)=0.01 ml·L-1×1 L=0.01 ml,正确;D项,Cu与S反应的产物为Cu2S,故1 ml Cu参加反应时转移电子数为NA,错误。
答案:D
5.解析:A项,室温时,1 L pH=2的NH4Cl溶液中所含H+的数目为0.01NA;B项,1 ml LiAlH4在125 ℃时完全分解生成LiH、H2、Al,反应中Al元素的化合价从+3价降低到0价,因此转移电子数为3NA;C项,1.7 g氨气的物质的量是0.1 ml,其中含有共价键的数目为0.3NA;D项,标准状况下,NO2不是气体。
答案:B
6.解析:在0 ℃、101 kPa条件下,11.2 L丁烷的物质的量为0.5 ml,其中含极性共价键(C—H)的物质的量为0.5 ml×10=5 ml,故A正确;根据钠原子守恒,含23 g钠元素的Na2O和Na2O2混合物的物质的量为0.5 ml,而Na2O和Na2O2均由2个钠离子和1个阴离子构成,故其中阴离子数目为0.5NA,故B错误;5NH4NO3 eq \(=====,\s\up7(△)) 4N2↑+2HNO3+9H2O中氧化产物和还原产物均为氮气,其中氧化产物与还原产物的物质的量之比为5∶3,当氧化产物比还原产物每多14 g时,共生成氮气2 ml,转移电子数为7.5NA,故C错误;用惰性电极电解饱和碳酸钠溶液,相当于电解水,当电路上通过2 ml电子时产生1 ml H2、0.5 ml O2,分子总数为1.5NA,故D错误。
答案:A
7.解析:1个N2H4分子中含有18个质子,A项错误;未指明NaClO溶液的体积,无法计算,B项错误;气体所处的状况未知,无法计算,C项错误;1个N2H4分子中存在1个N—N键和4个N—H键,1.6 g N2H4的物质的量为 eq \f(1.6 g,32 g·ml-1) =0.05 ml,存在共价键0.05 ml×5=0.25 ml,D项正确。
答案:D
1 ml
物质
P4
Si
SiO2
石墨
金刚石
S8
()
化学键
P—P
Si—Si
Si—O
C—C
C—C
S—S
共价键数目
6NA
2NA
4NA
1.5NA
2NA
8NA
1 ml物质
P4
Si
SiO2
石墨
金刚石
S8
()
化学键
P—P
Si—Si
Si—O
C—C
C—C
S—S
共价键
数目
6NA
2NA
4NA
1.5NA
2NA
8NA
高中化学复习微专题大素养专练含答案18: 这是一份高中化学复习微专题大素养专练含答案18,共16页。
高中化学复习微专题大素养专练含答案16: 这是一份高中化学复习微专题大素养专练含答案16,共4页。试卷主要包含了基团连接法,换位思考法,拆分法,等效氢法等内容,欢迎下载使用。
高中化学复习微专题大素养专练含答案13: 这是一份高中化学复习微专题大素养专练含答案13,共17页。试卷主要包含了已知反应,已知等内容,欢迎下载使用。












