

适用于新教材2024版高考化学一轮总复习第五章课时规范练24元素推断与物质的性质新人教版
展开课时规范练24
一、选择题:每小题只有1个选项符合题意。
1.(2023天津十二区县重点中学联考)X、Y、Z、R、W为原子序数依次增大的前20号主族元素,X元素原子失去一个电子后是“裸露”质子;R原子最外层电子数是其内层电子总数的一半;X、Y、Z、R形成化合物表示为[YX4]+[X2RZ4]-;W是前20号元素中金属性最强的。下列说法正确的是( )
A.离子半径:W+<Z2-
B.键能:Y-X>R-X
C.第一电离能:Z>Y>X
D.Y、Z、W形成的盐水溶液都呈中性
答案:B
解析:X元素原子失去一个电子后是“裸露”质子,X是H元素,R原子最外层电子数是其内层电子总数的一半,则R为第三周期元素,R为P元素。由[YX4]+[X2RZ4]-可知,Y是N元素、Z是O元素;W是前20号元素中金属性最强的,W为K元素。电子层数越多,粒子半径越大,则离子半径:W+>Z2-,A错误;非金属性越强,气态氢化物越稳定,因此NH3比PH3稳定,则NH3的能量较低,N—H的键能比P—H的大,B正确;同一周期从左到右,第一电离能呈逐渐增大的趋势,N原子的2p是半充满结构,第一电离能大于相邻元素,O、N、H的第一电离能大小顺序为N>O>H,C错误;N、O、K可形成KNO3、KNO2两种常见盐,后者发生水解,其水溶液显碱性,D错误。
2.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,Y的原子序数是X的2倍,由此可知( )
W | X |
|
| Y | Z |
A.原子半径:Z>Y>X
B.Y的单核阴离子还原性比X的强
C.Z的氧化物对应水化物的酸性一定比Y的强
D.简单氢化物的热稳定性:W>X
答案:B
解析:由四种短周期元素在元素周期表中的相对位置可知,W、X处于第二周期,Y、Z处于第三周期,且位于元素周期表的第ⅢA~ⅦA族。Y的原子序数是X的2倍,且X和Y处于同主族,由于短周期同主族相邻两种元素的原子序数相差8,从而推知,X是O元素,Y是S元素,W是N元素,Z是Cl元素。原子半径:S>Cl>O,A错误;元素的非金属性:O>S,则阴离子的还原性:S2->O2-,B正确;元素的非金属性:Cl>S,则最高价氧化物对应水化物的酸性:HClO4>H2SO4,但低价含氧酸则不一定,如HClO的酸性比H2SO3弱,C错误;元素的非金属性:N<O,则简单氢化物的热稳定性:NH3<H2O,D错误。
3.短周期主族元素a、b、c、d的原子序数依次增大,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族序数相同;d与a同主族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中c的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性弱
答案:D
解析:由题给信息推知,a、b、c、d分别为O、Na(或Mg)、Al、S元素。根据周期表中原子半径变化规律可得,原子半径:Na(或Mg)>Al>S>O,A错误;同周期主族元素从左到右,元素的金属性逐渐减弱,则金属性:Na(或Mg)>Al,故四种元素中b的金属性最强,B错误;Al(OH)3是两性氢氧化物,不是强碱,C错误;元素的非金属性:O>S,则单质的氧化性:O2>S,D正确。
4.(2023广东茂名调研)某化合物可用于制造激光器,其结构如图所示。已知元素X、Y、Z、W原子序数依次递增,且均不大于20,X与W同族,元素W的原子比Z原子多4个电子。下列说法正确的是( )
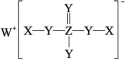
A.非金属性:Z>Y
B.单质的沸点:Z>X>Y
C.该化合物中Z满足8电子稳定结构
D.X、Y和W可形成既含有离子键又含有共价键的化合物
答案:D
解析:由题给信息推知,X、Y、Z、W分别为H元素、O元素、P元素、K元素。非金属性:Y>Z,A错误;单质的沸点:Z>Y>X(P>O2>H2),B错误;Z为P,形成3个共价键为8电子稳定结构,但是该化合物中形成5个共价键,则不是8电子稳定结构,C错误;X、Y和W可形成既含有离子键又含有共价键的化合物,如KOH,D正确。
5.某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素组成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其他原子均满足8电子稳定结构。下列说法正确的是( )
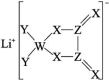
A.W位于第二周期第ⅣA族
B.原子半径:Z>X>Y
C.元素电负性:Y>Z>X
D.最高化合价:Y>Z>W
答案:B
解析:阴离子结构中,W形成3个共价键和1个配位键,X形成2个共价键、Y形成1个共价键、Z形成4个共价键,W、X、Y、Z是四种同周期主族元素,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其他原子均满足8电子稳定结构,则W为B元素、X为O元素、Y为F元素、Z为C元素。W为B元素,位于第二周期第ⅢA族,A错误;同周期元素,从左到右原子半径逐渐减小,则原子半径的大小顺序为C>O>F,B正确;同周期元素,从左到右元素的非金属性逐渐增强,电负性逐渐增大,则电负性的大小顺序为F>O>C,C错误;氟元素的非金属性最强,无正化合价,D错误。
6.五种短周期元素X、Y、Z、M、W的原子序数与其一种常见化合价的关系如图所示,下列关系不正确的是( )
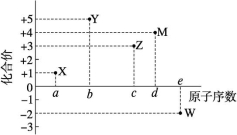
A.元素X可能为锂
B.Z虽是金属,但也能表现出一定的非金属性
C.M是金属元素和非金属元素分界线附近的元素,可用于制造半导体材料
D.最高价氧化物对应水化物的酸性:Y<M
答案:D
解析:X的原子序数最小,且化合价为+1价,则X可能是H元素或Li元素,A正确;Z是Al元素,处于元素周期表中金属与非金属的分界线附近,可表现金属性和非金属性,B正确;M是Si元素,其单质可用于制造半导体材料,C正确;非金属性:N>Si,则最高价氧化物对应水化物的酸性:HNO3>H2SiO3,D错误。
7.(2021浙江6月选考)现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如下表:
元素 | 相关信息 |
X | 最外层电子数是核外电子总数的一半 |
Y | 最高化合价和最低化合价之和为零 |
Z | 单质为黄色固体,常存在于火山喷口附近 |
Q | 同周期元素中原子半径最小 |
下列说法正确的是( )
A.常温时,X单质能与水发生剧烈反应
B.Y与Q元素组成的YQ4分子,空间结构为正四面体形
C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱
D.第五周期且与Q同主族元素的单质在常温常压下呈液态
答案:B
解析:X原子的最外层电子数是核外电子总数的一半,由于最外层电子数不超过8个,X只能是第二周期的Be元素;Y元素的最高化合价和最低化合价之和为零,位于第ⅣA族,Y是C元素或Si元素;Z单质为黄色固体,常存在于火山喷口附近,则Z是S元素;Q是同周期主族元素中原子半径最小的,且Z和Q位于同一周期,则Q是Cl元素。Be的金属性弱于Mg,常温时,镁和冷水不反应,Be单质不能与水发生剧烈反应,A错误;Y与Q元素组成的CCl4或SiCl4分子,空间结构均为正四面体形,B正确;Y、Z、Q三种元素的非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应水化物的酸性依次增强,C错误;第五周期且与Cl元素同主族元素的单质是碘,在常温常压下呈固态,D错误。
8.常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01 mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法不正确的是( )
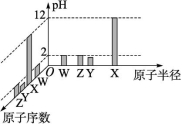
A.X与Y形成的化合物的水溶液呈酸性
B.单质的沸点:Y>Z
C.简单离子半径:Y>Z>W>X
D.ZO2可作为自来水的消毒剂
答案:A
解析:浓度均为0.01mol·L-1的溶液,W、Y、Z的最高价氧化物对应的水化物的pH都小于7,W、Y、Z的最高价氧化物对应的水化物是酸,说明W、Y、Z都是非金属元素,W、Z最高价氧化物对应的水化物的pH=2,为一元强酸,原子序数Z>W,则Z是Cl元素、W是N元素;Y的最高价氧化物对应的水化物的pH<2,应该为二元强酸硫酸,则Y是S元素;X的最高价氧化物对应的水化物的pH=12,应该为一元强碱氢氧化钠,则X是Na元素。X与Y形成的化合物Na2S为强碱弱酸盐,水解后水溶液呈碱性,A错误;常温下硫是固体,氯气为气体,单质的沸点:Y>Z,B正确;离子半径大小为S2->Cl->N3->Na+,即Y>Z>W>X,C正确;ClO2具有强氧化性,能使蛋白质变性,可作为自来水的消毒剂,D正确。
9.一种工业洗涤剂中间体结构式如图所示,其中短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,Y和Q最外层电子数之和是Z原子L层电子数的两倍。下列说法正确的是( )
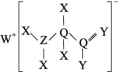
A.X、Z、Q、W均可与Y形成二元化合物
B.简单离子半径:W>Z>Y
C.Y的简单氢化物的稳定性和沸点都低于Z的简单氢化物
D.将W与O2反应后的固体放入水中,观察是否产生气体,即可判断氧化产物种类
答案:A
解析:短周期元素X、Y、Z、Q、W原子的半径依次增大,X和W同主族但不相邻,再结合该物质的结构式可得X为H元素,W为Na元素;Y和Q最外层电子数之和是Z原子L层电子数的两倍,则Y为O元素,Z为N元素,Q为C元素。H元素与O元素可形成H2O、H2O2,O元素与N元素可以形成NO、NO2,O元素与C元素可以形成CO、CO2,O元素与Na元素可形成Na2O、Na2O2,A正确。核外电子数相同时,核电荷数越大,离子半径越小,故离子半径:Na+<O2-<N3-,B错误。O元素的非金属性强于N元素,故H2O的稳定性强于NH3;H2O分子常温为液态,NH3为气态,故沸点高于NH3,C错误。钠与氧气反应后可能有钠剩余,若含有钠,则无论生成氧化钠或过氧化钠与水反应都会有气体生成,D错误。
10.(2023天津东丽区模拟)根据下表给出的信息:
元素及其性质或结构特点 | |||
第m周期元素 | 第m+1周期元素 | ||
X | 该元素最高价氧化物既溶于盐酸又溶于NaOH溶液 | Q | 焰色试验为紫色 |
Y | 原子最高能层上仅有1个电子 | W | 与Z属于同主族元素 |
Z | 该周期中原子半径最小 | ||
推断下列说法不正确的是( )
A.QW晶体中含有离子键
B.氧化性:Z2>W2
C.第一电离能:Q>Y
D.元素的金属性:Y>X
答案:C
解析:Q元素的焰色试验为紫色,则Q为K元素;K元素处于第四周期,m+1=4,则m=3,X位于第三周期,该元素最高价氧化物既溶于盐酸又溶于NaOH溶液,则X为Al元素;Y原子最高能层上仅有1个电子,则Y为Na元素;Z元素在该周期中原子半径最小,则Z为Cl元素;W与Z属于同主族元素,则W为Br元素。KBr为离子晶体,含有离子键,A正确;非金属性越强,对应单质的氧化性越强,非金属性:Cl>Br,则氧化性:Z2>W2,B正确;同主族从上到下第一电离能逐渐减小,则第一电离能:Q<Y,C错误;同周期元素,从左到右,元素金属性依次减弱,则金属性:Y>X,D正确。
11.短周期主族元素W、X、Y、Z的原子半径依次增大。m、n、p是由这些元素组成的二元化合物,r、s、q是其中三种元素对应的单质,m为淡黄色固体,r为黄色固体,W、X、Y位于不同周期。上述物质转化关系如图所示(部分生成物省略),下列说法错误的是( )
![]()
A.物质熔沸点:n>p
B.X、Y可形成离子化合物
C.单质氧化性:X>W
D.X、Y、Z三种元素组成的盐溶液可能呈中性或碱性
答案:B
解析:由题给信息推知,m为Na2O2,n为H2O,r为S,s为H2,p为H2S,q为O2;四种元素:W为H元素,X为O元素,Y为S元素,Z为Na元素。n为H2O,p为H2S,H2O分子间形成氢键,则沸点:H2O>H2S,A正确;X为O元素,Y为S元素,不可能形成离子化合物,B错误;X的单质为O2,W的单质为H2,氧化性:O2>H2,C正确;X为O元素,Y为S元素,Z为Na元素,三者形成的盐为Na2SO4和Na2SO3,前者呈中性,后者呈碱性,D正确。
适用于新高考新教材广西专版2024届高考化学一轮总复习第五章物质结构与性质元素周期律课时规范练17化学键: 这是一份适用于新高考新教材广西专版2024届高考化学一轮总复习第五章物质结构与性质元素周期律课时规范练17化学键,共7页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
适用于新教材2024版高考化学一轮总复习第五章课时规范练28晶体结构与性质新人教版: 这是一份适用于新教材2024版高考化学一轮总复习第五章课时规范练28晶体结构与性质新人教版,共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
适用于新教材2024版高考化学一轮总复习第五章课时规范练25化学键新人教版: 这是一份适用于新教材2024版高考化学一轮总复习第五章课时规范练25化学键新人教版,共3页。












