



鲁科版高中化学选择性必修1第1章化学反应与能量转化章末整合课件
展开
这是一份鲁科版高中化学选择性必修1第1章化学反应与能量转化章末整合课件,共51页。
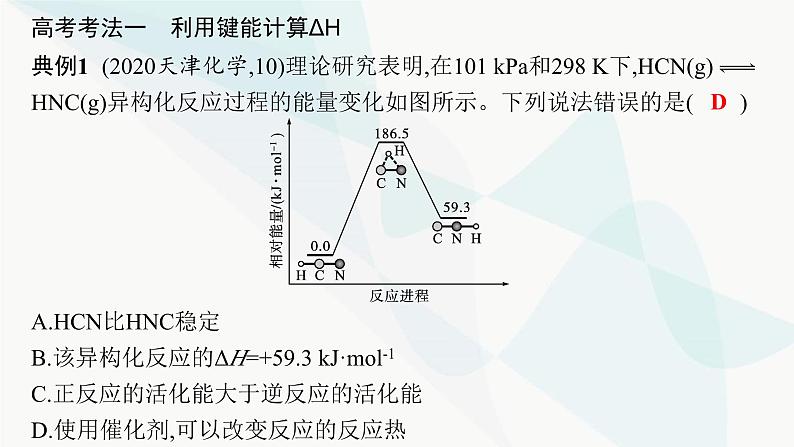
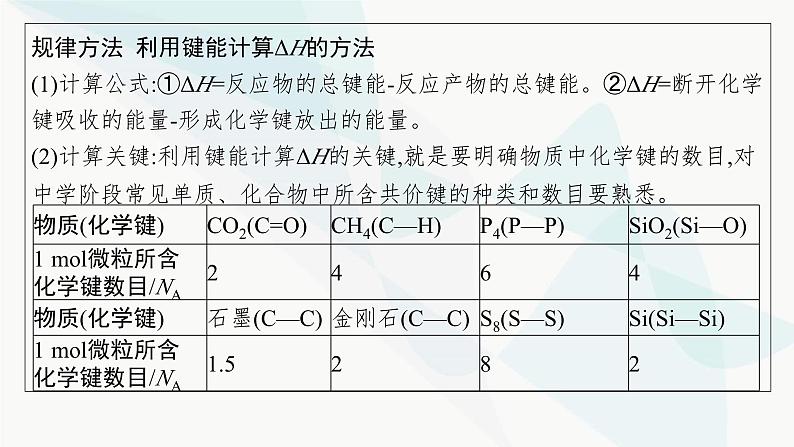
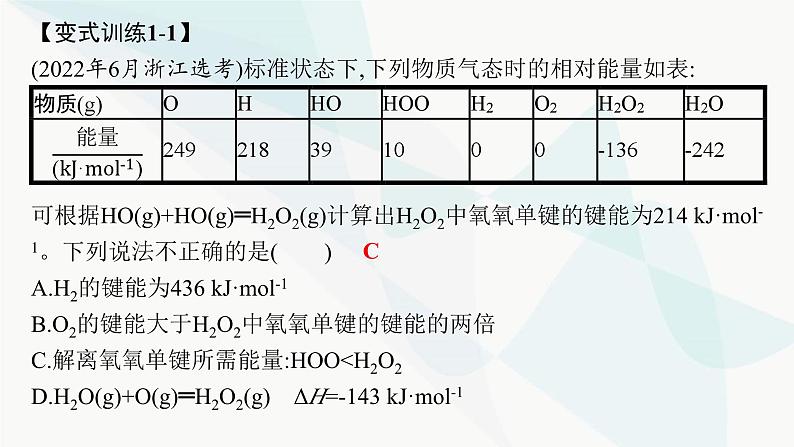
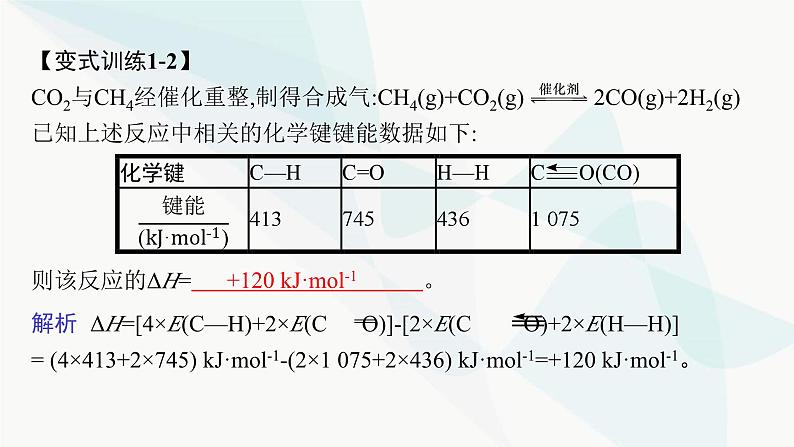
第1章 化学反应与能量转化章 末 整 合☞突破1 焓变(ΔH)的计算利用键能计算ΔH或根据盖斯定律计算、比较ΔH是近几年全国卷命题的必考点,特别是将热化学方程式和盖斯定律的应用融合在一起的试题,很好地考查了考生对所学知识的灵活应用和运算能力。正确计算ΔH的关键是合理设计反应途径。高考考法一 利用键能计算ΔH典例1 (2020天津化学,10)理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( )A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·mol-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热D解析 根据图示,HCN的相对能量低于HNC的相对能量,故HCN较稳定,A项正确;HCN(g) HNC(g)为吸热反应,ΔH=+59.3 kJ·mol-1,B项正确;根据图示可知,正反应的活化能明显大于逆反应的活化能,C项正确;使用催化剂,可以改变反应的活化能,但不能改变反应热,D项错误。规律方法 利用键能计算ΔH的方法(1)计算公式:①ΔH=反应物的总键能-反应产物的总键能。②ΔH=断开化学键吸收的能量-形成化学键放出的能量。(2)计算关键:利用键能计算ΔH的关键,就是要明确物质中化学键的数目,对中学阶段常见单质、化合物中所含共价键的种类和数目要熟悉。【变式训练1-1】(2022年6月浙江选考)标准状态下,下列物质气态时的相对能量如表:可根据HO(g)+HO(g)═H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-1。下列说法不正确的是( )A.H2的键能为436 kJ·mol-1B.O2的键能大于H2O2中氧氧单键的键能的两倍C.解离氧氧单键所需能量:HOO






